鮑魚腹足肌原纖維蛋白的組成及其性質
王 耀 耀, 朱 蓓 薇, 董 秀 萍, 葉 文 秀, 肖 桂 華
(大連工業大學 食品學院,遼寧 大連 116034)
0 引 言
鮑魚屬軟體動物門、腹足綱、鮑科,其營養豐富、味道鮮美,具有很高的食用價值。鮑魚的可食用部分主要是腹足,腹足中與殼肌相連的中間部位肌原纖維含量較高,而腹足邊緣部位膠原蛋白的含量相對較高[1]。關于蛋白質的研究表明,肌原纖維蛋白是一類以鹽溶性蛋白為主的蛋白質群,是具有重要生物學功能的結構蛋白質,與肉制品的流變學特性如保水性、彈性、質地等有著密切的關系[2]。另據報道,濁度可以反映蛋白質的聚集程度。溶液中蛋白質聚集形成顆粒的數目越多、體積越大,濁度就越大[3]。肌原纖維蛋白的聚集程度影響其形成凝膠的結構[4],進而影響肉類產品的品質。蛋白質的溶解度影響其熱誘導凝膠性質、起泡性以及肉品的保水性[5],同時溶解度可作為制品過熟程度的判斷指標[6]。溶液的溫度、pH 和離子強度能夠影響蛋白質的聚集程度和溶解度,進而影響其功能性質和加工特性。由于鮑魚腹足中肌原纖維蛋白含量很高,其性質與鮑魚產品的品質有直接關系,因此,對其性質進行研究有重要意義,但關于鮑魚腹足肌原纖維蛋白性質的研究國內外未見報道。本文將研究鮑魚腹足肌原纖維蛋白所包含蛋白質的種類,并考察溫度、pH 以及離子強度對鮑魚腹足肌原纖維蛋白溶液濁度和溶解度的影響,以期對鮑魚的加工以及鮑魚產品開發提供理論依據。
1 實 驗
1.1 實驗材料
鮮活皺紋盤鮑,(75±5)g,購于大連長興海鮮市場。
化學試劑與標準蛋白:磷酸二氫鈉、磷酸氫二鈉、氯化鈉、二硫蘇糖醇(DTT)、無水硫酸銅、氫氧化鈉、酒石酸鉀鈉等均為分析純;蛋白質分子質量標準品,寶生物工程(大連)有限公司。
1.2 主要儀器與設備
T25數顯勻漿機,德國IKA;Z-323K 冷凍離心機,德國HERMLE;UV-2100型紫外可見分光光度計,尤尼柯(上海)儀器有限公司;pH 計,上海鵬順科學儀器有限公司;HH-4數顯恒溫水浴鍋,江蘇省金壇市榮華儀器制造有限公司;JM-250型電泳儀,大連捷邁科貿有限公司。
1.3 實驗方法
1.3.1 鮑魚腹足肌原纖維蛋白的提取方法
鮑魚腹足肌原纖維蛋白的提取參照Paredi等[7]的方法進行改進。將鮑魚去殼、去內臟,取腹足閉殼肌及其相連部分洗凈,切碎,打漿30s,加入其20~30 倍體積(mL/g)的水洗液(40 mmol/L NaCl,0.5 mmol/L DTT,1 mmol/L MgCl2,10mmol/L 的 磷 酸 鹽 緩 沖 液pH 7.0),在5 000r/min勻漿4min。為了防止勻漿液過熱,每勻漿40s暫停20s。所得勻漿物在10 000r/min(4℃)離心5min。將所得沉淀按照上述步驟再重復處理兩次,向第3次所得沉淀中加入10倍體積(mL/g)的提取液(0.6mol/L NaCl,10mmol/L 的磷酸鹽緩沖液pH 7.0),4 000r/min勻漿4min,然后勻漿物在13 500r/min(4 ℃)離心25 min,所得上清即為鮑魚腹足肌原纖維蛋白溶液。
1.3.2 蛋白質質量濃度的測定方法
雙縮脲法[8]測定蛋白質質量濃度,用牛血清蛋白(BSA)作為標準蛋白。
1.3.3 鮑魚腹足肌原纖維蛋白的SDS-PAGE方法
參照Laemmli[9]的方法對鮑魚腹足肌原纖維蛋白進行SDS-PAGE 分析。將鮑魚腹足肌原纖維蛋白與樣品緩沖溶液按體積比1∶1 混合,100℃水浴加熱5min。選取12%的分離膠和5%的濃縮膠。電泳時初始電壓為90V,當樣品前沿剛好進入分離膠后將電壓提高到120V,電泳時間約3h。使用Gel-Pro analyzer 4軟件分析電泳圖像。
1.3.4 鮑魚腹足肌原纖維蛋白的熱處理方法
將一定量的肌原纖維蛋白溶液加入到配有旋蓋的玻璃試管中,旋緊旋蓋后置于水浴鍋中加熱。用溫度計檢測試管中心溫度,控制升溫速率為1 ℃/min,使樣品的溫度從30 ℃升高到90 ℃。考察溫度點為30、40、50、60、70、80和90℃,當溫度達到相應值時立即取出試管并流水冷卻。
1.3.5 濁度測定方法
參照文獻[10]的方法,調整肌原纖維蛋白質質量濃度為2.0mg/mL,在不同條件處理后靜置過夜,測定A350。
1.3.6 溶解度測定方法
測定濁度后的蛋白溶液在4 ℃、13 500r/min下離心25min,參照文獻[11]的方法測定蛋白溶解度。
2 結果與討論
2.1 鮑魚腹足肌原纖維蛋白的SDS-PAGE結果
通過SDS-PAGE 可知鮑魚腹足肌原纖維蛋白主要含有肌球蛋白重鏈(201ku)、副肌球蛋白(96 ku)、肌 動 蛋 白(46 ku)和 原 肌 球 蛋 白(38ku),質 量 分 數 分 別 為21.7%、35.8%、27.4%和6.6%,如圖1 所示。此結果與Ehara等[12]對鮑魚腹足肌原纖維蛋白的研究結果接近。另外,鮑魚腹足肌原纖維蛋白與脊椎動物[13-14]肌原纖維蛋白相比副肌球蛋白含量相對較高,這可能與物種差異有關。

圖1 鮑魚腹足肌原纖維蛋白的組成Fig.1 The composition of abalone myofibrillar protein
2.2 溫度對鮑魚腹足肌原纖維蛋白濁度和溶解度的影響
在緩沖液pH 為7.0,離子強度為0.6mol/L(NaCl),蛋白質質量濃度為2.0 mg/mL 的條件下考察溫度對鮑魚腹足肌原纖維蛋白濁度和溶解度的影響,見圖2。
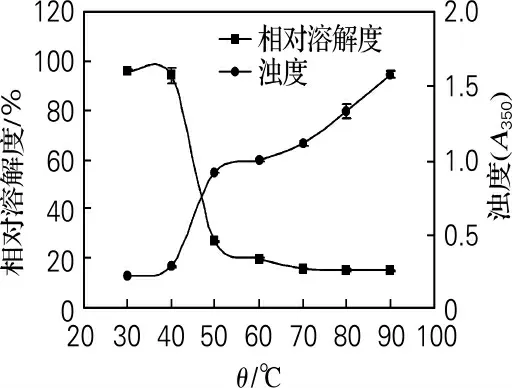
圖2 溫度對鮑魚腹足肌原纖維蛋白濁度和溶解度的影響Fig.2 Effect of heating temperature on turbidity and solubility of abalone myofibrillar protein
從圖2可知,鮑魚腹足肌原纖維蛋白的濁度隨加熱溫度升高而上升。30~40 ℃時,鮑魚腹足肌原纖維蛋白的濁度基本保持不變,說明蛋白還沒有發生明顯變性聚集。40~50 ℃時濁度明顯上升,說明蛋白變性聚集程度急劇增加。Paredi等[15]報道扇貝肌球蛋白的變性溫度為41.7~55.0 ℃,因此鮑魚肌原纖維蛋白濁度在40 ℃時開始增加可能是由于肌球蛋白的變性聚集引起。溫度達到50 ℃時,濁度(A350)達到1.0,說明溶液中已經產生明顯的蛋白聚集物。50~90 ℃時,隨加熱溫度升高濁度緩慢上升,說明蛋白聚集物的結構變得致密。因此,當升溫速率一定時,聚集物生成過程中濁度的上升較聚集物結構變得致密過程中濁度的上升更為明顯。
30~40 ℃時,鮑魚腹足肌原纖維蛋白溶解度變化不明顯,說明蛋白幾乎沒有發生變性。40~50 ℃時,溶解度急劇降低,說明蛋白急劇變性。50~90 ℃時,隨加熱溫度升高溶解度緩慢降低,說明部分未變性的蛋白緩慢變性。加熱促使鮑魚肌原纖維蛋白空間結構發生變化,疏水基團暴露,暴露的疏水基團發生聚集,從而導致蛋白沉淀、溶解度降低。
2.3 pH 對鮑魚腹足肌原纖維蛋白濁度和溶解度的影響
在離子強度為0.6 mol/L(NaCl),蛋白質質量濃度為2.0 mg/mL,溫度為室溫下(20~25 ℃)考察pH 對鮑魚腹足肌原纖維蛋白濁度和溶解度的影響,見圖3。從圖3 可知,當pH 在4.0、4.5和5.0時,鮑魚腹足肌原纖維蛋白溶液濁度較大(A350>1.3)且有波動,說明蛋白發生了明顯聚集而且聚集物的結構不均勻,費英等[4]同樣發現在酸性條件下肌原纖維蛋白形成的凝膠不均勻且存在聚合物。pH 在5.5~6.0時蛋白濁度急劇下降,說明蛋白的聚集程度也急劇下降。pH 高于6.0時,蛋白基本沒發生聚集,因此濁度較低且變化不明顯。鮑魚腹足肌原纖維蛋白在堿性和中性條件下基本不發生聚集,在酸性條件下聚集程度較大,pH 在5.5時聚集程度最大。
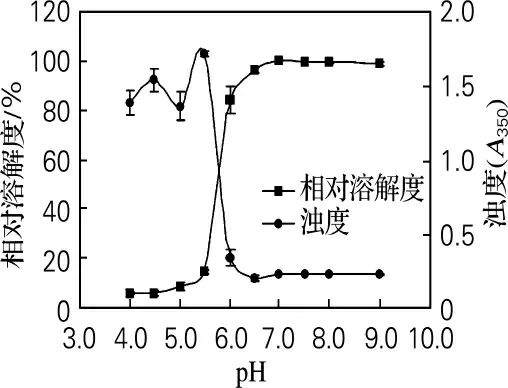
圖3 pH 對鮑魚腹足肌原纖維蛋白濁度和溶解度的影響Fig.3 Effect of pH on turbidity and solubility of abalone myofibrillar protein
pH 低于5.5 時,鮑魚腹足肌原纖維蛋白的溶解度較低,且隨pH 升高溶解度變化不明顯;pH 從5.5升高到6.0的過程中,溶解度急劇升高;pH 超過6.5以后,溶解度變化不大。通常當溶液的pH 靠近蛋白質等電點時,蛋白質所帶凈電荷減少、溶解度明顯降低,另外pH 對豬肉[16]、魚肉[17]的肌球蛋白二級結構變化有不同程度的影響,因此當溶液的pH 從6.0降低到5.5時,鮑魚腹足肌原纖維蛋白所帶凈電荷和空間結構發生變化,導致溶解度降低。
2.4 離子強度對鮑魚腹足肌原纖維蛋白濁度和溶解度的影響
在pH 為7.0,蛋白質質量濃度為2.0mg/mL,溫度為室溫(20~25 ℃)下考察離子強度(NaCl)對鮑魚腹足肌原纖維蛋白濁度和溶解度的影響,見圖4。從圖4可知,離子強度從0.2 mol/L 升高到0.4mol/L的過程中,鮑魚腹足肌原纖維蛋白的濁度急劇下降;當離子強度大于0.4 mol/L時,隨離子強度的增加濁度變化不明顯。濁度的降低反映了蛋白質聚集程度的降低,因此鮑魚肌原纖維蛋白在低離子強度下容易發生聚集,在高離子強度下聚集程度較低或者基本不發生聚集,這與徐幸蓮等[11]對兔骨骼肌肌球蛋白溶液濁度的研究結果一致。
離子 強 度 從0.2 mol/L 升 高 到0.4 mol/L時,鮑魚腹足肌原纖維蛋白的溶解度急劇升高;當離子強度大于0.4mol/L 時,隨離子強度增加溶解度變化不明顯。這與韓敏義等[18]研究兔肌球蛋白獲知的溶解度變化趨勢有相似性。
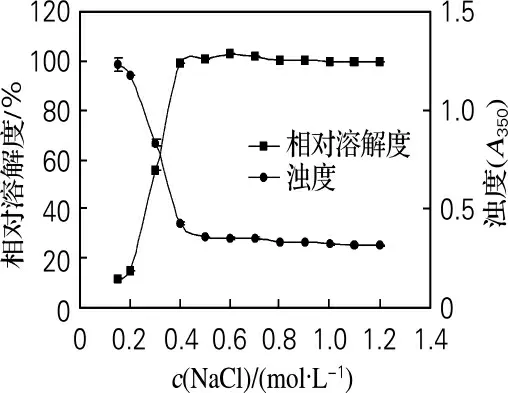
圖4 離子強度對鮑魚腹足肌原纖維蛋白濁度和溶解度的影響Fig.4 Effect of ionic strength on turbidity and solubility of abalone myofibrillar protein
3 結 論
(1)鮑魚腹足肌原纖維蛋白主要由肌球蛋白、副肌球蛋白、肌動蛋白和原肌球蛋白組成,其中副肌球蛋白含量相對較高。
(2)鮑魚腹足肌原纖維蛋白溶液濁度隨溫度升高而上升,隨pH 和離子強度的升高而下降;溶解度隨溫度升高而降低,隨pH 和離子強度的升高而升高。
(3)當 溶 液pH 高 于6.0,離 子 強 度 大 于0.4mol/L時,鮑魚腹足肌原纖維蛋白溶解度較高。當溫度高于50℃時,鮑魚腹足肌原纖維蛋白溶解度較低。
[1]OLEACHEA R P,USHIO H,WATABE S,et al.Toughness and collagen content of abalone muscles[J].Bioscience,Biotechnology,and Biochemistry,1993,57:6-11.
[2]ASGHAR A,SAMEJIMA K,YASUI T,et al.Functionality of muscle proteins in gelation mechanisms of structured meat products[J].Critical Reviews in Food Science and Nutrition,1985,22(1):27-106.
[3]THORARINSDOTTIR K A,ARASON S,GEIRSDOTTIR M B,et al.Changes in myofibrillar proteins dsuring processing of salted cod(Gadus morhua)as determined by electrophoresis and differential scanning calorimetry[J].Food Chemistry,2002,77(3):377-385.
[4]費英,韓敏義,楊凌寒,等.pH 對肌原纖維蛋白二級結構及其熱誘導凝膠特性的影響[J].中國農業科學,2010,43(1):167-170.
[5]VANI B,ZAYAS J F.Foaming properties of selected plant and water retention[J].Food Science,1996,60(4):1025-1028.
[6]丁麗敏,計成,戎易,等.蛋白溶解度作為評定豆粕過熟程度指標的研究[J].飼料工業,1997,18(6):34-37.
[7]PAREDI M E,de MATTIO N D V,CRUPKIN M.Biochemical properties of actomyosin of cold stored striated adductor muscles of Aulacomya ater ater(Molina)[J].Journal of Food Science,1990,55:1567-1570.
[8]袁道強,黃建華.生物化學實驗和技術[M].北京:中國輕工業出版社,2006:183-184.
[9]LAEMMLI U K.Cleavage of structural proteins during the assembly of the head of bacteriophage T4[J].Nature,1970,227:680-685.
[10]LIU M N,FOEFEDING E A,WANG S F,et al.Denaturation and aggregation of chicken myosin isoforms[J].Journal of Agricultural and Food Chemistry,1996,44:1435-1440.
[11]徐幸蓮,韓敏義,林麗君,等.兔骨骼肌肌球蛋白溶液濁度和溶解度研究[J].南京農業大學學報,2003,26(4):93-96.
[12]EHARA T,NAKAGAWA K,TAMIYA T,et al.Effect of paramyosin on invertebrate natural actomyosin gel formation[J].Fisheries Science,2004,70(2):306-313.
[13]OKITANI A,ICHINOSE N,ITOH J,et al.Liberation of actin from actomyosin in meats heated to 65 ℃[J].Meat Science,2009,81(3):446-450.
[14]MOHAN M,RAMACHANDRAN D,SANKAR T V,et al.Physicochemical characterization of muscle proteins from different regions of mackerel[J].Food Chemistry,2008,106:451-457.
[15]PAREDI M E,TOMAS M C,CRUPKIN M.Thermal denaturation of myofibrillar proteins of striated and smooth adductor muscles of scallop (Zygochlamys patagonica).A differential scanning calorimetric study[J].Journal of Agricultural and Food Chemistry,2002,50:830-834.
[16]LIU Ru,ZHAO Si-ming,XIONG Shan-bai,et al.Role of secondary structures in the gelation of porcine myosin at different pH values[J].Meat Science,2008,80:632-329.
[17]LIU Ru,ZHAO Si-ming,LIU You-ming,et al.Effect of pH on the gel properties and secondary structure of fish myosin[J].Food Chemistry,2010,121:196-202.
[18]韓敏義,徐幸蓮,林麗軍,等.兔骨骼肌肌球蛋白的純化及溶液濁度和溶解度研究[J].食品科學,2004,25(12):50-54.

