Br?nsted酸性離子液體合成及催化酯化反應應用*
張秀娟,羅華麗,劉建偉
(煙臺職業學院 食品與生化工程系,山東 煙臺 264670)
Br?nsted酸性離子液體合成及
催化酯化反應應用*
張秀娟,羅華麗*,劉建偉
(煙臺職業學院 食品與生化工程系,山東 煙臺 264670)
以芐基氯、N-乙基咪唑、濃硫酸為原料,成功合成出一種含有磺酸基的新型Br?nsted酸性離子液體,通過IR、1H NMR對其結構進行了表征。將其應用于催化乙酸和乙醇的酯化反應,考察其反應條件和循環使用性能。結果表明最佳反應條件為:反應時間90 min,催化劑用量5%,反應溫度80 ℃。此條件下產率為72.35%。離子液體循環使用4次,其催化效率穩定。
酸性離子液體; 合成; 乙酸乙酯; 催化
離子液體又稱室溫熔融鹽,是由有機陽離子和無機陰離子構成的、在室溫或近室溫下呈液態的鹽類。離子液體的種類比較多,經歷了對水敏感的氨鹽/三氯化鋁體系階段,對空氣、水穩定的六氟磷酸、四氟硼酸咪唑、吡啶鎓鹽體系階段,目前向功能化方向發展,成為可以設計的綠色溶劑/催化劑功能體系[1]。
乙酸乙酯是有機合成的重要原料,是應用最廣的脂肪酸酯之一。工業上通常使用濃硫酸作催化劑。由于濃硫酸存在一定的環境污染和對設備的腐蝕,近年來,出現了固體超強酸、雜多酸、強酸性陽離子交換樹脂等多種酯化催化劑[2-4]。但是這些催化劑的制備過程比較復雜,也有一定的局限性。因此,開發環境友好的酯化催化劑就顯得尤其重要。2002年Cole[5]等首次報道了Br?nsted酸性離子液體的合成,并成功地用于酯化、成醚等需要酸催化的合成反應,自此,Br?nsted酸性離子液體得到了廣泛研究和發展。酸性離子液體既具有酸高密度反應活性的優點[6],又具有不揮發、環境友好、酸強度分布均勻以及易循環使用等優點,具有替代濃硫酸作為酯化催化劑的潛力[7]。
本文設計合成了一種新型的Br?nsted酸性離子液體,其分子中陽離子部分含有磺酸基,陰離子為[HSO4]-,因此具有很強的酸性。酯化催化實驗結果表明該離子液體對乙酸乙酯的合成反應具有良好的催化性能。反應結束后,通過簡單的相分離就可以實現產物與離子液體的分離,分離后的離子液體經過真空脫水處理后可以重復使用。
1 實驗部分
1.1 主要儀器與試劑
Magana550型傅立葉紅外光譜儀(美國);Bruker Avance-400型核磁共振儀(瑞士);DF-101s集熱式恒溫加熱磁力攪拌器;DZF-6021型真空干燥箱(上海)。
N-乙基咪唑(工業級,使用前干燥純化,收集104 ℃/2 kPa餾分),芐基氯,濃硫酸,冰醋酸,無水乙醇,乙酸乙酯,乙醚,碳酸鈉,氯化鈉,氯化鈣,無水硫酸鎂等均為市售分析純試劑。
1.2 酸性離子液體的合成
1.2.1 離子液體合成路線
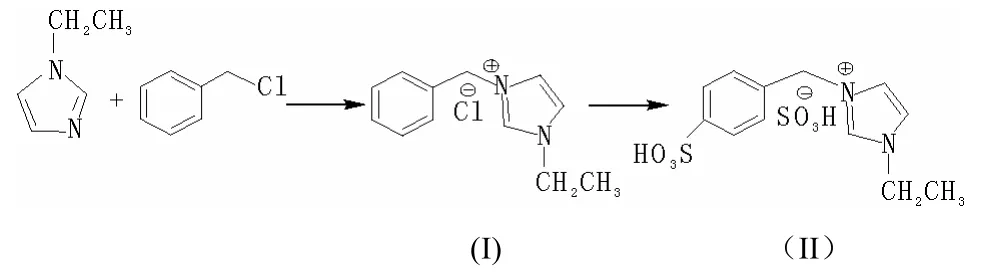
1.2.2 合成方法
100 mL三口燒瓶中加入15 mL甲苯、7.7 mL(0.08 mol)N-乙基咪唑、9.0 mL(0.08 mol)芐基氯,攪拌,80 ℃保溫24 h,傾倒出上層甲苯,用乙酸乙酯洗滌3次,80 ℃減壓蒸餾得到白色粘稠狀液體Ⅰ,產率為89.3%。
100 mL三口燒瓶置于冰水浴中,加入7 mL 98%的濃硫酸,攪拌,將氯化物緩慢滴入三口瓶中,保持反應溫度為40 ℃,24 h反應結束,用乙醚洗滌除去多余的硫酸,減壓蒸餾得到淡紅色粘稠狀液體Ⅱ(即Br?nsted酸性離子液體),產率為87.2%。IR(KBr),ν(cm-1):3 132(磺酸基中的—OH),3 074(芳環C—H);1 557,1 499,1 447(苯環骨架);1 260,1 023(SO2);852(苯環C—H變形振動);657(S—O)。1H NMR(D2O),δ:1.37(m,3H,CH3);3.91—4.29(m, N—CH2);5.25(s,2H,Ph—CH2);7.33—7.43(m,6H,Ar—H);8.76(s,1H,咪唑環上的氫)。
1.3 離子液體溶解性的測定
分別取一定量的離子液體,加入5 mL不同的溶劑,進行溶解性能測試[8]。
1.4 離子液體催化酯化反應[9-11]
150 mL三口燒瓶中加入適當比例的冰醋酸、無水乙醇及離子液體,混合搖勻,在一定溫度下攪拌反應1~4 h,反應結束后改為蒸餾裝置,直至在沸水浴上不再有餾出物為止,得到粗乙酸乙酯。在搖動下向餾出液中慢慢加入飽和碳酸鈉水溶液直至不再有氣泡冒出,有機相對pH試紙呈中性為止。將液體轉入分液漏斗中,分去水相,有機相依次用飽和氯化鈉溶液、飽和氯化鈣溶液洗滌2次,棄去下層液,酯轉入干燥的錐形瓶用無水硫酸鎂干燥,將干燥后的乙酸乙酯濾入蒸餾瓶中,在水浴上進行蒸餾,收集73~78 ℃餾分。最后稱重計算產率。每次反應完畢后催化劑經過適當的洗滌和真空脫水后可重復使用。
2 結果與討論
2.1 離子液體譜圖分析
通過紅外譜圖可以觀察到化合物Ⅱ中有苯環骨架振動吸收:1 557 cm-1,1 499 cm-1,1 447 cm-1;2 984(芳環C—H伸縮振動);同時也觀察到了磺酸基團的振動吸收:1 260 cm-1,1 023 cm-1(SO2),657 cm-1(S—O)。由于化合物Ⅰ中的乙基咪唑環已經帶有正電荷,電子密度小,所以在磺化時磺酸基應引入到苯環上,譜圖中852 cm-1處出現的吸收峰為苯環上對位取代后2個鄰接氫的振動吸收。再結合核磁共振氫譜的結果,芳氫的數目與二取代后芳氫的數目相一致,進一步證實了磺酸基是連在苯環上,因此可以確定目標化合物的結構是正確的。
2.2 離子液體溶解性的測定
溶解性測定結果表明該離子液體溶于水、乙酸,常溫下微溶于乙醇,不溶于乙酸乙酯和乙醚,其在極性較大并具有氫鍵的溶劑中具有較好的溶解性(見表1)。
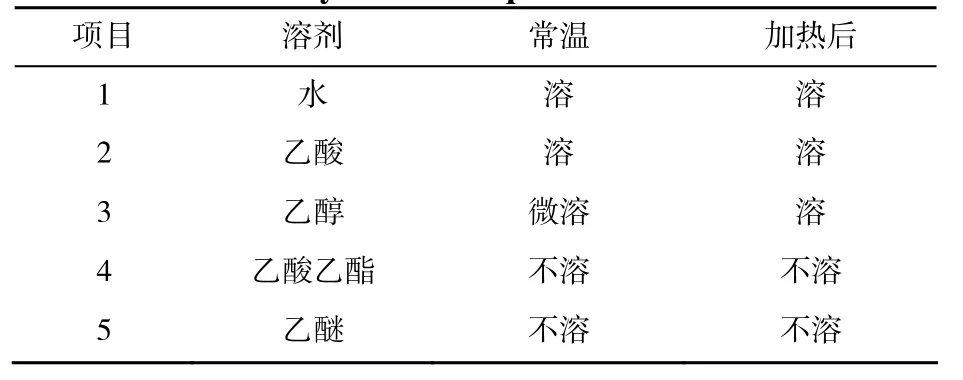
表1 離子液體在不同溶劑中的溶解性Table 1 Solubility of ionic liquid in different solvents
溶解性實驗結果表明該離子液體應用于乙酸乙酯的合成反應時,反應為均相催化。反應過程中生成的產物和離子液體自動分層,有利于正反應的進行。反應結束后,離子液體只需經過簡單的相分離和減壓蒸餾就可以回收利用。
2.3 離子液體催化乙酸乙酯合成
2.3.1 催化劑用量對乙酸乙酯產率的影響
首先考察了離子液體用量對酯化反應的影響,與濃硫酸作催化劑進行了比較。
在固定乙酸與無水乙醇的物質的量比為1︰1.5,回流時間為90 min,反應溫度為80 ℃的條件下,離子液體的用量對乙酸乙酯的產率影響見圖1,催化劑用量按總投料的摩爾百分比計算。單獨使用濃硫酸作催化劑時乙酸乙酯的產率為44.59%。
由圖1可以看出,離子液體對乙酸乙酯的合成有明顯的催化作用,且隨著催化劑用量的增多,乙酸乙酯的產率有增加的趨勢,當催化劑用量超過5%時,再增加催化劑用量,產率提高不明顯。因此,本實驗選擇催化劑最佳用量為5%,此時乙酸乙酯的產率為72.35%,與單獨使用濃硫酸作催化劑相比產率提高27.76%。
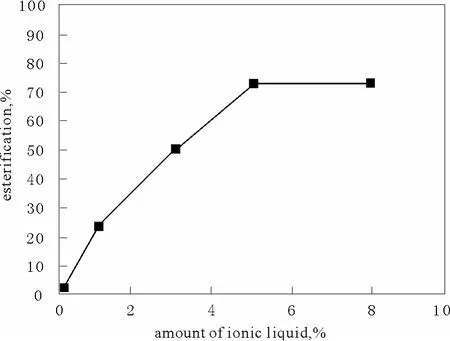
圖1 催化劑用量對酯化產率的影響Fig.1 Esterification yields under different catalyst dosage
2.3.2 反應溫度對乙酸乙酯產率的影響
在固定離子液體用量為5%,反應時間90 min,乙酸用量11.4 mL,乙醇用量17.4 mL ,考察不同反應溫度對酯化反應的實驗結果見圖2。
從圖2可以看出,升高反應溫度可以提高乙酸乙酯的產率,但當反應溫度由60 ℃上升到80 ℃時,產率提高并不明顯,說明在接近回流溫度時反應逐漸趨于平衡,因此,本實驗選擇最佳反應溫度為回流溫度80 ℃。
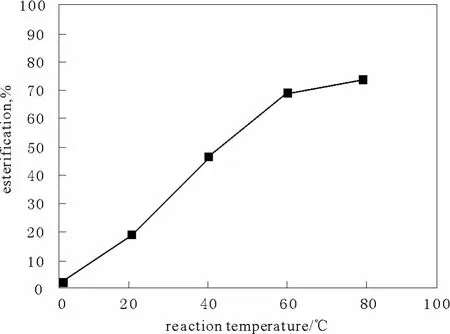
圖2 反應溫度對酯化產率的影響Fig.2 Esterification yields under different reaction temperatures
2.3.3 反應時間對乙酸乙酯產率的影響
從表2可以看出,隨著反應時間的增加,酯化產率逐漸升高,但當反應超過90 min時,延長反應時間,產率變化不大,說明此時酯化反應趨于平衡。從能耗角度考慮,選擇反應時間90 min為最佳反應時間。
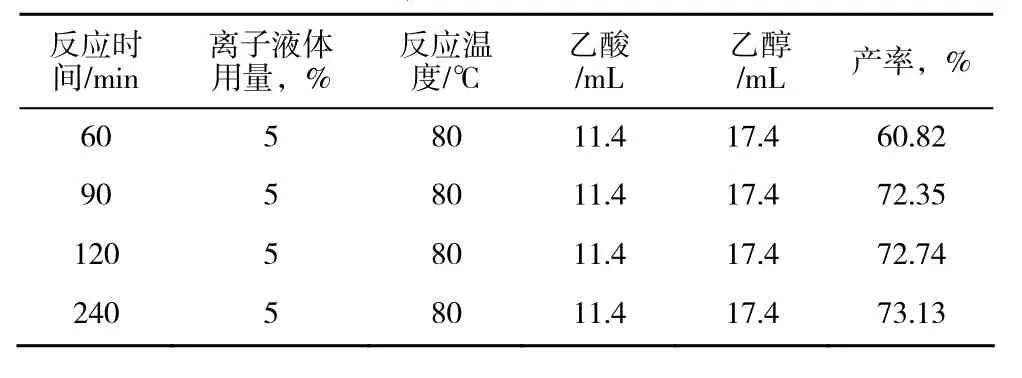
表2 反應時間對酯化產率的影響Table 2 Esterification yields under different reaction times
2.3.4 離子液體循環使用性能
循環使用性能是離子液體的一個重要特點,因此本實驗也考察了離子液體循環使用的催化情況,結果見表3。
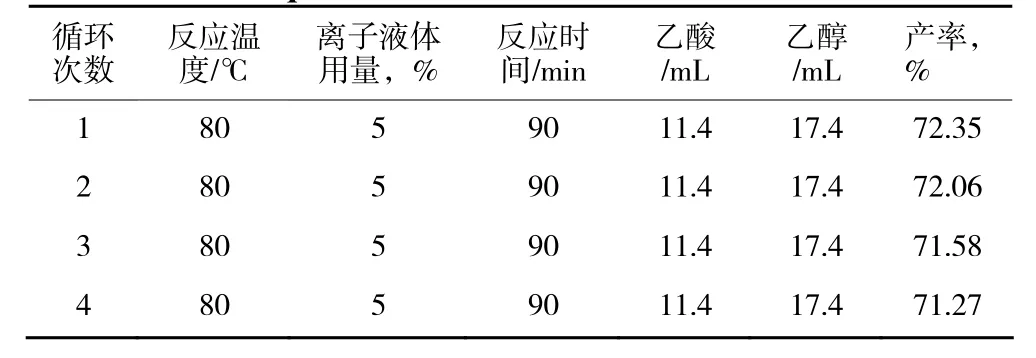
表3 離子液體的循環使用結果Table 3 Esterification yields under different reuse times of ionic liquid
從表3中可以看出,離子液體重復使用4次,酯化反應產率變化不大,說明該離子液體具有良好的循環使用性能。乙酸乙酯的產率略有下降可能是由于在循環使用中的少量損失或脫水不完全所致。
3 結 論
通過兩步反應合成了一種新型含磺酸基的酸性離子液體,IR和1H NMR分析確認了其結構。對乙酸乙酯的催化合成研究表明,該離子液體具有明顯的催化作用,在離子液體用量為5%,反應時間90 min,溫度80 ℃,n(乙酸)/n(乙醇)=1︰1.5的條件下,酯化產率可達72.35%。與傳統的濃硫酸作催化劑相比,酯化產率提高27.76%,且催化劑用量少,反應后的離子液體易于分離。分離后的離子液體重復使用4次,催化活性基本保持不變。
[1] 顧彥龍, 石峰, 鄧友全. 室溫離子液體: 一類新型的軟介質和功能材料[J]. 科學通報, 2004, 49(6):515-521.
[2] 張小曼. 稀土固體超強酸對合成乙酸乙酯的催化性能研究[J]. 化學試劑, 2002, 24(4): 233-234.
[3] 王新平, 葉興凱, 吳越, 等. 用雜多酸固載化催化劑催化酯化反應[J].精細石油化工, 1994(2):15-20.
[4] 楊亞婷, 趙維, 劉靜, 等. Lewis 固體酸催化合成乙酸乙酯的研究[J].應用化工, 2003, 32 (6):23-24.
[5] Cole A C, Jensen J L, Ntai I, et al. Novel Br?nsted acidic ionic liquids and their use as dual solvent-catalysts[J]. J Am Chem Soc ,2002, 124:5962-5963.
[6] 吳芹, 董斌琦, 韓明漢, 等. 新型Br?nsted酸性離子液體的合成與表征[J]. 光譜學與光譜分析, 2007, 20(10):2027-2031.
[7] 黃寶華, 汪艷飛, 杜志云, 等. 酸性離子液體的合成和光譜表征[J].分析測試學, 2007, 26(4):478-483.
[8] 葉天旭, 張予輝, 劉金河, 等. 烷基咪唑類室溫離子液體的合成及其溶解性能研究[J]. 現代化工, 2003, 1:15-18.
[9] 王清廉, 沈鳳嘉. 有機化學實驗[M]. 北京: 高等教育出版社, 2003:160-162.
[10] 唐曉麗, 王少君, 魏莉, 等. 咪唑類離子液體催化合成乙酸乙酯的研究[J]. 大連輕工業學院學報, 2007, 26(2):140-142.
[11] 郝巍, 李存雄. 離子液體在酯化反應中的應用[J]. 貴州師范大學學報, 2006, 24(4): 117-120.
Synthesis of Br?nsted Acid Ionic Liquid and Application in Catalytic Synthesis of Ethyl Acetate
ZHANG Xiu-juan,LUO Hua-li*,LIU Jian-wei
(Department of Food and biochemical Engineering,Yantai Vocational College,Shandong Yantai 264670,China)
A novel Br?nsted acid ionic liquid was synthesized by using benzyl chloride, N-diethyl imidazole and sulfuric acid as materials. Its structure was characterized by IR and 1H NMR. Catalytic activity of the acidic ionic liquids for the esterification of acetic acid with ethanol was measured.The results show that the best reaction conditions are as follows:catalyst dosage 5%,reaction temperature 80℃ and reaction time 90 min.Under above conditions,the yield of ethyl acetate can reach 72.35%. The ionic liquid can be reused for more than four times without remarkable loss of catalytic activity.
Acidic ionic liquids; Synthesis; Ethyl acetate; Catalysis
O 621
A
1671-0460(2011)01-0018-04
山東省高等學校科技計劃項目,項目編號:J10LB69
2010-11-12
張秀娟(1963-),女,山東蓬萊人,副教授,1986年畢業于山東師范大學化學專業,研究方向:從事有機合成及化學教育研究。E-mail:xiuxiu12885@163.com,電話:0535-6927262。
羅華麗(1978-),女,講師,碩士,研究方向:精細化工和醫用高分子。E-mail:luohuali@sohu.com,電話:0535-6927023。

