二氧化錳納米棒的制備和催化性能研究
李秀萍,趙榮祥
(1.遼寧石油化工大學化學與材料學院,遼寧 撫順 113001,2.遼寧石油化工大學石油化工學院,遼寧 撫順 113001)
二氧化錳納米棒的制備和催化性能研究
李秀萍1,趙榮祥2
(1.遼寧石油化工大學化學與材料學院,遼寧 撫順 113001,2.遼寧石油化工大學石油化工學院,遼寧 撫順 113001)
采用水熱法 140 ℃下制備了二氧化錳的棒狀結構。XRD和掃描電子顯微鏡研究了二氧化錳的晶相和形貌,對棒狀二氧化錳降解品紅催化性能進行了測試,實驗表明,催化劑的加入量,雙氧水的加入量和溶液的pH值對品紅的脫色效果產生重要的影響,在催化劑的加入量為0.02 g時,雙氧水的加入量為4 mL,溶液的pH值為6.2時有較佳的脫色效果。
二氧化錳;水熱;催化劑;品紅
氧化錳納米材料由于具有許多特殊的物理和化學性質, 使其在子篩、分子篩、催化材料、鋰離子二次電池的正極材料和新型磁性材料等催化、電化學、吸附和磁性質等應用領域顯示了廣闊的前景[1-3]。因而采用不同的方法制備氧化錳納米材料成為研究的熱點。
晶體的形貌主要取決于各個晶面能的大小和其所處的生長環境的影響,晶面能高的晶面生長速率高并最終消失掉,最終保留下品面能低的晶面,通常采用的改變晶體的生長環境的辦法來獲的不同形貌的納米材料。目前可以加入不同的修飾劑來改變晶體的生長環境,如:無機離子[4-5]、表面活性劑[6-7]、有機小分子以及溶劑[8-9]等。不同修飾劑的加入對于晶體的形成固然有好處,但也增加了后處理的困難,還有可能造成環境污染。在本文中,我們不添加任何的表面修飾劑僅以高錳酸鉀和硫酸銨作為反應物合成了棒狀的二氧化錳,并對其催化降解品紅的性能進行考察。我們不添加任何的表面修飾劑僅以高錳酸鉀和硫酸銨作為反應物合成了棒狀的二氧化錳,并對其催化降解品紅的性能進行考察。
1 實驗部分
1.1 試劑及儀器
反應中所使用的試劑 KMnO4和(NH4)2SO4均為分析純。
采用X射線衍射儀(D8 Advance Bruker全自動衍射儀,功率為40 kV,40 mA,選用CuKa輻射,λ= 0.154 06 nm,采用連續掃描方式收集衍射數據,階寬0.02°,步掃時間為0.5 s)分析產物的物相組成及結構;采用掃描電子顯微鏡 (SEM, AMRAY 1840,加速電壓15 kV)觀察產物的形貌及分散情況。
1.2 MnO2納米棒的合成方法
取 1 mmol(0.158 g)KMnO4和 1 mmol(0.079 g)(NH4)2SO4溶解到 50 mL蒸餾水中形成均勻混合液,然后倒入到聚四氟乙烯的水熱釜內,140 ℃下加熱24 h,產品經去離子水和無水乙醇洗滌幾遍,60 ℃下加熱烘干6 h。
1.3 納米MnO2的催化活性測定
稱取一定量的MnO2樣品置于250 mL錐形瓶中,然后加入一定濃度的酸性品紅溶液和H2O2溶液, 在磁力攪拌下反應。于不同反應時間下取樣, 經離心分離后移取上層清液, 用721型可見分光光度計在酸性品紅最大吸收波長546 nm處測其吸光度。
2 結果與討論
2.1 二氧化錳納米棒結構與形貌表征
圖1為所制備的納米棒的XRD圖譜,所有的衍射峰都和(JCPDS No.44—0l41) 完全符合,主峰較為尖銳且強度較大,說明所制備的產物為純相MnO2,而且結晶度良好。
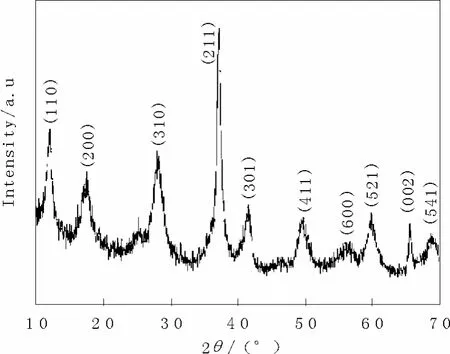
圖1 二氧化錳的XRDFig.1 XRD of manganese dioxide
圖2為氧化錳納米棒的照片,從照片可以看出,納米棒是有部分的聚集,但是整體上是棒狀結構。

圖2 二氧化錳的棒狀結構Fig.2 Rod structure of manganese dioxide
2.2 二氧化錳納米棒的催化性能
2.2.1 催化劑加入量對脫色率的影響
在 H2O2加入量為3 mL、酸性品紅濃度為 36 mg/L的反應條件下,測定不同催化劑用量對酸性品紅脫色率的影響,結果如圖3 所示。
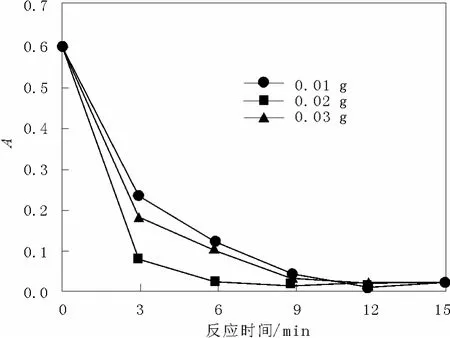
圖3 催化劑添加量對吸光值的影響Fig.3 Effect of catalyst dosage on the absorbance
圖3顯示了在反應體系中分別加入0.01,0.02,0.03 g MnO2納米棒催化過氧化氫降解酸性品紅曲線。酸性品紅的吸光度隨著催化劑用量的增加而下降, 但是當催化劑用量達到0.03 g 時, 酸性品紅的吸光度反而降低。在體系中加入 0.03 g 催化劑時,反應的初期可以明顯的觀察到體系中有大量的 O2逸出, O2不能使酸性品紅分子發生明顯的氧化降解。所以當增加催化劑用量時, 在相同的時間里消耗 H2O2產生 O2反而不利于酸性品紅分子發生氧化降解。宋等人[10]利用吸附-氧化降解-解吸的過程對 MnO2納米棒促進甲基藍氧化降解進行了解釋,我們認為, MnO2納米棒催化過氧化氫降解酸性品紅的催化反應機制同樣可能符合吸附-氧化降解-解吸機制。首先, H2O2和酸性品紅被吸附到 MnO2納米棒表面; 第二步H2O2被MnO2納米棒表面的活性中心催化分解為 OH·、HOO·和 O2-·自由基, 這些初生的自由基一部分在催化劑表面擴散并且和吸附的酸性品紅分子反應使其氧化降解, 另一部分自由基從催化劑表面解吸并擴撒到溶液中與溶液中的酸性品紅反應, 氧化降解酸性品紅; 最后, 催化劑表面吸附的酸性品紅氧化降解后的小分子從MnO2納米棒表面解吸進入溶液, 使催化劑表面的活性位恢復。上述酸性品紅在催化劑表面和液相的降解機制與過量的催化劑反而使酸性品紅的降解率下降這一實驗結果相符合。過量的催化劑使大量H2O2分解產生OH·、HOO·和O2-·自由基, 自由基活性高, 相互作用而終止并生成O2, O2不能使酸性品紅分子發生氧化降解。
2.1.2 H2O2用量對脫色率的影響
在酸性品紅濃度為 36 mg/L、催化劑用量為0.013 4 g的反應條件下,溶液的pH值不變的條件下,考察H2O2(質量分數30%)用量對酸性品紅脫色效果的影響。如圖4顯示了反應體系中H2O2用量分別為1,2,3 mL時的吸光度曲線,實驗表明,隨著雙氧水加入量的增加,反應最初的吸光值先下降后上升,顯然過多的雙氧水的加入量不利于酸性品紅的降解。
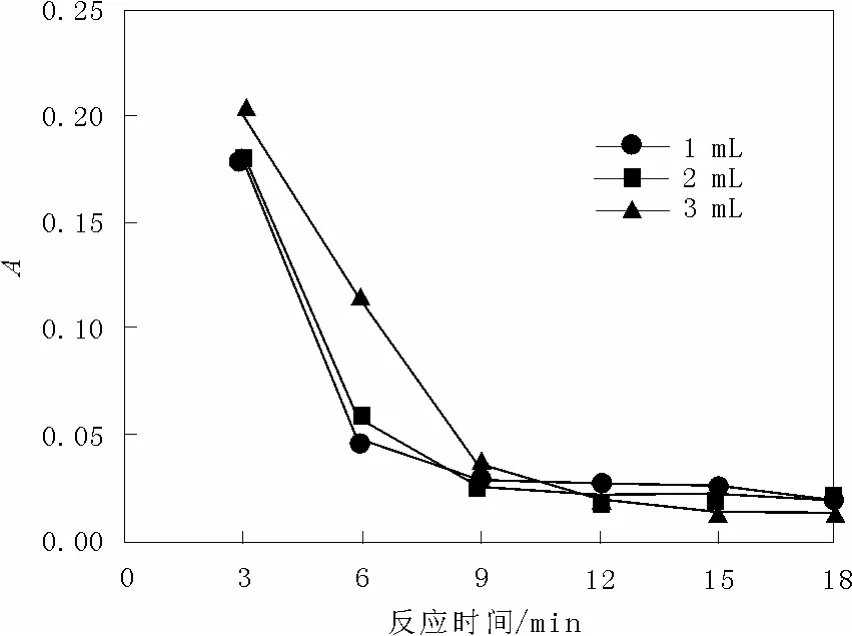
圖4 雙氧水入量對吸光度的影響Fig.4 Effect of hydrogen peroxide dosage on the absorbance
對于一定量的催化劑,其表面活性位的數目是有限的。當H2O2濃度相對較低時,表面活性位并沒有被占滿,增大H2O2濃度,催化劑表面吸附的H2O2數量就增多,從而可加快酸性品紅脫色,但是H2O2濃度過大時,催化劑表面吸附的H2O2數量已經達到了極限,限制了酸性品紅在催化劑表面的吸附,因而會減緩酸性品紅的降解。2.2.3 pH值對脫色率的影響
在酸性品紅濃度36 mg/L、催化劑用量0.013 4 g以及H2O2(質量分數 30%)用量為3 mL的反應條件下,考察pH值對酸性品紅脫色的影響。
如圖5所示,當體系初始pH=1.00和3.00時,酸性品紅脫色速率緩慢,30 min時的吸光值在0.6左右,當溶液的pH值為6.2時,脫色效果明顯變好,18 min后脫色基本完成。
有文獻[11]指出 Mn2+離子催化分解 H2O2的活性低,10 min內反應速率即降為0。因此在反應進行過程中,隨著溶液中酸性的增加越來越多的 MnO2被還原為低活性的Mn2+離子,酸性品紅的脫色效果也隨之變差。
實驗中發現,隨著反應進行溶液的pH值逐漸增大,H2O2迅速分解,產生大量的活性自由基,與酸性品紅分子發生反應而使其得以降解。
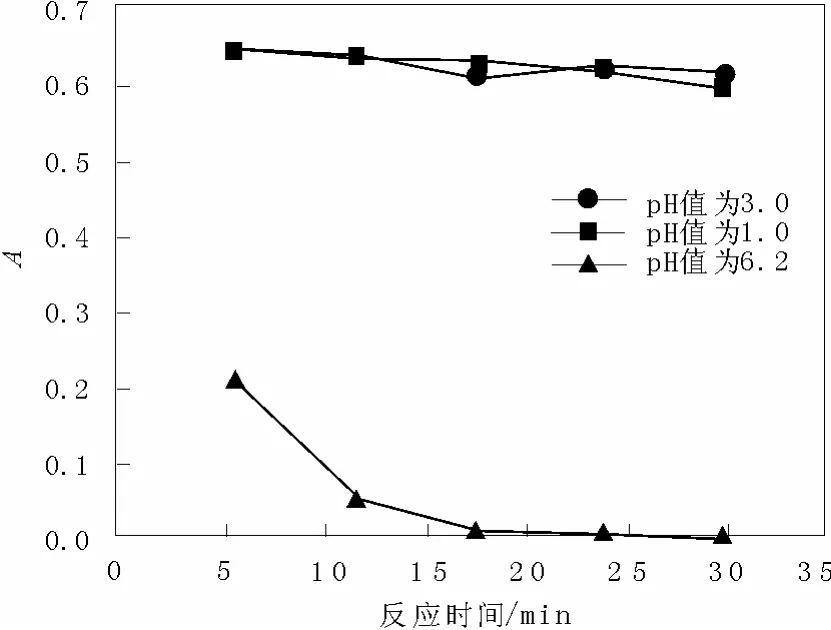
圖5 pH值對吸光值的影響Fig. 5 Effect of pH value on the absorbance
3 結 論
通過水熱法制備了氧化錳納米棒狀結構,對其催化降解品紅的性能進行了考察,實驗表明,催化劑的加入量,雙氧水的加入量和溶液的pH值對品紅的脫色效果產生重要的影響,在催化劑的加入量為0.02 g時,雙氧水的加入量為4 mL,溶液的pH值為6.2時有較佳的脫色效果。
[1] W Shi, H Peng, N Wang, P Li, L Xu, C Lee. Free-standing Single Crystal Silicon Nanoribbons[J]. Journal of the American Chemical Society, 2001,123: 11095-11096.
[2] Y Xia, P Yang, Y Sun, Y Wu, B Mayers, B Gates, Y Yin, F Kim, H Yan.One-Dimensional Nanostructures: Synthesis, Characterization, and Applications [J] .Journal of Advanced Materials, 2003, 15: 353-388.
[3] Z H Liu, K Ooi. Preparation and Alkali-Metal Ion Extraction/Insertion Reactions with Nanofibrous Manganese Oxide Having 2 × 4 Tunnel Structure [J]. Chemistry of Materials, 2003, 15: 3696-3703.
[4] B Tang, G L Wang, L H Zhuo, J C Ge, L J Cui. Facile Route to r-FeOOH and r-Fe2O3Nanorods and Magnetic Property of r-Fe2O3Nanorods[J].Inorganic Chemistry, 2006, 45: 5196-5200.
[5] B Tang, L H Zhuo, J C Ge, J Y Niu, Z Q Shi. Hydrothermal Synthesis of Ultralong and Single-Crystalline Cd(OH)2Nanowires Using Alkali Salts as Mineralizers[J]. Inorganic Chemistry ,2005, 44: 2568-2569
[6] M P Pileni, B W Ninham, T Gulik-Krzywicki, J Tanori, I Lisiecki, A Filankembo. Direct Relationship Between Shape and Size of Template and Synthesis of Copper Metal Particles[J]. Journal of Advanced Material,1999, 11 : 1358-1362.
[7] Y G Sun, B Gates , B Mayers , Y N Xia. Crystalline Silver Nanowires by Soft Solution Processing[J]. Nano Letters, 2002 ,2 : 165-168.
[8] 黃嵐, 張宇, 郭志睿, 顧寧. 半胱氨酸誘導金納米帶室溫合成[J].科學通報,2008,53:2531-2533.
[9] 趙榮祥,李秀萍,徐鑄德. 生物分子輔助水熱法合成樹枝狀硫化[J].無機化學學報,2008, 9:1434-1437.
[10] 宋旭春,楊娥,鄭一凡,王蕓. α-MnO2和β-MnO2納米棒的制備和催化性能研究[J].無機化學學報,2007, 23(5):919-922.
[11] 張建陽,史淑鳳,崔海香.金屬離子對過氧化氫的催化分解作用研究[J].唐山師范學院學報,2005, 5:10-13.
Preparation of MnO2Nanorod and its Catalytic Performance
LI Xiu-ping1,ZHAO Rong-xiang2
(1.School of Chemistry and Materials Science, Liaoning Shihua University, Liaoning Fushun 113001, China;2.School of Petrochemical Engineering,Liaoning Shihua University, Liaoning Fushun 113001, China)
MnO2nanorod was prepared by the hydro-thermal method at 140 ℃, and morphology was studied by XRD and scanning electron microscopy . Catalytic properties of the MnO2nanorod on degradation of magenta were tested. The results show that amount of catalyst, dosage of hydrogen peroxide and pH value of solution have important effect on decolorization of the magenta. When catalyst dosage is 0.02 g , hydrogen peroxide dosage is 4 mL , solution pH value is 6.2, decolorization effect is best.
Manganese dioxide; Hydrothermal;Catalyst;Magenta
TQ 137.1+2
A
1671-0460(2011)01-0033-03
2010-10-25
簡介作者: 李秀萍(1975-),女,講師,碩士,從事納米材料的制備研究工作。E-mail:lipingfushun@tom.com,電話:0413-6860249。

