防鳳愈傷組織誘導研究△
畢博,楊世海,徐大衛,劉春博
(1.吉林農業大學,吉林 長春 130118;2.吉林農業科技學院,吉林 吉林 132109;3.中國藥材公司,北京 100195;4.吉林省經濟管理干部學院,吉林 長春 130012)
防鳳愈傷組織誘導研究△
畢博1,2,楊世海1*,徐大衛3,劉春博4
(1.吉林農業大學,吉林 長春 130118;2.吉林農業科技學院,吉林 吉林 132109;3.中國藥材公司,北京 100195;4.吉林省經濟管理干部學院,吉林 長春 130012)
目的:運用現代生物技術探討防風愈傷組織的培養條件。方法:以防風葉片為外植體,對防風的愈傷組織進行不同濃度生長素和細胞分裂素誘導。結果:在2,4-D 1 mg·L-1誘導形成的愈傷組織長勢好于其他不同濃度,具有顯著差異。生長素與細胞分裂素配合使用時,愈傷組織的誘導率明顯高于單個生長素的處理,生長情況也有差異。結論:誘導防風最佳外源激素的濃度配比2,4-D 1.0 mg·L-1+6-BA 0.5 mg·L-1。
防風;愈傷組織;誘導;激素
防風Saposhnikovia divaricata(Turcz.)Schischk.為傘形科防風屬多年生草本植物,俗稱北防風、東防風、關防風、旁風、屏風、反風等[1]。藥用部位是收獲3年生未開花結實的防風根部,此時的防風根漿充足而豐滿,有菊花心,質佳,干燥后入藥稱“防風”。防風的藥用成分主要有揮發油、多糖、有機酸、無機元素、香豆素、色原酮、漢黃芩素、聚乙炔類、腺苷等,具有解熱鎮痛、抗菌、鎮靜、抗過敏作用,并具有抗腫瘤免疫促進作用及抗凝血作用[2]。防風藥材以采挖野生防風為主,種源多采自野生種子,但防風種子發芽勢低。趙敏[3]研究指出,防風種子中存在著活性較高的內源抑制物質,使種子播后出苗緩慢、出苗不齊,往往造成生產田缺苗甚至毀地重種。采用組織培養技術繁育防風時間短、速度快、成本低,對于保存防風的種質資源、合理開發利用中藥資源、滿足市場對防風的大量需求具有現實意義。
目前關于防風的研究主要在植物資源、化學成分、中藥鑒定、藥理作用和臨床應用等方面[4-5],有關防風體外培養、誘導愈傷組織的研究很少見報道。本試驗研究了不同濃度生長素和激素對防風葉片愈傷組織誘導的影響,為防風優良無性系的繁殖奠定理論基礎。
1 材料
防風種子于2009年9月采自吉林農業大學藥材基地,經吉林農業大學中藥材學院楊世海教授鑒定為防風Saposhnikovia divaricata(Turcz.)Schischk.種子。
2 方法
選擇健康飽滿的防風種子,先在無菌水中浸泡10~12 h后,小心剝去種皮(避免損傷胚),置于超凈工作臺上,用75%乙醇中浸泡30 s后,倒去乙醇,置于0.1%氯化汞表面消毒10 min(其間要不停搖動),倒去氯化汞,用無菌水沖洗3~5次,接種到MS培養基上,獲得無菌苗,待苗長至3~4 cm時備用。
取上述無菌苗,將葉片剪成0.5 cm×0.5 cm的小塊,所有培養基中蔗糖的含量均為25 mg·L-1,瓊脂的含量為0.7%,pH值為5.8~6.0。培養基在121℃下滅菌20 min,冷卻后備用。
培養溫度為(25±2)℃,在愈傷組織誘導階段先采用暗培養,4 d后轉入光下培養,以日光燈為光源,連續光照12 h·d-1,光強1 200~1 600 lx。培養過程中對其生長情況進行觀察,30 d后統計誘導出愈傷組織數量并計算誘導率,同時記錄愈傷組織的質地、顏色及生長情況。
誘導率=(形成愈傷組織的外植體數/接種外植體的塊數)×100%
將防風外植體分別接種在含有2,4-D、NAA、6-BA的濃度分別為 0,0.3,0.5,1.0,1.2,1.5 mg·L-1的MS培養基上,進行外源激素對愈傷組織誘導效應的研究。外源激素6-BA 0.5 mg·L-1與NAA、2,4-D配比使用,設8個處理,濃度分別為0.3,0.5,1.0,1.2 mg·L-1。
以上每個處理培養5個培養皿,每個培養皿接種10塊外植體,重復3次,待愈傷組織長出后觀察生長情況,計算誘導率。
3 結果與分析
利用單獨或配比使用2,4-D和6-BA,附加在MS基本培養基上,接種30 d后觀察統計,研究不同種類及濃度的激素對防風愈傷組織的誘導情況。
3.1 不同濃度2,4-D對防風愈傷組織誘導和生長的影響
表1反映了不同濃度2,4-D對防風愈傷組織誘導和生長的影響,2,4-D對防風葉片的愈傷組織有較強的誘導作用,在不添加2,4-D的培養基上不能誘導出愈傷組織。愈傷組織的誘導率隨2,4-D濃度的增加呈先上升后下降的趨勢,以1.0 mg·L-1的誘導率最高,高濃度的2,4-D反而抑制了愈傷組織的誘導;從愈傷組織生長情況來看,在濃度為1.0 mg·L-1時,愈傷組織具有很好的光澤,且生長狀況最好,顏色為乳白色。低濃度和高濃度的2,4-D均導致愈傷組織生長變差,當濃度達到1.2 mg·L-1時,大部分呈灰褐色,濃度為1.5 mg·L-1時,抑制了外植體產生愈傷組織,所產生的愈傷組織呈褐色,不能正常生長,可能是因為高濃度的2,4-D會誘導愈傷組織內多酚氧化酶活性升高,從而導致愈傷組織褐化。
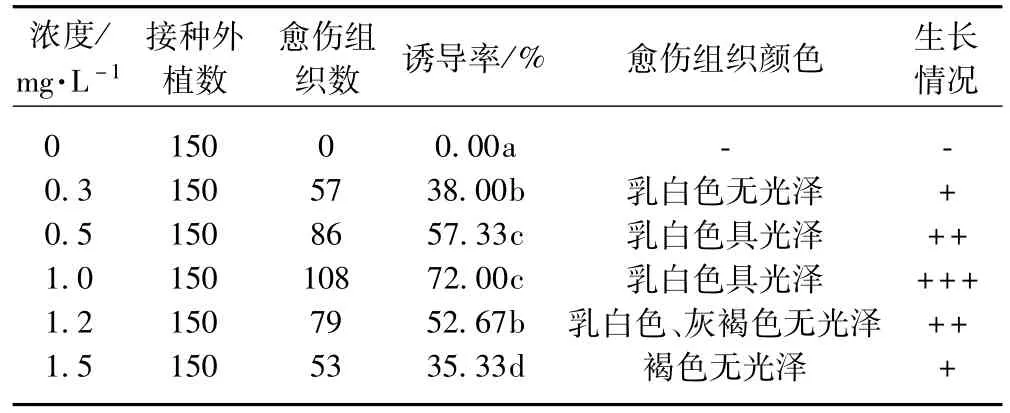
表1 不同濃度2,4-D對愈傷組織誘導和生長的影響
3.2 不同濃度NAA對愈傷組織誘導及生長的影響
表2反映了不同濃度NAA對愈傷組織誘導及生長的影響,可以看出NAA對防風愈傷組織的誘導作用也較強。在不添加NAA的培養基上不能誘導出愈傷組織,添加不同濃度的NAA均能誘導出愈傷組織。以0.5 mg·L-1的NAA誘導率最高,愈傷組織生長好,呈乳白色,具光澤,轉接后長勢好。但當NAA濃度增加為1.0 mg·L-1以上時,愈傷組織生長緩慢。當NAA濃度達到1.5 mg·L-1時,愈傷組織生長狀況變差,誘導率也逐漸降低。這是因為低濃度的生長素能促進生長,超過適宜濃度,由于生長素可誘導產生乙烯而干擾內部生理平衡,從而抑制生長[6-7]。
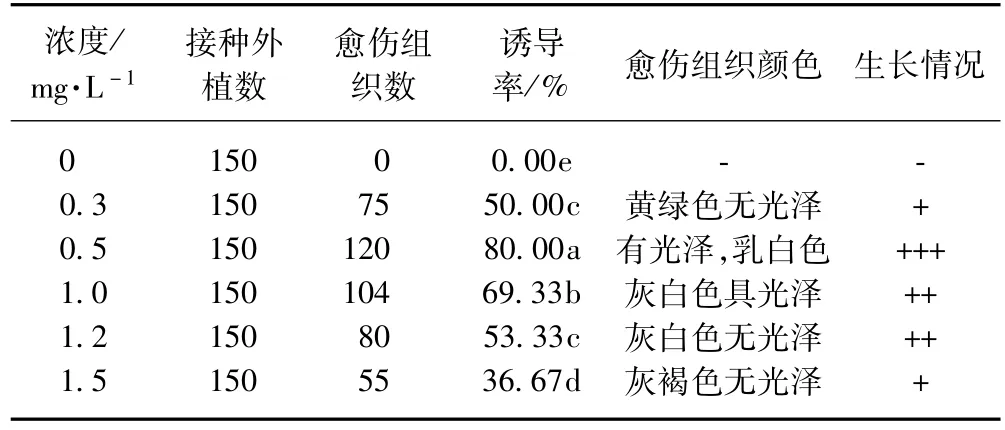
表2 NAA對愈傷組織誘導和生長的影響
3.3 不同濃度6-BA對防風愈傷組織生長的影響
表3反映了不同濃度6-BA對防風愈傷組織生長的影響,可以看出6-BA也是誘導防風葉片產生愈傷組織的關鍵因素。在不添加6-BA的培養基上不能誘導出愈傷組織,添加不同濃度的6-BA均能誘導出愈傷組織。當6-BA的濃度為0.5 mg·L-1時誘導率高,愈傷組織呈黃綠色,有光澤,生長好,是培養防風產生愈傷組織的適宜濃度。當6-BA的濃度小于0.5 mg·L-1時,誘導率低,誘導出的愈傷組織顏色較暗,生長差;當濃度在1.0 mg·L-1以上時,有少量愈傷組織產生,且生長緩慢。由于6-BA在適宜的濃度具有促進細胞分裂和伸長、促進細胞分化及物質的合成和運輸、影響細胞中各種酶的活性等作用[8],如果濃度過低,容易形成多核體阻止細胞分化,加速細胞衰老,逐漸死亡;而高濃度的6-BA使細胞體積因強烈的分裂活動而急劇縮小,已形成的愈傷組織不能正常生長,逐漸變褐[9]。
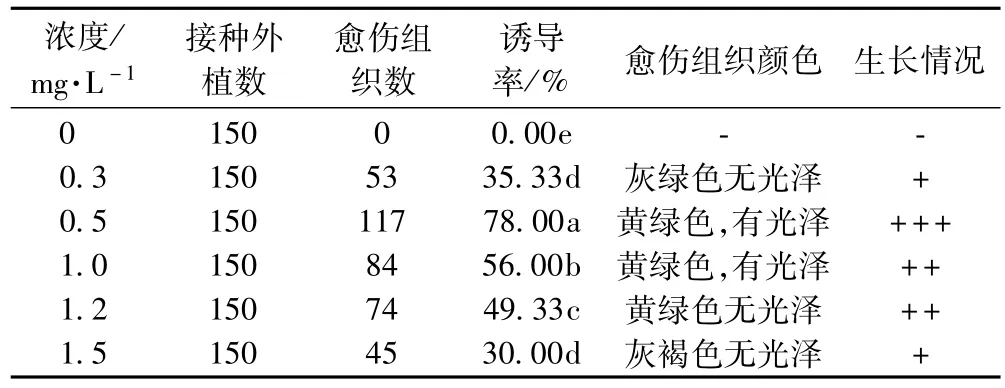
表3 不同濃度6-BA對愈傷組織誘導和生長的影響
3.4 外源激素組合對防風愈傷組織的影響
表4反映了外源激素組合對防風愈傷組織的影響。從誘導率方面來看,適宜濃度的2,4-D與6-BA組合、NAA與6-BA組合的誘導率均較高。結合生長情況及愈傷組織誘導出后發育情況來看,2.4-D 1.0 mg·L-1+6-BA 0.5 mg·L-1組合不僅生長好,愈傷組織呈淺黃色,具光澤,約20 d后,愈傷組織呈黃綠色,質地較緊密[10]。
比較了不同濃度的2,4-D、NAA、6-BA單獨使用及組合使用的植物生長調節物質對防風愈傷組織的誘導效應。單獨使用3種植物外源激素在一定濃度范圍內均能誘導出愈傷組織;配合使用外源生長素和細胞分裂素能獲得誘導率高、生長快、質量好的愈傷組織[11];較佳組合的培養基為 MS+2,4-D 1.0 mg·L-1+6-BA 0.5mg·L-1和 MS+NAA 0.5 mg·L-1+6-BA 0.5 mg·L-1;低濃度的2,4-D對防風愈傷組織的誘導有促進作用,但2,4-D濃度高時對愈傷組織的生長有抑制作用。
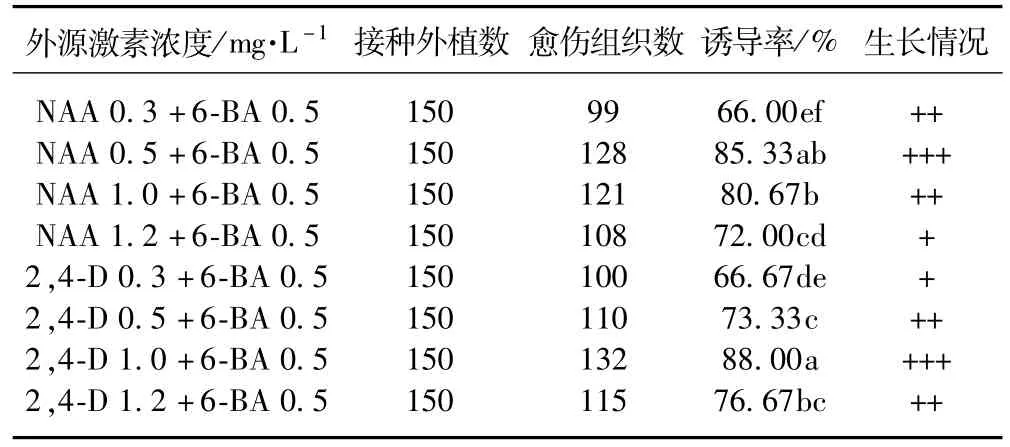
表4 外源激素組合對愈傷組織的影響
4 小結與討論
一般來說,激素及其組合的不同,對愈傷組織的誘導也起著關鍵作用,其中生長素和細胞分裂素是兩類主要的調控培養條件下細胞生長和分化的植物激素。已有研究證實,生長素和細胞分裂素對于細胞生長與分化具有協同作用,它們的量與比值的不同配合對細胞分化起著重要的調節作用[12-13]。在防風愈傷組織誘導過程中,通過調整培養基中2,4-D和NAA的濃度,結果發現,低濃度的激素對防風愈傷組織的誘導有促進作用,但激素濃度過高時對愈傷組織的生長有抑制作用。
比較愈傷組織的誘導率及生長情況發現,2,4-D對愈傷組織的誘導效果好,尤以1 mg·L-1的2,4-D誘導形成的愈傷組織長勢好,呈顆粒狀,疏松、乳白色,與其他濃度比較具有顯著性。實驗結果表明,生長素與細胞分裂素配合使用時,愈傷組織的誘導率明顯高于單個生長素的處理,生長情況也有差異。誘導防風愈傷組織最佳外源激素的濃度配比為2,4-D 1.0 mg·L-1+6-BA 0.5 mg·L-1。本研究結果未對防風愈傷組織有效成分進行比較,防風有效成分含量很多,這一方面的深入研究我們正在進行,將為防風的高效快速繁殖開拓新的領域。
[1]陳祥梅,貝麗霞.藥用植物防風組織培養關鍵技術研究[J].中國農學通報,2007,23(5):83-87.
[2]高詠莉.生藥防風的化學成分與藥理作用研究進展[J].山西醫科大學學報,2004,35(2):216-218.
[3]趙敏.防風種子中內源抑制物質活性的研究[J].中草藥,2004,35(4):441-444.
[4]馬紅 .防風近年研究概述[J].中草藥,1994,25(8):382-440.
[5]張貴軍,張艷波,李影.我國生藥防風近10年的研究概況[J].時珍國醫國藥,1997,8(1):73-75.
[6]張朝紅,崔宏安.杜仲愈傷組織誘導的研究[J].西北農林科技大學學報(自然科學版),2003,(5):153-157.
[7]龔慕辛,朱甘培.香薷的本草考證[J].北京中醫,1996,12(5):39-41.
[8]彭紅云,楊肖娥.香薷植物修復銅污染土壤的研究進展[J].水土保持學報,2005,19(5):197-201.
[9]葛冰,盧向陽,易克,等.石香薷的研究概況[J].中藥材,2004,26(4):302-305.
[10]呂金順,張景瓊,鄭尚珍,等.香薷屬植物藥用成分研究進展[J].中國醫學生物技術應用,2002,(4):15-19.
[11]郝近大,謝宗萬.香薷藥用品種的延續與變遷[J].1994,(6):26-29.
[12]Dominov JA,Stenzier L,Lee S,etal.Cytokinins and auxins control the expression of a gene inNicotiana Plubaginifoliacells by feed back regulation[J].The Plant Cell,1992,4:451-461.
[13]Ye ZH,Varner JE.Expression of an auxin and cytokinin-regulated gene in cambial region in Zinnia[J].Proc Natl Acad Sci,1994,91:6539-6565.
Study on Induction of Sapashnikovia divaricata Callus
BIBo1,2,YANG Shi-hai1,XU Da-wei3,LIU Chun-bo4
(1.JinlinAgriculturalUniversity,Changchun130118,China;2.JilinAgriculturalScienceandTechnologyCollege,Jilin132109,China;3.ChinaNationalCorp.ofTraditional&HerbalMedicine,Beijing100195,China;4.JilinProvinceEconomicsandManagementCadresCollege,Changchun130012,China)
Objective:To investigate the culture conditions for callus induction inSaposhnikoviadivaricata.Methods:With the blade ofSaposhnikoviadivaricataas explant,to induce the callus with different concentration of auxin and cytokinin.Results:The callus grew significantly better in conduction with 2,4-D 1 mg·L-1than in other conditions.When auxin andcytokinins were used together,callus induction rate was significantly higher than single auxin.Conclusion:The optimal culture condition for callus induction is 2,4-D 1.0 mg·L-1+6-BA 0.5 mg·L-1.
Saposhnikoviadivaricata;Callus;Induction;Plant growth regulator
吉林省中醫藥管理局項目——防風多倍體種質資源創新技術研究
*楊世海,E-mail:jlyangs@163.com
2011-03-29)

