豬傳染性胃腸炎病毒Sa 基因的克隆與序列分析
溫海燕 (菏澤學院動物科學系 山東 菏澤 274015)
?
豬傳染性胃腸炎病毒Sa 基因的克隆與序列分析
溫海燕 (菏澤學院動物科學系 山東 菏澤 274015)
將豬傳染性胃腸炎病毒接種ST細胞進行增殖,待細胞出現明顯的病變后,將細胞反復凍融3次收獲病毒。根據GenBank中已發表的豬傳染性胃腸炎病毒S基因的序列,設計合成了1對擴增S基因包含A抗原位點724bp基因片段(Sa)的引物,引物兩端分別有HⅠ和dⅢ的酶切位點。以感染細胞提取的病毒RNA為模板,經RT-PCR擴增得到目的片段,然后將其克隆到pMD18-T載體上,經藍白斑篩選和酶切鑒定選擇陽性克隆進行序列測定,構建成功的重組質粒命名為pMD18-T-Sa。用DNAstar軟件將其與GenBank上的序列進行同源性比較,結果表明,核苷酸同源性為97%以上,氨基酸同源性為93%以上。根據豬傳染性胃腸炎病毒Sa基因核苷酸序列繪制的系統進化樹,結果表明,試驗株與TH-98株親緣性最近。
胃腸炎病毒 Sa基因 克隆 序列分析
豬傳染性胃腸炎病毒(Transmissible gastroenteritis virus of swine,TGEV)隸屬于冠狀病毒科冠狀病毒屬,是引起仔豬病毒性腹瀉的重要病原,由其引起的豬傳染性胃腸炎(Transmissible gastroenteritis of swine,TGE)是一種急性、高度接觸性腸道傳染病,是世界動物衛生組織(OIE)法典中B類疫病中必檢的豬傳染病。不同年齡和品種的豬均易感,尤其以仔豬最易感,2周齡以內的仔豬致死率高達100%,以嘔吐、腹瀉、脫水、高死亡率為典型癥狀,成年豬死亡率較低,但是會造成機體消瘦,降低飼料利用率等[1]。目前該病已遍布全世界各國,給養豬業造成了巨大的經濟損失。
TGEV由4種結構蛋白和3種非結構蛋白構成,其中S蛋白為大的糖蛋白,形成病毒突起,攜帶主要的B淋巴細胞抗原決定簇,是唯一能誘導機體產生中和抗體和提供免疫保護作用的結構蛋白;含有宿主細胞氨肽酶受體(PAPN)的識別位點,在決定宿主細胞親嗜性方面起關鍵作用[2]。S基因長度為4.35×103bp,包括A、B、C、D4個位點,其中A位點又可分為Aa、Ab、Ac 3種亞位點,A位點暴露于病毒的表面,主要誘導中和抗體的產生,并且不同分離株的A位點保守性強[3,4]。
目前國際上已培育多種弱毒疫苗,有德國的BI-30疫苗株,匈牙利的CKP弱毒株,美國的TGE-Vac株等等,國內哈爾濱獸醫研究所也培育成功華株弱毒疫苗[5]。弱毒株大多是經不同方式的人工致弱而成,一般的弱毒疫苗均有一定的殘余毒力與致病性,在動物體內增殖誘發免疫力的同時又有毒力返強的可能。而滅活疫苗接種后雖能誘導機體產生比弱毒疫苗更高的循環抗體,但因機體缺乏局部的黏膜免疫,不能有效地抵抗外界野毒的侵襲[6]。鑒于此,本研究對豬傳染性胃腸炎病毒Sa基因進行克隆與序列分析,為豬傳染性胃腸炎病毒新型基因工程疫苗的研制奠定基礎。
1 材料與方法
1.1 試劑與材料 1640培養基(購自美國HyClone公司),新生牛血清購自上海華美公司、Taq DNA聚合酶、TAKARADNA Fragment Purification Kit 、DNA 分子量標準 DL2000、限制性內切酶HⅠ和dⅢ、T4DNA 連接酶、膠回收純化試劑盒購自大連寶生物工程有限公司,X-gal、IPTG購自Merk 公司、DEPC購自Sigma公司、胰蛋白胨和酵母提取物購自OXOID公司,ST細胞、DH5α、豬傳染性胃腸炎病毒均有傳染病實驗室保存,pMD18-T Vector購自大連寶生物工程有限公司。
1.2 引物的設計與合成 根據GenBank中已發表的基因序列,應用Primer5.0軟件自行設計合成了一對能擴增724bp基因片段(包括S基因A抗原位點)的引物,兩端分別含有HⅠ和dⅢ的酶切位點及保護性堿基,序列:P1:5’ACGTCA TTG AAC ACA ACG GGT GGT GTC 3’HⅠ;P2:5’ AGCCTG TGG CAT CTA AAA CGT CCG T3’dⅢ。送北京賽百盛基因技術有限公司合成。
1.3 病毒RNA的抽提 將病毒液接種到ST單層細胞上,72h后,待細胞出現明顯的細胞病變,將細胞反復凍融三次。10000rpm離心10min,取上清,獲得的病毒液參照Trizol(一步法總RNA提取試劑)試劑盒說明書進行操作。
1.4 RT-PCR (1)cDNA的合成參照M-MLV Reverse Transcriptase 說明按下列體系進行反轉錄:RNA模板1μl,0.5μl下游引物P2,9μl RNase Free H2O,70℃溫浴5min結束后立即放在冰上。繼續添加4μl 5×M-MLV RTase buffer,2μl 100Mmdtt,2μl dNTP(2.5mM),0.5μl RNase inhibitor,1μl M-MLV RTase,37-42℃溫浴1h,得到的反應液可立刻用于PCR反應或-20℃保存備用。(2)Sa基因的PCR擴增。按常規方法進行PCR反應,冰上操作,采用25μl體系,PCR 管中依次加入以下試劑:3μl cDNA模板,2.5μ1 0×PCR Buffer,0.5μl上游引物P1(20pmoL/μl),0.25μl Taq DNA聚合酶(5U/μl),18.75μl ddH2O,優化后的PCR反應條件:94℃ 5min,94℃ 1min、69.4℃ 1min、72℃ 1min進行30個循環,72℃10min。PCR結束后,PCR產物用1%瓊脂糖凝膠進行電泳,觀察結果。
1.5 目的片段的回收、純化及序列測定 參照超薄瓊脂糖凝膠DNA回收試劑盒說明回收純化目的片段,然后將其與pMD18-T載體連接,將連接產物轉化感受態細胞DH5α,挑斑,擴大培養,抽提重組質粒進行酶切鑒定和PCR鑒定,將鑒定為陽性克隆的菌液送寶生物(大連)有限公司測序。
1.6基因序列分析 利用DNAstar 軟件對所測定的基因的核苷酸序列及推導的氨基酸序列進行編輯,并與GenBank中的序列進行同源性比較,然后用ProtScale軟件對編碼的Sa蛋白的空間進行模擬分析。
2 結果與分析
2.1 TGEV Sa基因的RT-PCR擴增 以TGEV RNA為模板,應用引物P2,反轉錄合成第一鏈cDNA,以P1和P2為引物擴增Sa基因,所獲得的PCR產物在1.0%瓊脂糖凝膠電泳上呈單一條帶,大小與預期724bp相符(圖1)。
2.2 質粒的雙酶切鑒定 重組質粒經HⅠ和dⅢ雙酶切后,得到約760bp的插入片段和約2656bp的載體片帶,證明所挑取的克隆為正確的重組轉化子,將得到的重組質粒命名為pMD18-T-Sa(圖2)。
2.3 重組質粒的PCR鑒定 將重組質粒pMD18-T-Sa轉化入大腸桿菌DH5α感受態細胞,獲得大量轉化子。從中隨機挑選幾個重組子單菌落,用PCR方法進行鑒定,瓊脂糖凝膠電泳結果顯示,以引物P1和P2擴增出了大小為724bp的特異片段,表明所檢測的克隆中均含有外源目的片段的插入(圖3)。
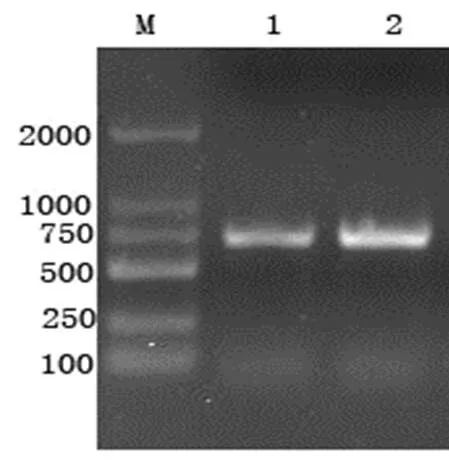
圖1 RT-PCR擴增結果
M:DNA標準DL2000;1-2:RT-PCR擴增產物
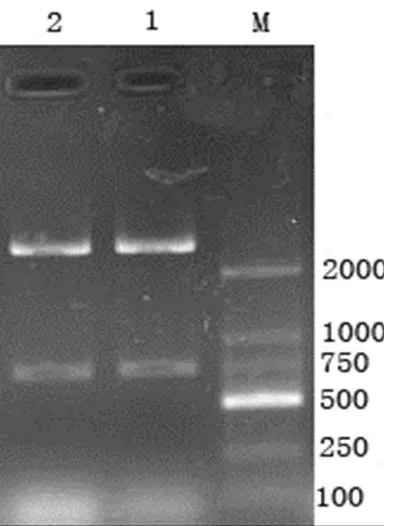
圖2 重組質粒pMD18-T-Sa雙酶切鑒定結果
M:DNA標準DL2000;1-2:雙酶切鑒定結果
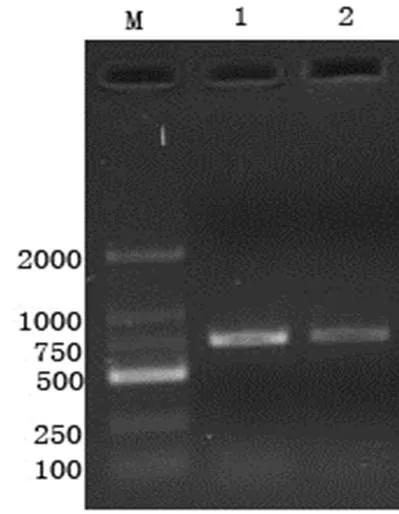
圖3 重組質粒pMD18-T-Sa PCR鑒定
M:DNA標準DL2000;1-2:重組質粒pMD18-T-Sa PCR 鑒定
2.4 Sa基因的序列測定及分析 將疑似陽性克隆的菌液送寶生物(大連)公司進行測序,用DNAstar軟件將測定序列與GenBank中的序列進行同源性比較,結果表明:試驗株Sa基因與GenBank中毒株TH-98、HN2002、SC-Y、133、TS的基因核苷酸同源性分別為99.3%、97.9%、99.6%、97.7%、97.9%,氨基酸同源性分別為97.9%、95.0%、98.8%、93.8%、95.0% (表1),再根據它們的核苷酸序列繪制系統進化樹(圖4),結果表明:試驗株與TH-98毒株在進化上親緣關系最近,最后利用DNAstar軟件對Sa片斷的抗原表位進行分析,由圖可見第178-231(即S基因A位點)位點抗原性好(圖5)。
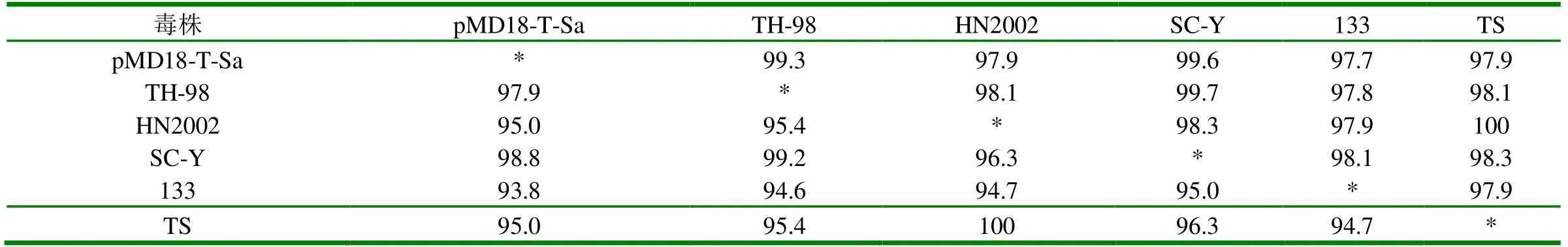
表1 不同病毒株Sa基因的核苷酸及氨基酸同源性比較(%)
注:*表示同源性為100%
3 討論
(1)豬傳染性胃腸炎病毒感染具有明顯的腸嗜性,病毒粒子表面的纖突蛋白(S蛋白)與存在于腸上皮細胞頂膜的氨基肽酶(APN)的結合是感染發生的首要條件,因此,S蛋白是免疫預防和診斷研究的重點。TGEV只有1個血清型,而變異卻使TGEV各毒株之間產生了抗原差異。彭樹英等[7]將TSX毒株S全基因序列與其他毒株相比,雖在核酸和氨基酸序列上存在一定差異,但形成4個抗原位點的核酸和氨基酸序列并未發生變異,Aa、Ab、Ac位點仍高度保守,并且A位點的缺失可導致S蛋白喪失產生中和抗體的能力。因此,本研究設計引物擴增了一段包含TGEV S基因A位點的片段,為豬傳染性胃腸炎基因工程疫苗的研制奠定了良好基礎。(2)TGEV病毒通過消化道進入仔豬體內,其靶細胞都是腸絨毛上皮細胞,引起腸絨毛的萎縮脫落,導致動物消化紊亂、酸中毒和脫水。在預防上,如果在腸腔內經常有抗體存在,就可以不斷中和豬體攝入的病毒,從而起到保護作用。因此,黏膜免疫是本病特異性免疫應答的主要特征,而腸道黏膜表面SIgA含量的高低直接決定臨床疾病的發生和疾病嚴重程度[8]。針對本病的特點,采用口服免疫是較為理想的預防途徑,口服免疫突出的優點是可有效地刺激腸道局部免疫細胞產生SIgA,尤其適應于腸道黏膜傳染病,而探索安全、有效、廉價、可以誘導黏膜免疫產生的新型疫苗顯得尤為重要。本試驗成功地克隆得到了TGEV Sa基因,結合枯草芽孢桿菌基因的功能特點,構建新的跨膜體系,為研制有效誘導黏膜免疫產生的新型疫苗奠定基礎。
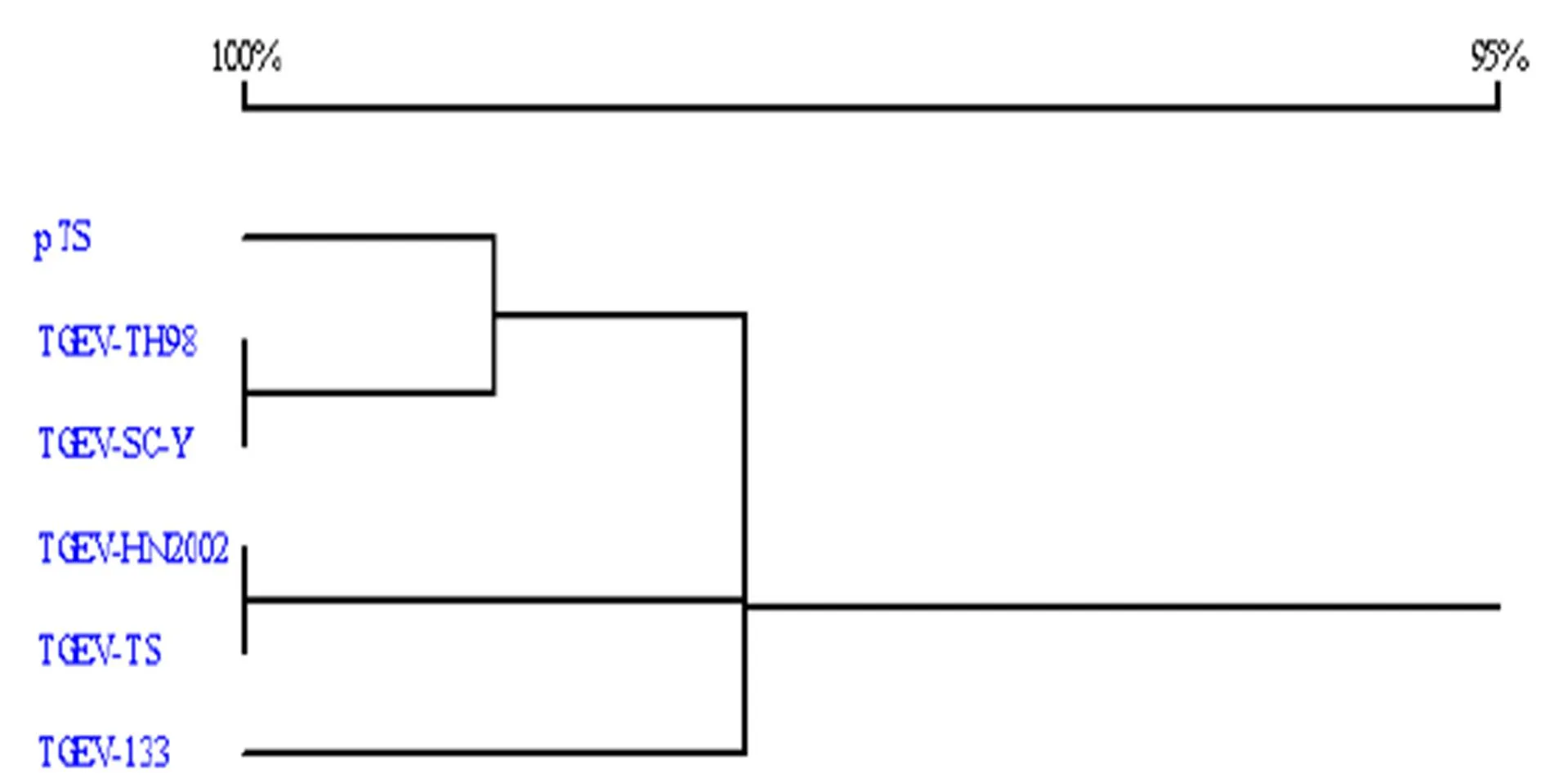
圖4 根據豬傳染性胃腸炎病毒不同毒株Sa基因核苷酸序列繪制的系統進化樹
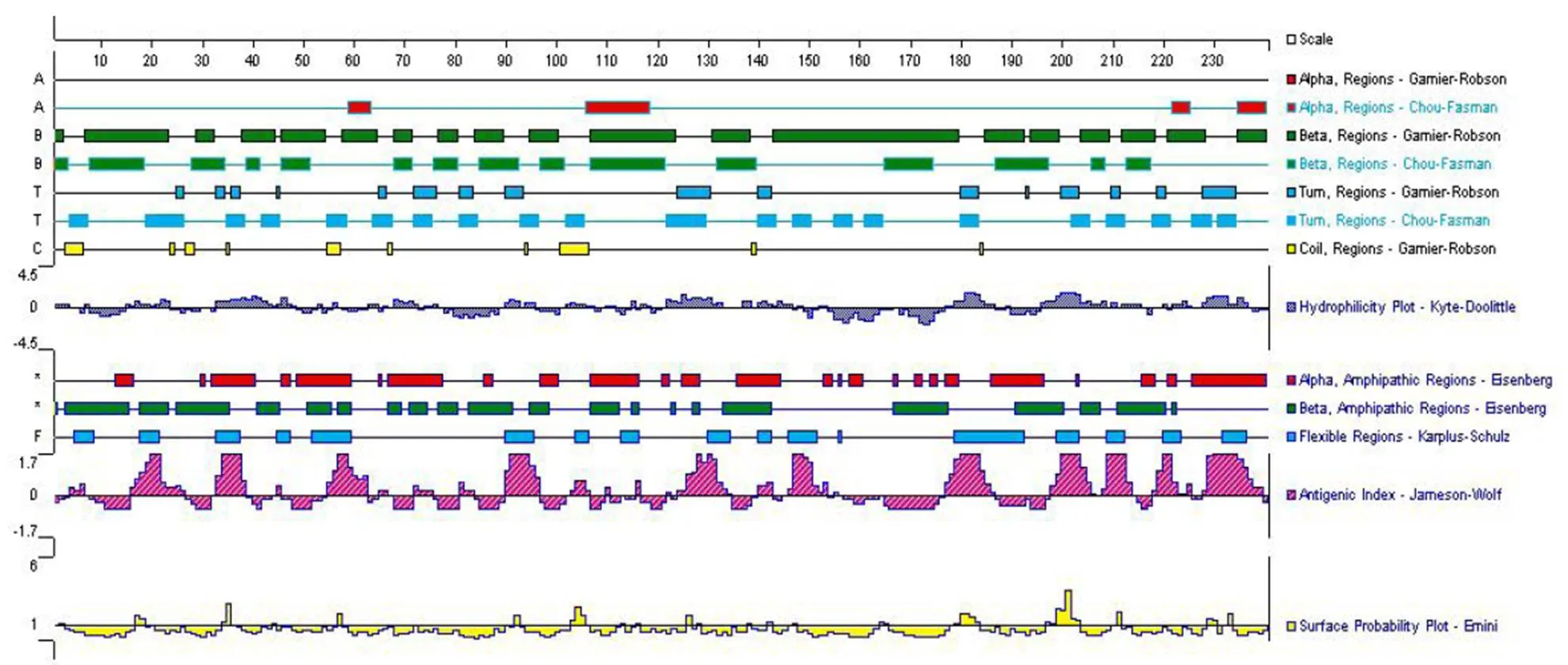
圖5 利用DNAstar軟件對TGEV Sa片斷的抗原表位分析
[1] 陳秀強,劉建華.豬傳染性胃腸炎[J].福建畜牧獸醫,2000, (22) 16: 36-37.
[2] DeLmas B, GeLfi J, Laude H. Antigenic structure of transmissibLe gastroenteritis virus. II. Domains in thepepLomergLycoprotein [J]. JGen Viro,L 1986, 67: 1405-1408.
[3] Sanchez C M,Izeta A,Sanchez-Morgad J M,etaL.Targeted recombination demonstrates that the spike gene of transmissibLe gastroenteritis coronavirus is a determinant of its enterictropism and viruLence[J].J ViroL,1999,73:7607-7618.
[4] Soo J K,Jeong H H,Hyuk M K.PartiaL sequence of the spike gLycoprotein gene of transmissibLe gastroenteritis viruses isoLated in Korea[J]. Veterinary MicrobioLogy, 2003, 94: 195-206.
[5] 吳鋒,黃毓茂.豬傳染性胃腸炎疫苗的研究進展[J].畜牧與獸醫,2009,41(12):97-99.
[6] Mesteck J, Lamm ME, etaL Handbook of mucosaL immunoLogy[M].MucosaL immunogLobuLin, 1994: 79-98.
[7] 彭樹英,呂寧,何曉寧,等.豬傳染性胃腸炎病毒纖突蛋白全基因的克隆與序列分析[J].西北農林科技大學學報,2007,7(5):1-5.
[8] Brandtzaeg P. Distribution and characteristics of mucosaL immunogLobuiLin-producing ceLLs. In: Handbook of immunoLogy [M]. Boston:Academic Press, 1994: 251-279.
(2011–02–26)
S852.65+9.4
A
1007-1733(2011)04-0001-03

