Ca2GeO4∶Eu3+的電子結構和紫外-真空紫外發光特性的研究*
秦青松于明匯周宏亮周美嬌項曉天李曉的曾俊璽張加馳
Ca2GeO4∶Eu3+的電子結構和紫外-真空紫外發光特性的研究*
秦青松 于明匯 周宏亮 周美嬌 項曉天 李曉的 曾俊璽 張加馳
(蘭州大學磁學與磁性材料教育部重點實驗室,蘭州730000)
(2010年8月1日收到;2010年9月21日收到修改稿)
采用高溫固相法合成了發光材料Ca2GeO4∶Eu3+,并詳細研究了其紫外-真空紫外發光特性.發現并解釋了Eu3+離子在空氣中的自還原以及在不同波長激發下的顏色轉換現象.Ca2GeO4∶Eu3+在163—230和301,466 nm處具有強激發帶,表明Ca2GeO4∶Eu3+在等離子顯示板和發光二極管等方面具有潛在的應用價值.通過對激發光譜的研究,鑒定了Ca2GeO4∶Eu3+的光致發光機理.用密度泛函理論的局部密度近似原理計算了Ca2GeO4∶Eu3+的電子結構和非線性光學性質.
Ca2GeO4∶Eu3+,光致發光機理,空氣中自還原,顏色轉換
PACS:78.55.Hx,81.05.Zx
1.引言
伴隨著發光材料性能的改善,各種發光器件如場發射顯示器(FEDs)、等離子顯示器、發光二極管(LEDs)和電致發光顯示器(ELD)等都得以快速的發展.目前,在新型發光材料的開發和研制上,科研人員已經進行了大量的工作[1—3].最近,鍺酸鹽作為一種應用廣泛的新型發光材料基質備受關注.在場致發射顯示器中的應用方面,Xiao等[4,5]報道了一種高亮度的發光材料(Zn2SiO4)-(Zn2GeO4): Mn2+,Zhao等[6,7]研究了發光材料Y2Ge2O7:M3+和Y4GeO8:M3+(M3+=Eu3+,Tb3+和Bi3+).在白光LED器件方面,Jiang等[8]報道了在465 nm激發下Ca2GeO4:Ce3+,Li+具有很強的黃光發射,而根據Toda等[9]的研究,Y2GeO5:Tb3+的亮度達到了日亞公司生產的YAG:Tb亮度的90%.在等離子顯示器的應用方面,Toda等[9]報道了新型發光材料Na(Y,Gd)GeO4∶Eu3+比Y2O3:Eu3+具有更好的真空紫外發光性能,Yang等[10,11]研究了綠色發光材料Mg2GeO4:Tb3+和Ca2GeO4:Tb3+的發光性能,并發現Mg2GeO4:Tb3+在172 nm處的激發強度是在272 nm處的1.8倍.
綜上所述可知,鍺酸鹽是一種具有應用價值的優良基質材料.而在眾多鍺酸鹽中,Ca2GeO4具有較好的導電性和穩定的物理化學性質,是一種很好的基質材料.不過到目前為止,對Ca2GeO4晶體的研究主要是通過摻雜Cr4+離子來制備激光材料[12,13].另一方面,Eu3+是一種典型的高效激活離子.同時,因為Eu3+的磁偶極和電偶極躍遷在很大程度上取決于其基質的離子占位對稱性,所以Eu3+的發射光譜可以用來研究基質材料的晶體格位環境.此外,Ca2GeO4∶Eu3+的紫外-真空紫外發光性能及其發光機理目前尚未見報道.
本文利用高溫固相方法合成了發光材料Ca2GeO4∶Eu3+.對Ca2GeO4∶Eu3+的紫外及真空紫外發光性能進行了全面的表征,并闡明了Ca2GeO4∶Eu3+的紫外-真空紫外的激發機理.此外,還以局域密度近似(LDA)的密度泛函理論(DFT)為理論基礎,計算了Ca2GeO4電子結構和非線性光學性質.
2.實驗
用高溫固相法制備了Ca2-2xEu2xGeO4(x=0—0.12)系列粉末樣品.初始原料是CaCO3(純度為99.5%),Eu2O3(純度為99.99%)和GeO2(純度為99.5%).首先,用瑪瑙研缽將初始原料充分研磨混合,再將混合物放在氧化鋁坩堝中,在1350℃的溫度下保溫10 h.然后,將所得樣品冷卻到室溫,再用瑪瑙研缽研細.
采用Rigaku D/Max-2400型X射線粉末衍射儀測定了樣品的物相.用PE Lambda 950型紫外可見分光光度計測得樣品的吸收光譜,并用BaSO4進行校正.樣品的紫外激發和發射光譜用以Xe 900(450 W氙弧燈)作為光源的FLS-920 T型熒光光譜儀測試.真空紫外光譜儀的光源是一個Cathodeon Incorporate生產的150 W的氘燈.采用VM504型真空單色儀測量樣品的真空紫外激發和發射光譜,并用水楊酸鈉對其真空紫外激發光譜進行校正.所有的測試都在室溫下進行.
所有計算都是以廣義梯度近似(GGA)的DFT為基礎的[14—17].我們主要采用計算軟件Materials Studio 4中的CASTEP程序組計算Ca2GeO4電子結構,具體的計算原理在文獻[14—20]中已有詳細的闡述.從整體上看,計算過程中以下兩個步驟是必要的[18—20]:第一步是要利用已知的晶體數據來建立晶體結構,并利用CASTEP程序中的GGA模塊(也可采用LDA模塊)對所建立的晶體結構進行優化[21].第二步是繼續利用程序中的GGA模塊對優化后的晶體結構來計算Ca2GeO4的電子結構和非線性光學性質,所有計算過程均在軟件內置程序中進行.對于這兩個步驟的計算,基本參數設置如下:動力學能閥為300 eV,k點間距為0.05-1,k點網格設為4×2×3,自洽場閾值為每原子2.0×10-6V.在計算光學性能的設置中,我們將光學k點的Γ設置為中點,這樣既縮短了計算時間,又保持了較高的計算精確度.可以預見,在該設置下計算所得的理論吸收光譜將略微偏大.
3.結果與討論
3.1.Ca2GeO4∶Eu3+的晶體結構
圖1是作為典型代表的Ca2GeO4∶Eu3+(Eu摩爾分數為6%)樣品的X射線衍射譜,結果表明:所得樣品的晶面指數與標準卡片JCPDS(26-0304)一致,其他樣品也基本符合.這說明本實驗所制備的所有樣品均是很好的單相.摻雜Eu3+離子在其濃度達到12.0 mol%之前不會使樣品產生任何雜質相.

圖1 Ca2GeO4∶Eu3+樣品的X射線衍射譜與Ca2GeO4的JCPDS標準卡片26-0304的對比
作為一種橄欖石結構的晶體,Ca2GeO4晶體的空間群為Pnma,其晶格常數a=5.24,b=6.79,c=11.4.根據文獻[21]報道的原子坐標,圖2是用DIAMOND程序畫出的Ca2GeO4晶體結構[22,23].由2圖可見:一個Ca2+與6個O2-形成八面體結構,最近的Ca—O鍵長為1.866.Ca2GeO4中存在兩種不同的Ca格位,圖2也給出了Ca2GeO4晶體結構中Ca(1)和Ca(2)兩種格位的八面體配位示意圖,其中最鄰近鈣之間的距離是4.585.由于Eu3+的離子半徑(0.95)比Ge4+的離子半徑(0.53)更接近Ca2+的離子半徑(0.99),所以摻入Ca2GeO4晶體中的Eu3+將占據Ca2+的格位.同時,由于電荷不平衡,且體系中沒有其他電荷補償離子,所以在高溫條件下少量Ca將移動到表面,從而形成負電的Ca空位(V¨Ca),以實現電荷平衡.
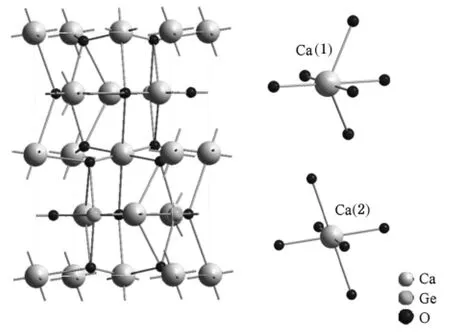
圖2 Ca2GeO4的晶體結構和Ca(1)和Ca(2)的八面體格位示意圖
3.2.光致發光特性
圖3(a)是在254 nm光激發下的Ca2GeO4∶Eu3+(Eu摩爾分數為6%)樣品的發射光譜,可以清楚地發現其發射光譜主要由兩部分組成,即位于320—550 nm的發射寬帶和在550—650 nm之間的紅光發射峰.對紅光發射峰而言,在575和578 nm的弱發射峰可以歸屬于Eu3+的5D0-7F0躍遷.同時,5D0-7F0躍遷分裂成為兩個分裂峰的事實表明:在Ca2GeO4晶格中,Eu3+離子占據了兩種格位.Eu3+的磁偶極5D0-7F1躍遷分別位于585,591,594和600 nm處.此外,5D0-7F1躍遷出現了超過3個(2J+1)分裂峰的事實也證明Eu3+離子占據了兩種不同的格位[24].在圖3(a)中,在611和623 nm處的發射峰應歸屬于電偶極5D0-7F2躍遷,其中611 nm處的峰強最高.另一方面,為了確定在320—550 nm的發射寬帶的歸屬,圖3(b)給出了在254 nm激發下高斯分解后的Ca2GeO4∶Eu3+的發射光譜.正如圖3(b)所示,在320—550 nm的寬峰帶可以分解為3個高斯模擬峰,其中位于360和392 nm的發射峰是源于在Ca2GeO4晶格中與缺陷能級相關的電子和空穴復合輻射[25].此外,如圖4所示,在沒有摻雜任何稀土離子的Ca2GeO4晶體中,也可以觀察到在360和392 nm處的兩個發射峰,這也進一步說明這兩個發射峰是屬于Ca2GeO4的基質發射.而對在450 nm處的相對較弱的發射帶而言,它應該歸屬于Eu2+的5 d-4 f特征躍遷,這表明在Ca2GeO4晶體中,一些Eu3+可能在空氣中自發地還原為Eu2+.
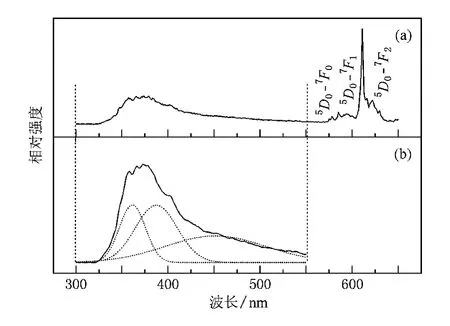
圖3 在254 nm光激發下,Ca2GeO4∶Eu3+樣品的發射光譜和高斯分解后的發射光譜(a)發射光譜;(b)高斯分解后的發射光譜
為了證明Eu2+離子的存在,我們給出了以下兩個證據:1)圖4是在254 nm激發下Ca2GeO4和Ca2GeO4∶Eu3+的歸一化后的發射光譜.在圖4中Ca2GeO4樣品的發射帶為320—445 nm,而在圖4 (b)中Ca2GeO4∶Eu3+為樣品的發射帶的右邊緣延伸到了550 nm,這是因為Eu2+的發射帶為380—550 nm.2)圖5是在450 nm光監測下Ca2GeO4∶Eu3+的激發光譜,其在290,308,343,365及387 nm的激發峰歸屬于Eu2+的4f-5d特征吸收.此外,圖6 (c)是Ca2GeO4∶Eu3+在365 nm激發下的發射光譜,在380—550 nm范圍內可以清楚地觀察到Eu2+的特征f-d發射寬帶.
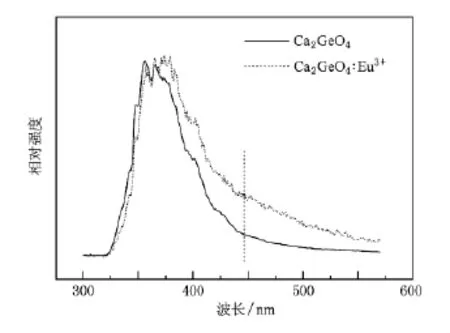
圖4 在254 nm光激發下,Ca2GeO4和Ca2GeO4∶Eu3+樣品的歸一化后的發射光譜
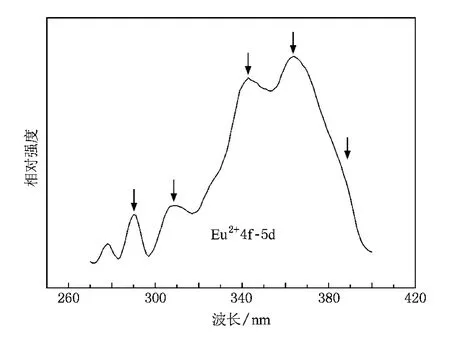
圖5 在450 nm光監控下,Ca2GeO4∶Eu3+樣品的激發光譜
以上結果表明:在空氣的制備環境中,Ca2GeO4中有一定數量的Eu3+自發地還原為Eu2+.在其他體系中(比如CaB(OH)SiO4[26],SrB4O7[27—29],SrB6O10[30],SrBPO5[31],Sr3(PO4)2[32]和Sr2B5O9Cl[33]也有類似現象.通常滿足以下4種條件之一,3價稀土離子將可能發生自還原現象[26,32,33]:1)在基質中沒有氧化離子;2)3價稀土離子摻雜必須取代不等價的陽離子,如2價堿土離子;3)復合氧化物基質中存在陰離子的剛性三維網狀結構;4)2價稀土離子與被取代的陽離子具有相近的離子半徑.在Ca2GeO4∶Eu3+體系中Eu3+可能的自還原機理如下:當Ca2+離子被Eu3+離子取代時,兩個Eu3+需要取代3個Ca2+,以保持該化合物的電中性.因此,將產生負價鈣空位,而在高溫環境中負價鈣空位將通過熱運動轉移到Eu3+附近,最終使Eu3+被還原為Eu2+[26,32,33].
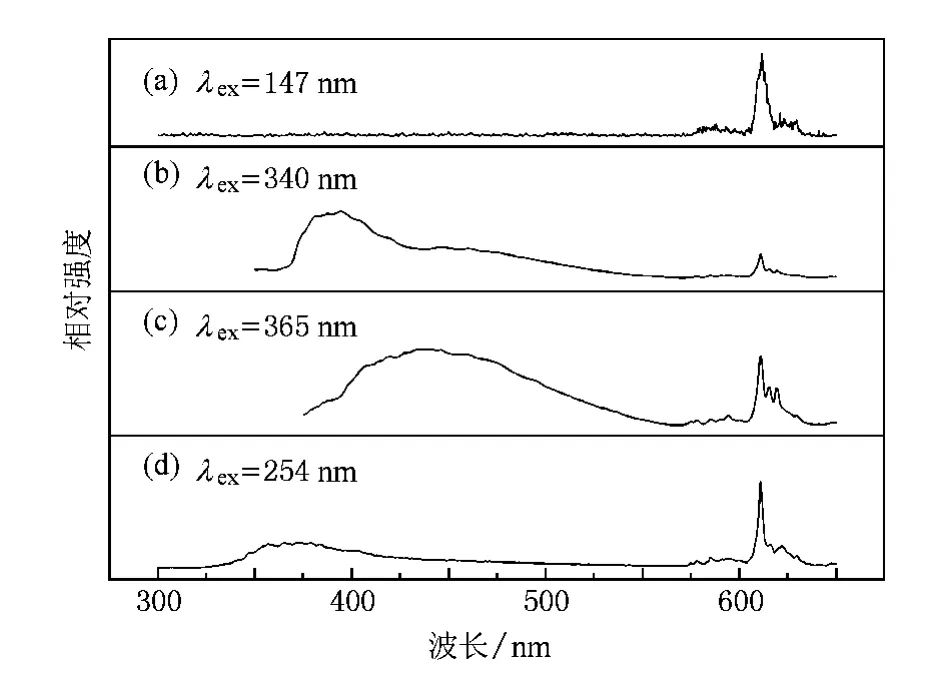
圖6 不同波長的光激發下,Ca2GeO4∶Eu3+樣品的發射光譜(a)147 nm;(b)340 nm;(c)365 nm;(d)254 nm
在不同波長激發下,我們發現一個有趣的現象:在空氣中制備的Ca2GeO4∶Eu3+可以呈現出不同的發光顏色.圖6是Ca2GeO4∶Eu3+(Eu摩爾分數為6%)樣品分別在147,340,365和254 nm激發下的發射光譜.由圖6可見:在254 nm激發下,可以觀察到在611 nm處的具有很高強度的紅光發射以及在320—550 nm相對較弱的發射寬帶.但是,在340 nm激發下,位于357 nm處的發射峰消失了,可在450和392 nm附近的發射寬帶卻相對較強,其中390 nm的發射帶歸屬于Ca2GeO4的基質發射(圖7 (a)給出了在340 nm激發下的Ca2GeO4的發射光譜),而450 nm處的相對低一些的發射帶歸屬于Eu2+的特征藍光發射.同時還注意到:用340 nm光激發時,392 nm處的發射帶強度高于450 nm處的強度,這是因為基質發射在340 nm光激發下具有更強的發射強度,如圖7(b)所示.在392 nm光監控下,Ca2GeO4基質的激發光譜在340 nm附近顯示出一個很強的激發帶,這說明340 nm的激發光不僅有效激發了Eu2+的藍光發射,也更有效地激發了Ca2GeO4的基質發射.當用365 nm光激發時,可以觀察到分別位于450和611 nm附近的Eu2+和Eu3+的特征發射,且兩者的發射強度相當.當然,在340 nm或者365 nm光激發下,其整體發光強度都比在254 nm光激發下要弱一些.如圖6(a)所示,在147 nm光激發下樣品的發射幾乎是純紅色,由于其發射相對較弱,所以發射背景雜峰較為明顯.我們可以計算出其國際發光照明委員會(CIE)色坐標值,結果如下:λex=147 nm時為(0.61,0.37);λex= 340 nm時為(0.32,0.31);λex=365 nm時為(0.30,0.28);λex=254 nm時為(0.41,0.26).同時,圖8給出了在空氣中制備的Ca2GeO4∶Eu3+樣品在不同波長光源激發下的色度坐標.這就是所謂的“顏色轉換”現象,可以想像,具有“顏色轉換”效應的發光材料能用作特殊的“交替燈”、“指示燈”、“光波探測器”等.
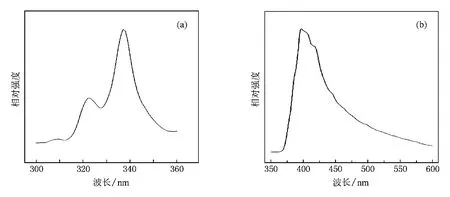
圖7 Ca2GeO4的光譜(a)在392 nm光監控下的激發光譜;(b)在340 nm光激發下的發射光譜
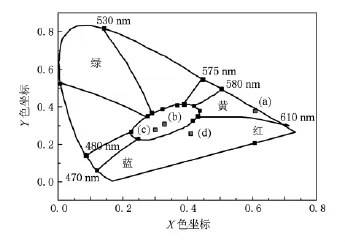
圖8 Ca2GeO4∶Eu3+樣品在不同波長光源激發下的色度坐標
圖9 給出了在611 nm光監控下,Ca2GeO4∶Eu3+(Eu摩爾分數為6%)樣品的紫外激發光譜.由圖9可見:位于322,364,383,394,415,466 nm的特征激發峰分別歸屬于Eu3+離子的7F0到5FJ,5D4,5GJ,5L6,5D3,2的躍遷.而位于301 nm的激發寬帶可以歸屬于Eu3+-O2-之間電荷遷移態.另一方面,還可以觀察到在466 nm處具有很強的線狀激發峰(激發強度約為301 nm處的1.7倍),同時在301 nm處也具有很寬的激發帶(250—350 nm,帶寬約為100 nm),這表明Ca2GeO4∶Eu3+發光材料在藍光LEDs和近紫外激發方面具有潛在的應用價值.
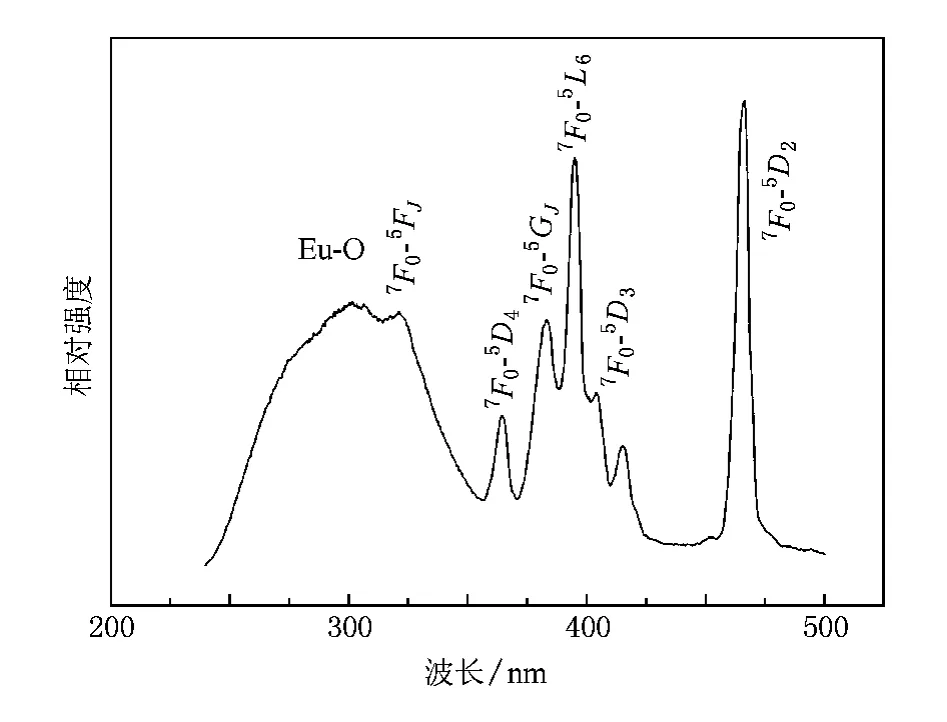
圖9在611 nm光監控下,Ca2GeO4∶Eu3+樣品的紫外激發光譜
圖10 (a)是在611 nm監控下Ca2GeO4∶Eu3+(Eu摩爾分數為6%)樣品的真空紫外激發光譜.如圖10(b)和(c)所示,我們同時測量了Ca2GeO4: Tb3+和Sr2GeO4∶Eu3+的真空紫外激發光譜用來作為對比.由圖10可見:在100—150 nm之間,3個樣品都存在一個較強的激發帶,所以這可以歸屬于GeO4四面體的基質吸收.另一方面,Ca2GeO4∶Eu3+和Ca2GeO4:Tb3+樣品的激發光譜顯示在164—180 nm有相似的吸收肩峰,但在Sr2GeO4∶Eu3+樣品的激發光譜中沒有觀察到該肩峰.因此,Ca2GeO4∶Eu3+和Ca2GeO4:Tb3+在163—230 nm的激發帶主要歸屬于Ca—O的基質吸收.一般而言,在等離子平板顯示屏和無汞燈中,真空紫外光源Xe的激發能量通常集中在以147和172 nm為主的區域內[34].因此,在163—230 nm的強激發帶意味著Ca2GeO4∶Eu3+在等離子顯示器和無汞燈方面具有潛在的應用價值.
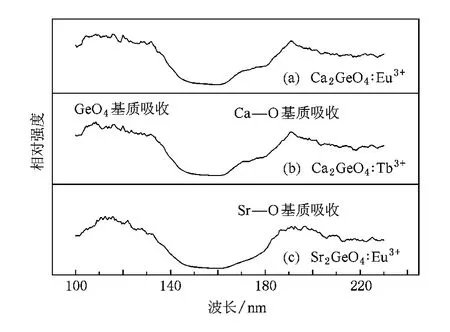
圖10 樣品的真空紫外激發光譜(a)Ca2GeO4∶Eu3+(λem= 611 nm);(b)Ca2GeO4:Tb3+(λem=541 nm);(c)Sr2GeO4∶Eu3+(λem=611 nm)
3.3.理論計算
圖11給出了Ca2GeO4晶體的實驗和計算所得的吸收光譜.圖11(a)顯示,Ca2GeO4的基質吸收應該從222 nm(5.58 eV)開始,表明Ca2GeO4在真空紫外區(100—200 nm)可能有較強的光致發光.這個吸收帶可以歸屬于Ca—O的基質吸收.該歸屬與圖10中真空紫外激發光譜符合較好.同時,我們注意到以下兩個重要現象:1)如圖7(a)所示,Ca2GeO4基質的最強激發帶位于340 nm附近,但在吸收光譜中其最強吸收卻在206 nm附近.這說明Ca2GeO4的價帶中被激發電子并沒有進入導帶,而是直接被禁帶中的發光中心能級所俘獲,從而產生缺陷發光,而這些基質發光現象中的發光中心通常被認為是在制備過程中由于高溫等諸多條件產生的氧空位.2)Ca2GeO4基質在340 nm處的吸收較弱,但卻有較強激發強度的現象,這可能源自基質在340 nm光激發下所吸收的能量能更有效地被傳遞給發光中心.
另一方面,與通過測量所得的Ca2GeO4的吸收光譜相對應,圖11(b)給出了基于第一性原理計算所得的理論吸收光譜,從圖11(b)可以看出:其基質吸收邊緣在4.28 eV,這表明實驗和理論計算之間的結果有差異.因為GGA程序通常低估了能帶帶隙的大小,所以這個差異是常見的[35].這種差異還意味著理論和實驗結果的能隙修正值約為1.3 eV,這可以用于Ca2GeO4晶體能帶結構的修正.
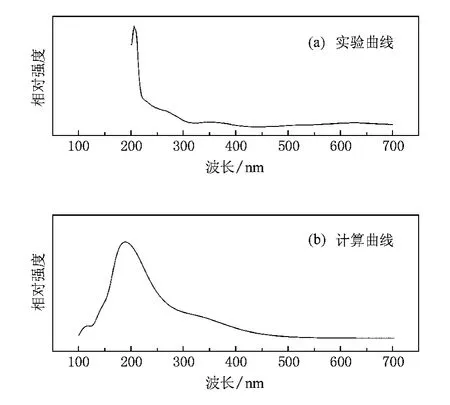
圖11 Ca2GeO4晶體的實驗吸收光譜以及基于第一性原理理論計算的吸收光譜
圖12 是基于第一性原理利用CASTEP程序中的GGA模塊計算所得的Ca2GeO4晶體的能帶結構圖.由圖12可見:Ca2GeO4晶體是一種基于G點的直接帶隙基質材料,其導帶底和價帶頂間的能隙約為4.08 eV.然而,該計算結果應該用能隙修正值(1.3 eV)予以修正,最終得到的修正值為5.38 eV.此外在Z,T,Y,S,X,U和R點的間接帶隙值分別為6.03,6.93,6.87,6.71,6.26,6.65和6.97 eV.
圖13給出了Ca2GeO4的全部和部分態密度圖.由圖13可見:Ca2GeO4的價帶組成主要來源于O2p,Ge3 p(3 s)的雜化軌道;Ca2GeO4的導帶底部主要由Ca4 s(3p)軌道構成,同時也雜化了部分Ge (4 p)軌道.從真空紫外激發光譜上可以看出,基于Ge—O的基質吸收主要位于150 nm(8.26 eV)以上,因此,對價帶頂以下0—3 eV附近的電子態應歸屬于GeO4四面體的吸收.從上述討論可以推斷真空紫外區域的高能基質吸收主要源自價帶中的O2 p,Ge3 p(3s)軌道以及導帶中的Ca4s(3p)和Ge4 p軌道.
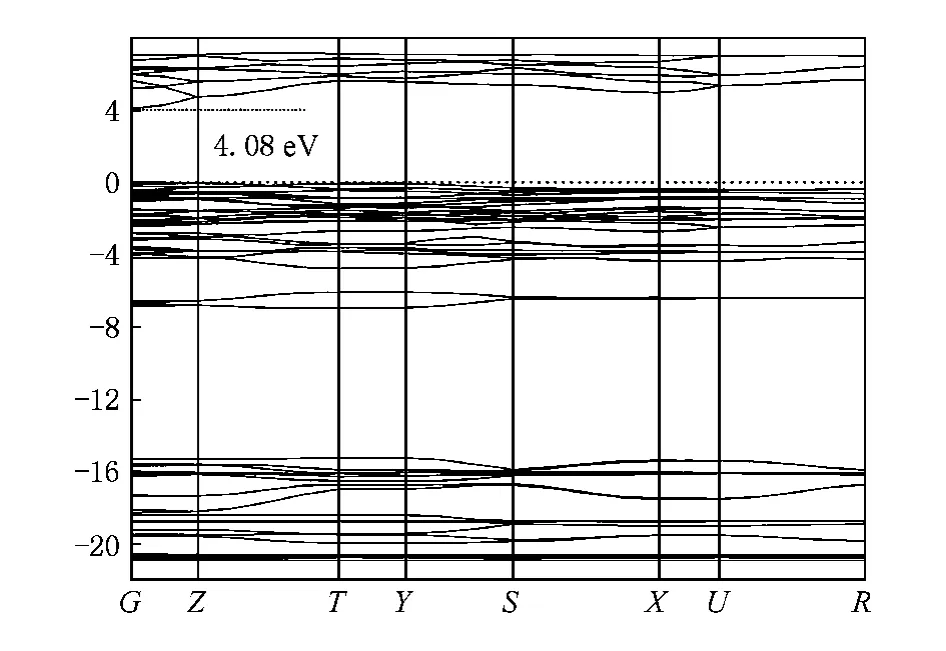
圖12 Ca2GeO4晶體的能帶結構圖

圖13 Ca2GeO4晶體的總體和局部態密度圖
4.結論
由高溫固相法成功制備了Ca2GeO4∶Eu3+粉末樣品.由于Ca2+離子空位的存在,Ca2GeO4晶體中的一些Eu3+在空氣中自發地還原為Eu2+.在不同波長光源激發下,在空氣中制備的Ca2GeO4∶Eu3+樣品呈現出不同的顏色.對紫外-真空紫外激發光譜的研究結果表明:GeO4四面體的基質吸收位于100—150 nm,而在163—230 nm范圍內的強激發可以歸屬于Ca—O的基質吸收.其在466 nm具有較強的激發強度,同時在301 nm處存在一強激發寬帶,這意味著Ca2GeO4∶Eu3+發光材料在等離子平板顯示、無汞照明燈以及LEDs等方面具有潛在的應用價值.基于第一性原理的理論計算結果表明: Ca2GeO4是一種直接能隙的基質材料,其計算所得的帶隙值是4.08 eV,修正后為5.38 eV.Ca2GeO4中對應于真空紫外強吸收帶的能帶結構主要由價帶中的O(2p),Ge3 p(3s)軌道和導帶中的Ca4 s (3p),Ge4 p軌道構成.
[1]Chen X B,Zhang G Y,Chen J K,Wang Y H,Liu B,Shang M R,Li J W 1993 Chin.Phys.2 695
[2]Wang Z J,Li P L,Wang G,Yang Z P,Guo Q L 2008 Acta Phys.Sin.57 4575(in Chinese)[王志軍、李盼來、王剛、楊志平、郭慶林2008物理學報57 4575]
[3]Zhang J C,Wang Y H 2008 Chin.Phys.Lett.25 1453
[4]Xiao T,Kitai A H,Liu G,Nakau A 1997 Digest of Technical Papers 1997 SID International Symposium Boston,USA p 415
[5]Liu J D,Wang Y H 2010 Acta Phys.Sin.59 3558(in Chinese)[劉吉地、王育華2010物理學報59 3558]
[6]Zhao F,Guo P M,Li G B,Liao F H,Tian S J,Jing X P 2003 Mater.Res.Bull.38 931
[7]Guo P M,Zhao F,Li G B,Liao F H,Tian S J,Jing X P 2003 J.Lumin.105 61
[8]Jiang Z Q,Wang Y H,Ci Z P,Jiao H Y 2009 J.Electrochem.Soc.156 J 317
[9]Toda K J,Imanari Y,Nonogawa T 2003 Chem.Lett.32 346
[10]Yang H M,Shi J X,Liang H B,Gong M L 2006 Mater.Res.Bull.41 867
[11]Yang H M,Shi J X,Gong M L,Liang H B 2010 Mater.Lett.64 1034
[12]Brunold T,Herren M,Oetliker U,Giidel H U,Kesper U,Albrecht C,Reinen D 1994 J.Lumin.60/61 138
[13]Evans J M,Petricevic V,Bykov A B,Alfano R R 1997 Opt.Lett.22 1171
[14]Hohenberg P,Kohn W 1964 Phys.Rev.136 B864
[15]Kohn W,Sham L J 1965 Phys.Rev.140 A1133
[16]CASTEP 3.5 1997 Molecular Simulations Inc.
[17]Payne M C,Teter M P,Allan D C,Arias T A,Joannopoulos J D 1992 Rev.Mod.Phys.64 1045
[18]Rappe A M,Rabe K M,Kaxiras E,Joannopoulos J D 1990 Phys.Rev.B 41 1227
[19]Lin J S,Qteish A,Payne M C,Heine V 1993 Phys.Rev.B 47 4174
[20]Kleinman L,Bylander D M 1982 Phys.Rev.Lett.48 1425
[21]Hahn E 1970 Z.Kristallogr.131 322
[22]Bergerhoff G,Berndt M,Brandenburg K 1996 J.Res.Natl.Inst.Stand.Technol.101 221
[23]Brandenburg K,Berndt M 1999 J.Appl.Cryst.32 1028
[24]Thim G P,Brito H F,Silva S A,Oliveira M A S,Felintoc M C F C 2003 J.Solid.State.Chem.171 375
[25]Wu X C,Song W H,Zhao B,Sun Y P,Du J J 2001 Chem.Phys.Lett.349 210
[26]Gaft M L,Gorobets B S 1979 J.Appl.Spectrosc.(USSR)31 1488
[27]Pei Z,Su Q,Zhang J 1993 Alloy J Compd.198 51
[28]Peterson J R,Xu W,Dai S 1995 Chem.Mater.7 1686
[29]Liang H,He H,Zeng Q,Wang S,Su Q,Tao Y,Hu T,Wang W,Liu T,Zhang J,Hou X 2002 J.Electron.Spectrosc.Relat.Phenom.124 67
[30]Zeng Q,Pei Z,Wang S,Su Q 1999 Chem.Mater.11 605
[31]Liang H B,Su Q,Tao Y,Hu T D,Liu T 2002 J.Phys.Chem.Solid.63 719
[32]Liang H,Tao Y,Su Q,Wang S 2002 J.Solid.State.Chem.167 435
[33]Pei Z,Zeng Q,Su Q 1999 J.Solid.State.Chem.145 212
[34]Zeng X Q,Im S J,Jang S H,Kim Y M,Park H B,Son S H,Hatanaka H,Kim G Y,Kim S G 2006 J.Lumin.121 1
[35]Jones R O,Gunnarsson O 1989 Rev.Mod.Phys.61 689
PACS:78.55.Hx,81.05.Zx
*Project supported by the Young Scicentist Fund of the National Natural Science Foundation of China(Grant No.502041032)and the National Innovation Experimental Program for University Student,China(Grant No.101073005).
Corresponding author.E-mail:zhangjch@lzu.edu.cn
Electronic structure and photoluminescence properties
of Ca2GeO4∶Eu3+in ultraviolet and vacuum ultraviolet region*
Qin Qing-Song Yu Ming-Hui Zhou Hong-Liang Zhou Mei-Jiao Xiang Xiao-Tian Li Xiao-Di Zeng Jun-Xi Zhang Jia-Chi
(Key Laboratory for Magnetism and Magnetic Materials of Ministry of Education,Lanzhou University,Lanzhou 730000,China)
(Received 1 August 2010;revised manuscript received 1 September 2010)
Red emitting Ca2GeO4∶Eu3+phosphors are synthesized by solid state method.The ultraviolet and vacuum ultraviolet excited photoluminescence properties are investigated in detail.The phenomenon of reduction of Eu3+ions in air and the color switches are discovered and explained.The Ca2GeO4∶Eu3+presents intense excitation intensities at 163—230,301 and 466 nm,showing the potential applications in plasma display panels and light emitting diodes.The excitation spectra are studied to identify the photoluminescence mechanism of Ca2GeO4∶Eu3+.First principles calculation within the local density approximation of the density functional theory is used to calculate the electronic structure and the linear optical properties of Ca2GeO4.
Ca2GeO4∶Eu3+,photoluminescence mechanism,reduction in air,color switch
*國家自然科學青年科學基金(批準號:502041032)和國家大學生創新實驗計劃(批準號:101073005)資助的課題.
.E-mail:zhangjch@lzu.edu.cn

