對醫療器械上市后追溯和召回制度的設計
北京市藥品監督管理局房山分局 王巖

▲北京市藥監局房山分局工作人員在醫療器械輸出企業調研產品追蹤的方式方法
近年來,醫療器械風險在臨床使用中日益增加,監管部門對產品上市后的監控也在不斷加強。加強醫療器械生產企業對產品的可追溯性和產品召回等管理,即強化醫療器械采購、生產、檢驗的質量控制及產品流向全過程的控制。筆者就醫療器械生產企業產品追溯體系的建立進行了調研。調研發現,生產企業產品銷售到代理商,經銷商分銷記錄填寫不完善,致使無法追溯到臨床使用,從而無法完成召回,這些問題亟須解決。筆者就其中企業產品可追溯程度和追溯途徑進行了闡述。
1 產品可追溯程度
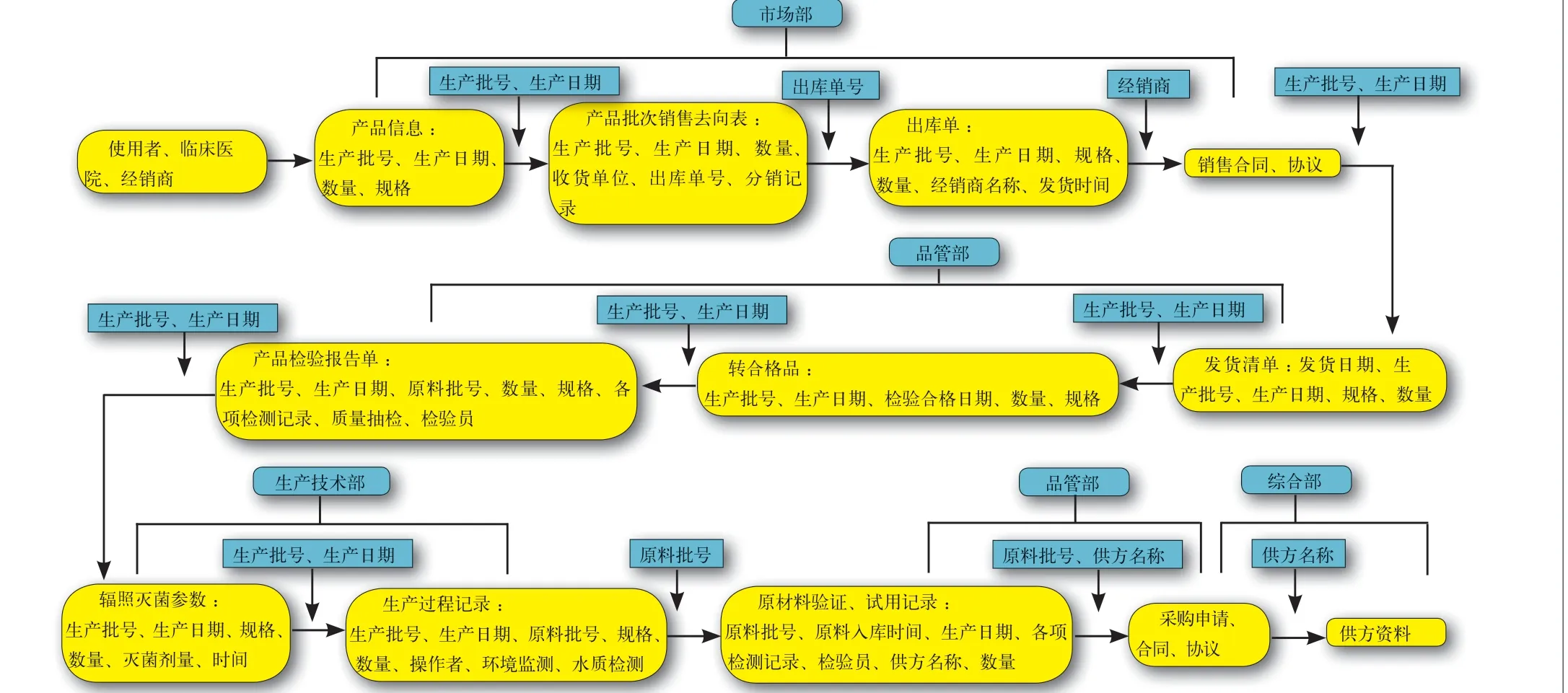
1.1 采購方面 原材料的采購,應該可以追溯到供方,并保留每批原料的采購記錄,記錄應包括采購申請(申請時間、申請人、批準人、原料名稱、數量、規格、采購單位、到貨時間)、采購廠家、數量、批號、生產日期、驗收記錄、供方資料等。
1.2 生產過程 應能追溯到工序操作者和檢驗員,每批/天的產品都應保留原料領用記錄、生產記錄和檢驗記錄,原料領用記錄應明確批號、名稱、數量、領用時間;生產記錄應明確原料批號、生產批號、生產日期、數量、規格、關鍵特殊工序參數記錄和各工序的操作者;檢驗記錄應明確原料批號、生產批號、生產日期、數量、規格、各項目檢測結果、檢驗者、審核者;還應留存每批產品生產環境和水質檢測記錄,明確檢測時間、檢測者、各項目檢測記錄。
1.3 銷售記錄 應可以追溯到經銷商和臨床醫院,企業應保留銷售記錄,記錄包括產品流向表、銷售合同、出庫單、合同評審、分銷記錄,記錄代理商名稱、產品生產批號、生產日期、數量、代理商資質證明等,并按照規定進行顧客滿意度調查和臨床應用調查。
2 產品可追溯性途徑及其信息或標識
2.1 產品標識程序文件 在整個追溯過程中,產品生產批號、生產日期和檢驗日期等貫穿于產品實現的全過程,是產品整個過程跟蹤的唯一標識。因此,建立產品標識控制相關程序文件,避免因標識不清楚而無法實現產品的追溯是重中之重(標識可分為產品標識和狀態標識)。見附圖1。

▲北京市藥監局房山分局工作人員查驗產品流通記錄
2.2 內部質量程序文件 針對產品流入到市場后的控制,企業就應對已售出產品進行質量跟蹤,并在企業內部程序文件中明確一些要求:每年最少向顧客發出一次顧客滿意度調查表,全方面地了解產品質量、售后服務、交貨期、與同類產品相比較等情況;每年最少發放一次臨床應用調查表,調查表主要針對代理商或醫院臨床科室對產品質量的意見或建議,以及產品規格、尺寸在應用中是否合適及改進等;通過面談、電話、傳真等方式向醫院、經銷商了解對產品質量、服務等的意見和建議。將收集到的信息填寫質量信息反饋單,反饋到相關部門,采取糾正措施和預防措施;產品不直接進入臨床的,還可以向經銷商發放分銷記錄,要求經銷商認真填寫每批產品的具體流向,從而實現產品的追溯。2.3 不良事件發布及控制程序 遇特殊情況,如同類產品發生不良事件時可增加發放臨床應用調查表的頻次,明確具體要求。產品一旦發生質量問題或可疑不良事件時,啟動不良事件報告程序、不良事件處理制度、可追溯性程序和忠告性通知發布和實施控制程序,明確可疑不良事件的報告原則、處理組織機構、報告時限、方法及報告程序等。企業各部門及時收集產品或同行業不良事件,建立了不良事件檔案,同時根據每批或每天產品的去向表查到銷售到哪些經銷商和醫院,并根據產品造成傷害事件的可能性、嚴重程度、影響范圍和后果制定召回計劃并實施召回。經銷商或醫院對涉及產品召回流程:經銷商或醫院確認產品缺陷后,制定召回計劃并向監管部門提交報告,通知經銷商和使用醫院停止銷售和使用產品,按計劃召回后,向藥品監管部門提交召回效果評估報告,按要求對召回產品進行處理。
2.4 重視對產品召回的管理 加強對產品召回的管理,提高召回產品重要性的認識,應本著對消費者負責,對自己負責的態度,不斷增強誠信守法意識,落實召回管理辦法,保證醫療器械使用的安全有效,進一步減少對消費者的危害。如對于召回有難度的醫院,可以派專人去協調解決。
附圖1 可追溯性流程圖

附圖2 經銷商或醫院對涉及產品召回流程

