綠色木霉產內切殼聚糖酶的鑒定及酶學性質的研究
劉 萍,劉 靖,祁興普,夏文水
(1.江蘇省畜產品深加工工程技術研究開發中心,江蘇畜牧獸醫職業技術學院,江蘇泰州 225300; 2.江南大學食品學院,食品科學與技術國家重點實驗室,江蘇無錫 214122)
綠色木霉產內切殼聚糖酶的鑒定及酶學性質的研究
劉 萍1,劉 靖1,祁興普1,夏文水2
(1.江蘇省畜產品深加工工程技術研究開發中心,江蘇畜牧獸醫職業技術學院,江蘇泰州 225300; 2.江南大學食品學院,食品科學與技術國家重點實驗室,江蘇無錫 214122)
以實驗室前期從Trichoderma virideXW01微晶纖維素誘導的發酵液中分離純化的一種新殼聚糖酶組分Csn為對象,采用SDS-PAGE分析、不同反應時間水解產物的粘度測定和薄層層析(TLC)分析、還原糖含量的測定等手段對殼聚糖酶Csn進行了初步鑒定及酶學性質研究,結果顯示:Csn的分子量為45ku,最適作用溫度和最適pH分別為60℃和pH5.0,在低于50℃、pH4.8~7.5范圍內非常穩定;脫乙酰度DD對Csn的催化速率影響顯著,其對83%DD的殼聚糖的催化活力最高;金屬離子Mn2+、Mg2+、Ca2+、Zn2+對該酶有明顯的促進作用,而Fe3+、Cu2+和Hg2+則對該酶有強烈的抑制作用;該酶的米氏常數為1.10mg/mL,最大反應速度為7.15μmol/mL·min;該酶以內切方式作用于殼聚糖,主要水解GlcNAc-GlcN和GlcN-GlcN之間的糖苷鍵,水解產物以四糖以上的殼寡糖為主。
綠色木霉,殼聚糖酶,酶學性質,作用模式
殼聚糖(chitosan)是一種從海洋水生甲殼類動物外殼或真菌細胞壁中提取的天然多糖,它是由氨基葡萄糖(GlcN)和少量乙酰氨基葡萄糖(GlcNAC)通過β-1,4鍵連接而成的天然線性高分子聚合物,殼聚糖為含氮多糖類生物活性物質,具有對人體十分重要的生理功能。但由于殼聚糖分子量大,水溶性差,在人體內不易吸收,使其應用受到限制;而經殼聚糖降解得到的殼寡聚糖不僅具有水溶性好、易吸收等優點,近年來更發現其還具有許多獨特的生理活性和功能性質[1],其應用前景在食品、醫藥、保健品方面倍受矚目。因而如何制備殼寡糖成為人們研究的熱門課題。綠色木霉是生產商品纖維素酶的主要絲狀真菌之一,近十年來很多研究者發現其發酵產物同時可以降解殼聚糖,國內外已經在實驗室范圍內廣為利用綠色木霉發酵制備甲殼低聚糖[2-5]。但是目前為止,對綠色木霉在纖維素類碳源或殼聚糖碳源誘導條件下產殼聚糖酶組分的分離鑒定尚不完全,除了夏文水等人分離鑒定的具有氨基葡萄糖苷酶活性的CBHI酶(66ku)[6]以及趙玉萍等人分離的內切殼聚糖酶組分(51ku)[7]外,尚未有其它報道。本研究對從綠色木霉(Trichoderma virideXW-01)經微晶纖維素誘導的發酵產物中分離提取出一個新殼聚糖酶組分Csn,通過十二烷基磺酸鈉-聚丙烯酰胺凝膠電泳(SDS-PAGE)、薄層層析(TLC)、還原糖含量分析(DNS)等方法對其水解殼聚糖的作用模式及酶學性質進行了分析,為利用綠色木霉這一潛在優良殼聚糖酶源發酵制備殼寡糖提供了一定的數據參考。
1 材料與方法
1.1 材料與儀器
純化酶Csn凍干粉 經DEAE-sepharose CL6B、phenyl sepharose CL4B和 sephadex G75柱層析純化后冷凍干燥制得,活力為5.96U/mg;殼聚糖Ⅰ 脫乙酰度71.75%、相對分子質量6.03×105;殼聚糖Ⅱ脫乙酰度83%、相對分子質量5.21×105;殼聚糖Ⅲ
脫乙酰度91%、相對分子質量8.8×105;殼聚糖Ⅳ
脫乙酰度92.7%、相對分子質量5.12×105;殼聚糖Ⅴ 脫乙酰度96.7%、相對分子質量4.3×105,均為實驗室由蟹殼經堿處理制得;殼寡糖標樣(GlcN)2-6
日本燒津水產化學株式會社;丙烯酰胺(Acr)、N,N″-亞甲基雙丙烯酰胺 Fluka公司,電泳級;四甲基乙二胺(TEMED) Amersham公司;β-巰基乙醇
Janssen Chimica公司;氨基葡萄糖鹽酸鹽、考馬斯亮蘭R-250 Sigma公司,分析純;低分子量蛋白質marker 碧云天生物技術有限公司,生化試劑;薄層層析用硅膠G 青島海洋化工有限公司生產;其它試劑均為國產分析純。
Mini型蛋白質電泳儀 0.75mm厚度制膠板,美國BioRad公司;UV-754紫外分光光度計 上海菁華科技儀器有限公司;HHS-11-2電熱式恒溫水浴鍋 江蘇金壇宏凱儀器廠;TGL-16C臺式高速離心機 上海安亭科學儀器廠;FA2004電子天平 上海天平儀器廠;NDJ-7型旋轉式粘度計 上海精密科學儀器有限公司;ELS20實驗室pH計 瑞士梅特勒-托利多儀器(上海)有限公司。
1.2 實驗方法
1.2.1 殼聚糖酶Csn的SDS-PAGE分析 參照文獻[8],分離膠濃度為10%,濃縮膠濃度為5%,電泳采用pH8.3的 Tris-甘氨酸緩沖體系,考馬斯亮藍R-250染色。
1.2.2 殼聚糖酶酶活力測定方法 DNS法[9]。殼聚糖酶活力單位定義:在最適溫度和最適pH下酶與底物反應,每分鐘形成1μmol氨基葡萄糖所需要的酶量。
1.2.3 溫度對Csn酶活性和穩定性的影響 分別移取適當稀釋的酶液0.5mL,加入1.5mL不同的底物溶液中,搖勻,在20、30、40、45、50、55、60、70、80℃下反應30min測定酶活,以確定最適反應溫度;此外,預先將殼聚糖酶Csn在以上各溫度中保溫30min,然后按照酶活力測定方法測定殘余酶活力。以各溫度下初始酶活力為各溫度下的對照(100%),研究溫度對殼聚糖酶Csn穩定性的影響。底物條件為:濃度均為0.5%,殼聚糖溶液pH為5.2。
1.2.4 pH對Csn酶活性和穩定性的影響 分別用0.2mol/L的不同pH的醋酸-醋酸鈉(pH3.6~5.8)、磷酸鹽(pH6.0~7.5)的緩沖溶液配制0.5%殼聚糖溶液,加入0.5mL酶液,60℃反應30min,按照酶活力測定方法測定酶活力,以活力最高者為100%對照,確定酶最適反應pH。
預先將殼聚糖酶Csn與以上各pH緩沖液等體積混合,置于4℃保存6h,然后按照酶活力測定方法測定殘余酶活力。以各pH條件下初始酶活力為各自對照(100%),研究pH對殼聚糖酶Csn穩定性的影響。
1.2.5 底物特異性測定 將不同脫乙酰度和不同相對分子質量的殼聚糖分別配制成濃度為0.5%(w/v)和pH為5.0的殼聚糖溶液,各取1.5mL底物與0.5mL酶液在60℃反應30min,測定殼聚糖活力大小,以活力最高者為100%,計算不同殼聚糖作底物時的相對活力。
1.2.6 殼聚糖酶Csn的動力學分析 分別配制pH為5.0的不同濃度的殼聚糖底物溶液,并使其1/[S]成等差級數,依次分別為0.2、0.4、0.5、0.8、1.0、1.25、2、2.5、5mg/mL,分別移取 Csn酶液 0.5mL,加入1.5mL不同濃度的底物溶液中,搖勻,分別于60℃反應30min,測定其殼聚糖酶活力。采用雙倒數法(Lineweaver-Burk)[10]來測定Csn酶的Km、Vmax。
1.2.7 金屬離子對Csn酶活力的影響 將不同的無機鹽溶液以及EDTA溶液與等量酶液混合,并使混合液中的無機鹽及EDTA的最終濃度達到0.5mmol/L,按1.2.2的方法測定酶活力,設不加金屬離子組為對照組,測定金屬離子對Csn酶活力的影響。
1.2.8 殼聚糖經Csn水解過程中的粘度變化 用pH5.0的醋酸緩沖液配制50mL0.5%的殼聚糖溶液,加入1%的殼聚糖酶溶液(酶底比),在50℃反應,每隔一段時間用快速粘度測定法[7]測定反應體系的粘度,繪制粘度隨時間變化的曲線。
1.2.9 Csn作用殼聚糖的水解模式分析 在0.5% (w/v)、pH5.0的殼聚糖溶液中加入1%的粗酶液和Csn酶液,50℃恒溫水浴中分別水解24h和48h,沸水浴滅酶后取等量水解產物點樣于硅膠薄板,用1mg/mL的氨基葡萄糖和殼寡糖標樣做對照。置于層析缸中在展開劑(異丙醇∶水∶氨水=70∶30∶1,V/V/V)中上行展開,展開完畢后,在100℃的烘箱中烘干,再用0.5%的茚三酮乙醇溶液(w/v)作為顯色劑,在105℃干燥箱中顯色20min[6]。
2 結果與分析
2.1 殼聚糖酶Csn的SDS-PAGE分析
SDS-PAGE被廣泛應用于蛋白質純度的鑒定和相對分子質量的測定[11]。將粗酶和純化殼聚糖酶Csn進行SDS-PAGE電泳,以初步鑒定Csn酶組分的純度和相對分子量,結果見圖1。
由圖1可以看出,粗酶(泳道1)中蛋白條帶較多,經離子交換層析和疏水層析等一系列柱層析純化后,得到一條45ku大小的條帶(泳道2),表明殼聚糖酶Csn已達到電泳純,結合前期的凝膠層析結果證實該酶為單亞基蛋白,SDS-PAGE法測得的分子量大小約為45ku。
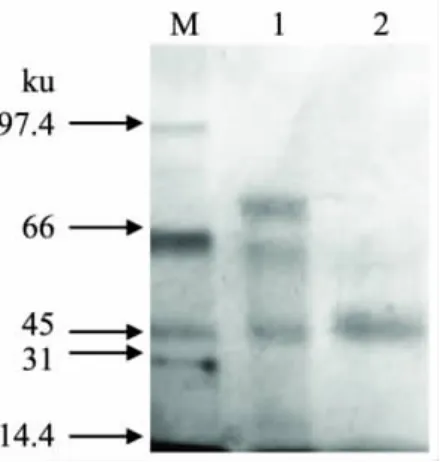
圖1 殼聚糖酶Csn的SDS-PAGE電泳圖譜注:1為纖維素酶粗酶液;2為純化后的
2.2 殼聚糖酶Csn的最適反應溫度及熱穩定性分析
以殼聚糖Ⅱ為底物,研究溫度對殼聚糖酶Csn的酶活力和穩定性的影響,結果見圖2。
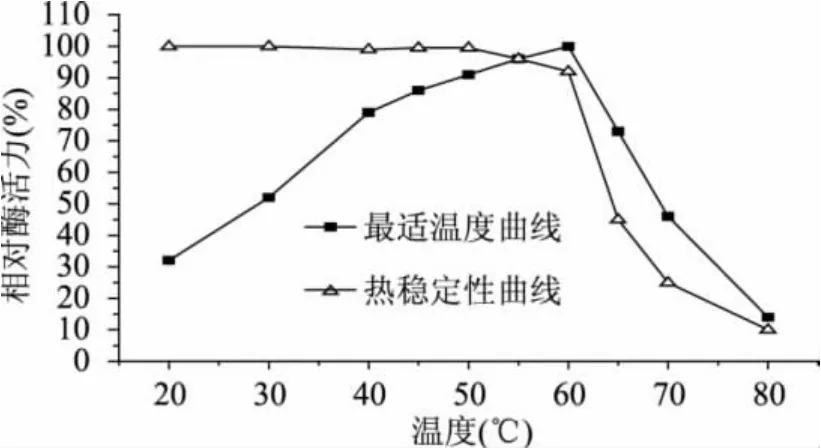
圖2 溫度對殼聚糖酶Csn的酶活力和穩定性的影響
由圖2可以看出,該殼聚糖酶Csn在45~60℃之間活性較強,溫度低于60℃時酶活力隨著溫度的升高而增強,在60℃過后隨著溫度的升高酶活力急劇下降,由此可以看出殼聚糖酶Csn的最適反應溫度為60℃,這與趙玉萍等人已報道的綠色木霉在殼聚糖誘導條件下產生的內切殼聚糖酶[7]并不相符,由此可初步推測:綠色木霉在纖維素類碳源和殼聚糖類碳源中誘導產生的殼聚糖降解組分并不完全相同,這有待深入探究。
從殼聚糖酶Csn的熱穩定性曲線可知,殼聚糖酶Csn在20~50℃之間穩定性很好,保溫30min其殼聚糖酶活性基本保持不變;當溫度升至50~60℃之間時,其殼聚糖酶活力緩慢下降,但仍保留有90%以上的活力,初步表明殼聚糖酶Csn非常穩定;當溫度超過60℃時,酶高溫失活,導致殘余酶活力急劇下降。
2.3 pH對殼聚糖酶Csn酶活力及穩定性的影響
pH對殼聚糖酶Csn酶活力及穩定性的影響見圖3。
由圖3可知,pH對殼聚糖酶Csn的酶活力的影響呈倒V型,Csn的最適反應pH為5.0,且在pH4.5~5.5的范圍內具有較高的酶活力(80%以上)。pH<5.0時,隨著pH的上升Csn酶活力近似呈線性增加,而pH>5.0時酶活力則急劇下降;這是因為在pH< 4.0的強酸條件下,酶蛋白結構變性失活;而當pH>5.5時殼聚糖因為溶解性下降而出現絮狀沉淀,酶和底物不能接觸從而導致酶活力急劇下降。
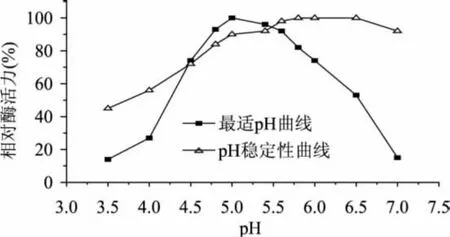
圖3 pH對殼聚糖酶Csn的酶活力和穩定性的影響
圖3的pH穩定性曲線表明,殼聚糖酶Csn活性在pH4.8~7.5之間有較好的穩定性,孵育6h殘余酶活力仍維持在80%以上的初始酶活力;而在pH4.0~4.8范圍內酶活力損失較大,結合最適反應pH曲線: Csn在pH4.5~5.5的范圍內具有較高的酶活力,可初步推測Csn的等電點在pH4.0~4.8范圍內[11]。
2.4 殼聚糖酶Csn的底物特異性分析
選擇五種不同脫乙酰度和粘均分子量的殼聚糖作為底物,在殼聚糖酶Csn催化下進行水解,其結果見表1。
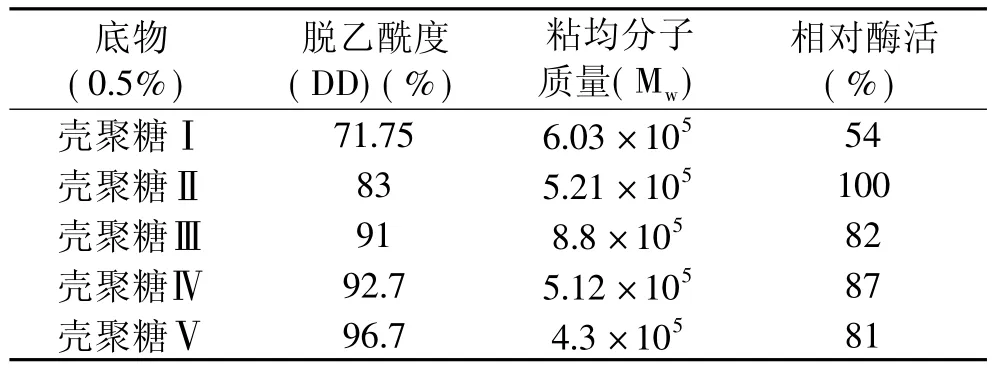
表1 Csn的底物特異性
由表1可知,殼聚糖的脫乙酰度對酶催化能力影響較粘均分子量更為顯著,Csn對于脫乙酰度(DD)為83%的殼聚糖顯示了最強的活力,將該活力定為100%。從Csn對殼聚糖Ⅱ和殼聚糖Ⅳ兩個粘均分子質量相近的底物的水解能力看,當DD>83%時,脫乙酰度小的殼聚糖底物更易被Csn水解,由此可以推測該酶主要水解GlcNAc-GlcN之間的糖苷鍵;同時Csn酶對DD90%以上的殼聚糖也具有較高的降解能力,表明Csn酶還可以降解GlcN-GlcN之間的糖苷鍵;且當脫乙酰度相近時(殼聚糖Ⅲ和殼聚糖Ⅳ),粘均分子量越小,Csn酶的催化能力越強。Csn酶對71.75%DD的殼聚糖的降解活力很低,表明該酶不能水解GlcN-GlcNAc和GlcNAc-GlcNAc之間的糖苷鍵。
已知殼聚糖酶根據底物特異性被分為三類:殼聚糖酶Ⅰ可以同時切割GlcNAc-GlcN和GlcN-GlcN鍵;殼聚糖酶Ⅱ只能切割GlcN-GlcN鍵;而殼聚糖酶Ⅲ能切割GlcN-GlcN和GlcN-GlcNAc之間的糖苷鍵[12],由此可初步推測Csn酶屬于殼聚糖酶I類。
2.5 殼聚糖酶Csn的動力學常數測定
以不同濃度的殼聚糖溶液作為反應底物,按照酶活力測定方法,進行反應30min,測定殼聚糖酶的酶活力。殼聚糖濃度的倒數為橫坐標,以殼聚糖酶活力作為縱坐標,根據Lineweaver-Burk作圖,結果見圖4。殼聚糖酶Csn的酶促反應動力學遵循米氏方程,經曲線擬合,計算出Csn的殼聚糖的米氏常數Km和Vmax分別為1.10mg/mL和7.15μmol/mL·min。
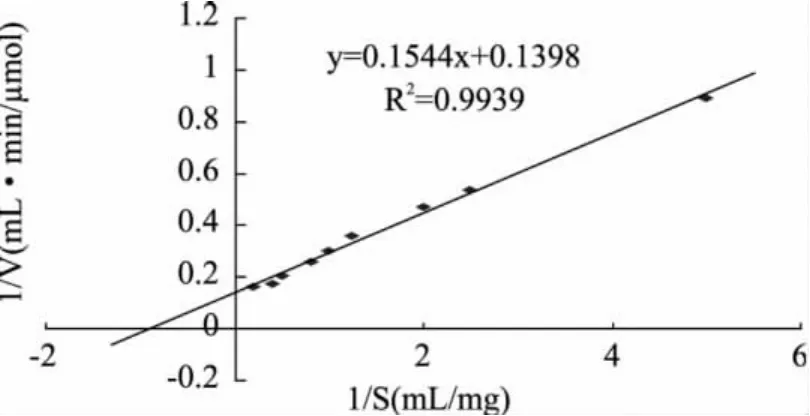
圖4 殼聚糖酶Csn動力學曲線
2.6 金屬離子對Csn酶活性的影響
金屬離子對殼聚糖酶Csn酶活力影響見表2。金屬離子Mn2+、Mg2+、Ca2+、Zn2+對酶Csn有一定的激活作用,尤其以Mn2+和Mg2+為最;而Fe3+、Cu2+和Hg2+則對酶有強烈的抑制作用,這與已報道的殼聚糖酶性質基本一致[13]。在酶反應體系中加入金屬螯合劑EDTA,沒有觀察到對酶活性的抑制作用,表明Csn酶的活性中心沒有金屬離子的參與。
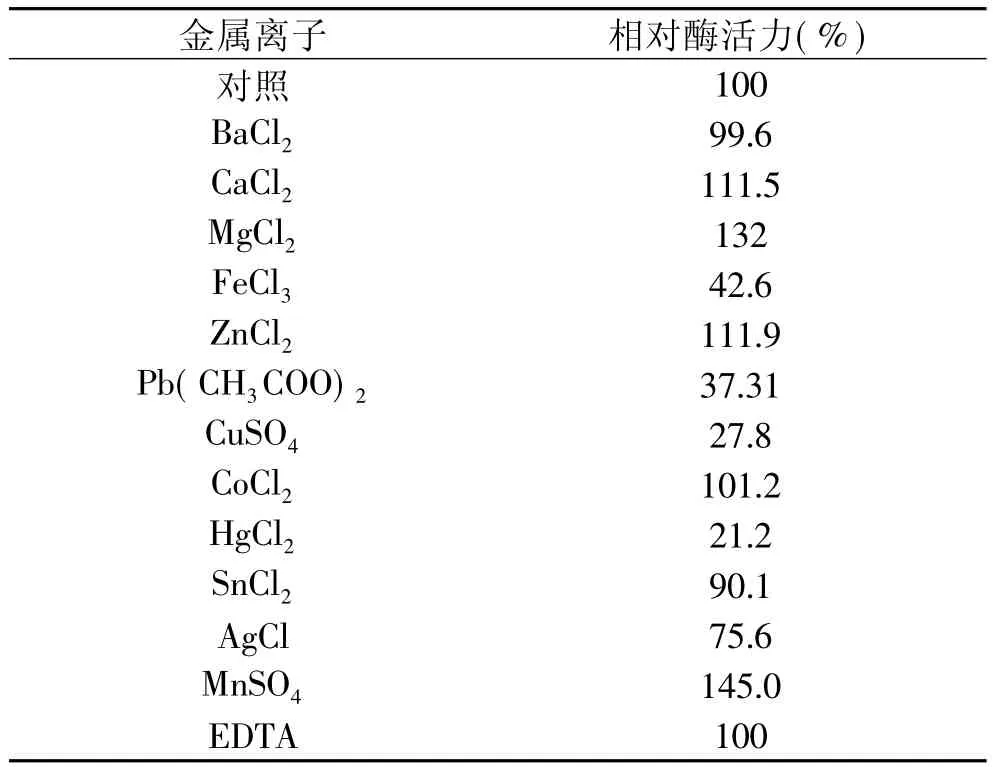
表2 金屬離子對Csn酶活力的影響
2.7 殼聚糖酶降解反應體系粘度的變化
不同反應時間粗酶制劑及酶Csn水解殼聚糖反應體系的粘度變化曲線如圖5所示。在加酶量相同的條件下,粗酶和Csn兩個反應體系的粘度在反應初始階段均呈現迅速下降趨勢,但是酶Csn水解液的粘度下降更迅速,反應1h以后,其粘度下降趨于平穩,粘度降低87.5%;而粗酶反應1h后粘度下降62%,在反應2h后粘度下降趨于平穩。這一結果表明Csn酶以內切方式作用于殼聚糖,也是粗酶制劑中導致殼聚糖溶液粘度下降的關鍵組分。加酶量相等條件下,粗酶催化殼聚糖能力低于純酶Csn,這是因為粗酶中含有多種酶蛋白組分,如2種外切氨基葡萄糖苷酶組分[14]、多種纖維素酶組分等[15],阻礙了酶與殼聚糖底物的有效接觸,因此酶的水解速率也隨之被降低。
2.8 Csn酶作用殼聚糖水解產物的TLC分析
殼聚糖Ⅱ經粗酶和Csn酶降解后的產物經薄層層析分析,結果如圖6所示。
從圖6可以看出,盡管Csn純酶和粗酶的水解產物均以低聚糖為主,但其作用方式與產物和粗酶并不完全相同,粗酶的水解產物中除含有寡糖外,尚含有少量的氨基葡萄糖單糖,這和我們前期報道纖維素酶粗酶制劑中含有雙功能的β-1,4-氨基葡萄糖苷酶相一致[6];而殼聚糖經Csn酶水解24h和48h的水解產物中均不含氨基葡萄糖單糖,殼寡糖含量達到95%以上,且以四糖以上的寡糖為主,這與水解產物的粘度變化趨勢相一致,再次表明純酶Csn以內切方式作用于殼聚糖,屬于內切殼聚糖酶類。
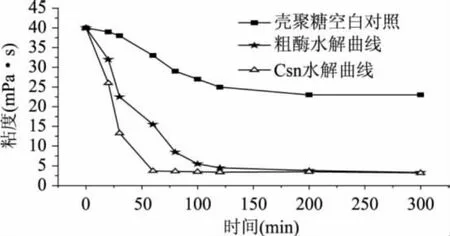
圖5 殼聚糖酶降解反應粘度曲線
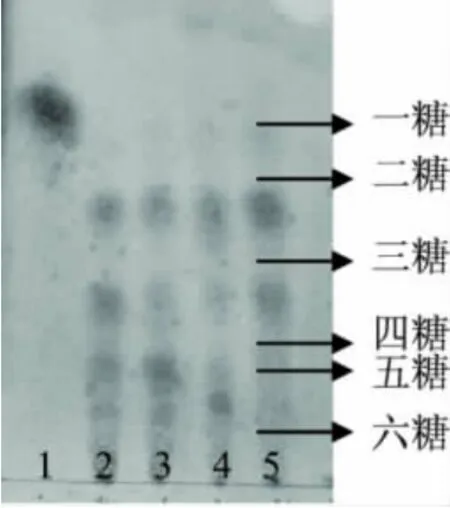
圖6 殼聚糖的Csn水解產物的薄層層析分析
3 結論
3.1 綠色木霉在纖維素類碳源誘導下所產生的內切殼聚糖酶組分與殼聚糖誘導條件下并不完全相同,SDS-PAGE顯示Csn酶為單亞基蛋白,相對分子質量為45ku。
3.2 對殼聚糖酶Csn的酶學性質研究顯示:Csn酶作用殼聚糖的最適溫度和pH分別為60℃和pH5.0,在低于50℃、pH4.8~7.5范圍內穩定性較好;金屬離子Mn2+、Mg2+、Ca2+、Zn2+對該酶有明顯的促進作用,而Fe3+、Cu2+和Hg2+則對該酶有強烈的抑制作用;該酶的米氏常數為 1.10mg/mL,最大反應速度為7.15μmol/mL·min。
3.3 底物脫乙酰度對Csn催化速率的影響大于底物的粘均分子質量,該酶對83%DD的殼聚糖的催化活力最高;以內切方式作用于殼聚糖,主要水解GlcNAc-GlcN和GlcN-GlcN之間的糖苷鍵,屬于殼聚糖酶I,水解產物以四糖以上的殼寡糖為主。
[1]Zhang JL,Xia WS,Liu P,et al.Chitosan Modification and Pharmaceutical/Biomedical Applications[J].Marine Drugs,2010 (8):1962-1987.
[2]Qin CQ,Zhou B,Zeng LT,et al.The physicochemical properties and antitumor activity of cellulase-treated chitosan[J].Food Chemistry,2004,84(1):107-115.
[3]Xie Y,Wei Y,Hu J.Depolymerization of chitosan with a crude cellulase preparation from Aspergillus niger[J].Appl Biochem Biotechnol,2010,160(4):1074-83.
[4]劉羿君,蔣英,封云芳,等.特種纖維素酶催化水解殼聚糖及殼寡糖的制備研究[J].功能高分子學報,2005,18(2):325-329.
[5]謝宇,胡立明.非專一性酶纖維素酶降解殼聚糖的研究[J].河南工業大學學報,2008,29(3):49-50.
[6]劉靖.纖維素酶降解殼聚糖的機制研究[D].無錫:江南大學食品學院,2006.
[7]趙玉萍,錢紅梅.綠色木霉產殼聚糖酶的分離純化及酶學性質[J].中國糧油學報,2009,24(4):144-147.
[8]Laemmli U K.Cleavage of structural proteins during the assembly of the head of Bacteriophage T4[J].Nature,1970,227: 680-685.
[9]Miller GL.Use of dinitrolicylic acid regent for determination of reducing sugar[J].Anal Chem,1959,31(3):426-428.
[10]Lineweaver H,Burk D.The determination of enzyme dissociation constants[J].J Am Chem Soc,1934,56:658-666.
[11]夏其昌.蛋白質化學研究技術與進展[M].北京:科學出版社,1999.
[12]Kim P,Tae KH,Chung KJ,et al.Purification f a constitutive chitosanase produced by Bacillus sp.MET 1299 with loning and expression of the gene[J].FEMS Microbiol Lett,2004,240: 31-39.
[13]Xia WS,Liu P,Liu J.Advance in chitosan hydrolysis by nonspecific cellulases[J].Bioresource Technology,2008,99 (15):6751-6762.
[14]劉萍.綠色木霉產雙功能酶的結構與功能研究[D].無錫:江南大學食品學院,2009.
[15]劉北東.綠色木霉纖維素酶系基因克隆表達及特性研究[D].哈爾濱:哈爾濱工業大學生命科學與工程系,2004.
Purification and properties of endo-chitosanase secreted by Trichoderma viride
LIU Ping1,LIU Jing1,QI Xing-pu1,XIA Wen-shui2
(1.Jiangsu Engineering Research Center for Livestock Product Processing Technology,Jiangsu Animal Husbandry&Veterinary College,Taizhou 225300,China;2.Jiangnan University,School of Food Science and Technology,State Key Lab of Food Science and Technology,Wuxi 214122,China)
In our previous study,a novel chitosanase Csn was purified from the fermented solution of Trichoderma viride WX01 with the induction of microcrystalline cellulose.The characteristics of the Csn toward chitosan were studied in detail.SDS-PAGE analysis showed that the enzyme Csn was a mono subunit and the molecular weight was estimated as 45ku.Csn was stable below 50℃and within the pH range from 4.8~7.5.The optimal temperature for the enzyme was 60℃ and optimal pH was 5.0.Mn2+,Mg2+,Ca2+,Zn2+enhanced the enzyme activity,whereas Fe3+,Cu2+and Hg2+inhibited the enzyme activity significantly.Kinetic parameter Km was 1.10mg/mL,Vmaxwas 7.15μmol/mL·min.Substrate specificity study showed that the effect of deacetylation of chitosan on the activity was evident.Csn exhibited the highest activity toward 83%DD chitosan.The hydrolysates of Csn toward 83%DD chitosan were analysis by TLC and viscosity changing.The results indicated that Csn could split GlcNAc-GlcN as well as GlcN-GlcN,with the main product of hydrolysis showing the degrees of polymerization more than four.
Trichoderma viride;chitosanase;enzymatic properties;action mode
TS201.2
A
1002-0306(2011)12-0254-05
2011-08-31
劉萍(1982-),女,博士,講師,研究方向:食品生物技術。
國家自然科學基金(20876068);江蘇省自然科學基金項目(BK2009734);院級課題(YB201003)。

