赤潮毒素大田軟海綿酸表面等離子共振免疫檢測方法研究*
周向東,陳惠濱,詹舒越,王曉萍* ,歐惠超,羅昭鋒
(1.浙江大學現代光學儀器國家重點實驗室,杭州 310027;2.集美大學信息工程學院,福建 廈門 361021;3.中國科技大學合肥微尺度國家實驗室,合肥 230027)
由于環境污染導致的海水富營養化以及赤潮,會破壞海洋的正常生態結構。赤潮導致海洋生物死亡產生毒素,并污染海洋中養殖的蝦、貝類等,通過食物鏈的傳遞,造成人類食物中毒[1]。
目前海洋赤潮毒素的檢測方法主要有生物分析法、化學儀器分析法和免疫檢測法。以小鼠實驗為典型的生物分析法[2],雖然簡單易行,但因生物個體差異,導致測量結果偏差大,且靈敏度非常低,特異性差。高效液相色譜法[3-4]可以準確分離各種組分,實現海洋藻毒素定性和定量分析,但是大多數毒素如PSP(Paralytic Shellfish Poisoning,)、DSP(Diarrhetic Shellfish Poisoning,腹瀉性貝類毒素)等必須經熒光衍生后才能檢測,衍生后的熒光產物均很不穩定,容易造成測量偏差。因此國內外逐步將色譜質譜聯用技術[5]應用于多種海洋生物毒素的分析,但色譜分析法因為儀器昂貴,需要專業操作人員等原因限制了方法的普及和應用。利用多克隆或單克隆抗體檢測的酶聯免疫分析法[6-8]具有高特異性和選擇性,分析過程無需繁瑣的樣品前處理步驟,具有商品化的試劑盒為該方法的進一步廣泛應用提供了可能性。但其檢測過程需要酶標記抗體及依賴于酶催化反應的比色檢測,導致成本增加,耗時長達數小時,且檢測過程仍需依賴實驗室環境,難以適應現場分析檢測的實時性要求。
本文以在我國渤海、長江口、福建沿海、珠江口、香港和臺灣等海域廣泛分布[9]的腹瀉性貝類毒素中的大田軟海綿酸(Okadaic Acid,OA)為分析檢測對象,將免疫分析方法與表面等離子共振檢測技術相結合,建立一種免標記、響應速度快、靈敏度高、低成本的可以應用于海洋赤潮毒素分析的快速SPR免疫檢測分析方法。提出并設計了一種小型化、可適用于現場應用的SPR免疫檢測分析系統,制備了可識別OA的特異性免疫傳感芯片,通過實驗分析并評價了該檢測系統的性能指標。
1 檢測原理與實驗裝置
表面等離子共振是光在玻璃與金屬薄膜界面發生全反射時產生的倏逝波引發金屬表面的自由電子產生表面等離子(Surface Plasmon,SP),并在表面等離子與倏逝波頻率和波數相同的情況下產生的一種共振現象,由此導致反射光的能量急劇下降,反射光譜上出現共振峰。當傳感芯片表面固定一層生物分子識別膜,將待測樣品流過芯片表面,若樣品中有能夠與芯片表面的生物分子相互作用的分子,會引起金膜表面折射率變化,最終導致SPR共振峰變化,從而可獲得被分析物的濃度、親和力、動力學常數和特異性等信息[10]。
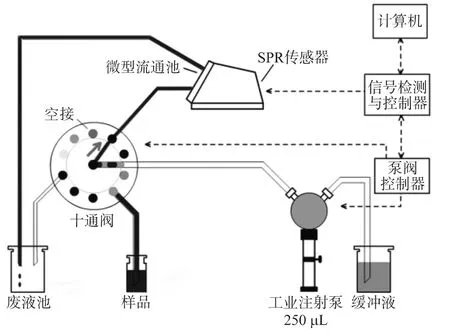
自行研制開發的表面等離子共振免疫檢測分析系統結構如圖1所示。傳感器選用Kretschmann結構的TSPR1A170100 SpreetaTM傳感器,其折射率分辨率為5×10-6RIU,具有體積小、功耗低、性價比高等特點;十通閥(美國Valco Inc.)用于切換選擇緩沖液、待檢樣品和再生液等;工業注射泵(Sapphire EngineeringTMInc.)依據程序將各種溶液注射流經表面功能化的SPR傳感器表面,傳感器輸出的SPR光譜經信號檢測與控制電路采集后,傳送到計算機進行分析處理。在軟件的控制下,系統可實現自動進樣、測量、再生、清洗等功能。
2 材料與方法
2.1 材料
NHS(N-hydroxysuccinimide,N-羥基琥珀酰亞胺);EDC(1-ethyl-3-(3-dimethylaminopropyl)carbodiimide hydrochloride,水溶性碳化二亞胺);TeCP(tetrachlophenoxide,四氯苯酚);鹽酸乙醇胺(1 mol/L ethanolamine hydrochloride,pH=8.5,Alfa Aesar Inc.):純度>98%;SDS(sodium dodecyl sulfate,十二烷基硫酸鈉)溶液:質量分數為10%;OA-mAb(OA單克隆抗體,清華大學生命科學學院);OA標準品(Sigma Inc.):純度>95%;OA-BSA(OA牛血清蛋白偶聯物溶液,Sigma Inc.);PBS(phosphate buffered saline,磷酸鹽緩沖液):將8.0 g NaCl、2.9 g Na2HPO4、0.2 g KH2PO4、0.2 g KCl溶于800 mL蒸餾水中,調整溶液pH值至7.4,補充液體使溶液體積為1 L,分裝、高壓蒸汽滅菌后室溫保存;再生液:100 mmol/L的NaOH溶液與質量分數為0.05%的SDS溶液混合。
2.2 測試方法及生物芯片制備
由于OA是小分子,為提高檢測靈敏度通常采用間接檢測法即抑制法進行測量。其過程為:將OA抗原偶聯在SPR傳感器芯片(金膜)表面;將適量的OA-mAb與含有OA分子的被測溶液混合,抗原抗體結合達到平衡態,此時混合液有一定量多余的OA-mAb;將該混合液作為SPR儀器的被測樣品注入并流經傳感器金膜表面,此時混合液中多余的OA-mAb與修飾在傳感器金膜表面的OA抗原結合,SPR輸出信號發生變化,根據SPR輸出信號的大小,可以得到混合液中多余OA-mAb的量,從而可以計算出被測溶液中的OA分子濃度。
為使SPR傳感器對特定待測分子具有特異性,需要對傳感器芯片(金膜)表面進行修飾。對于OA傳感芯片的制備,是利用OA-BSA偶聯物的巰基與傳感器金膜表面共價偶聯,形成一層自組裝的單分子檢測層。具體的步驟如下:
①用H2SO4∶H2O2(98%濃硫酸∶30%雙氧水=7∶3)清洗傳感器金膜表面12 h。
②取OA-BSA溶液20 μL滴于芯片表面反應8 h,使OA-BSA通過巰基固定于芯片表面。
③回收芯片表面的OA-BSA溶液,沖洗芯片表面,氮氣吹干,2 mg/mL BSA+1%TeCP 溶液 20 μL滴于芯片表面,反應5 h。在TeCP作用下,BSA的蛋白二硫鍵被打開,封閉未吸附OA-BSA的金膜表面,以減少結合過程的非特異性吸附。
④沖洗芯片表面,氮氣吹干。NHS/EDC混合溶液20 μL滴于芯片表面反應5 h,交聯活化芯片,使得芯片表面的獨立蛋白BSA之間的羧基與氨基交聯在一起,提高結合的穩定性。
⑤沖洗芯片表面,氮氣吹干。鹽酸乙醇胺20 μL滴于芯片表面反應12 h,封閉芯片表面多余的羧基,減少羧基對抗體蛋白的非特異性吸附。
2.3 測試過程
2.3.1 測試條件優化
分別以100 mmol/L NaOH與100 mmol/L NaOH+0.05%SDS混合溶液為再生液,以稀釋200倍的OA-mAb溶液作為檢測樣品,25 μL/min速度進樣,進樣量50 μL,考察芯片再生后,基線的恢復能力。
將OA 單克隆抗體用 PBS 按 1 ∶100、1 ∶200、1∶300比例稀釋后,分別作為檢測樣品,以25 μL/min速度進樣,進樣量50 μL,測試三種不同稀釋比抗體溶液的SPR響應值,選擇合理的稀釋倍數。
2.3.2 檢測方法性能測試
以 1 ∶200 OA-mAb 溶液為測試樣品,25 μL/min速度進樣,每次進樣50 μL并再生,連續進樣12次,測試芯片穩定性。
用PBS緩沖液、OA標準品和1∶200 OA-mAb溶液,配制出 OA 含量分別為 2.5、5、10、20、40、80、160、320、640、1280 ng/mL OA 的混合溶液,由高濃度到低濃度依次檢測,每個濃度重復3次,獲取OA標準曲線。
3 結果與討論
3.1 測試條件選定
抗體稀釋200倍,兩種不同再生液條件下的SPR譜圖如圖 2、圖 3所示,分別以 100 mmol/L NaOH、100 mmol/L NaOH+0.05%SDS 混合溶液為再生液,SPR結合前與恢復后的基線并不對齊,存在大約48RU、77RU的結合量差值,表明所選擇的再生液并不能使傳感器表面的抗原和抗體結合物完全分離。而由100 mmol/L NaOH+0.05%SDS混合溶液、100 mmol/L NaOH兩種再生溶液先后再生兩次可以使基線回復到起始水平,如圖1所示,因此設定再生條件先由100 mmol/L NaOH+0.05%SDS混合溶液再生,后由100 mmol/L NaOH再次再生一次。

圖2 抗體稀釋200倍,再生液為NaOH的SPR譜圖
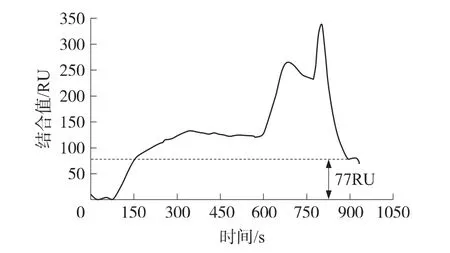
圖3 抗體稀釋200倍,再生液為NaOH+SDS的SPR譜圖
OA-mAb稀釋100、200、300倍的SPR譜圖如圖4所示,由圖可見,在相同的進樣速度和進樣量條件下,抗體稀釋100倍的溶液結合量最大,達135RU;而抗體稀釋300倍的溶液結合量最小,僅為80RU。雖然抗體稀釋100倍溶液結合值較大,但抑制濃度隨之增大,最終導致檢測限變大,且抗體消耗量也大,會增加分析成本;而抗體稀釋300倍的溶液結合值低,競爭抑制曲線動態響應范圍小,會導致定量濃度范圍變窄。因此選擇抗體稀釋200倍較為恰當,其響應值為123RU,能在檢測限、樣品消耗量及信號動態響應范圍之間取得一個合理的平衡。
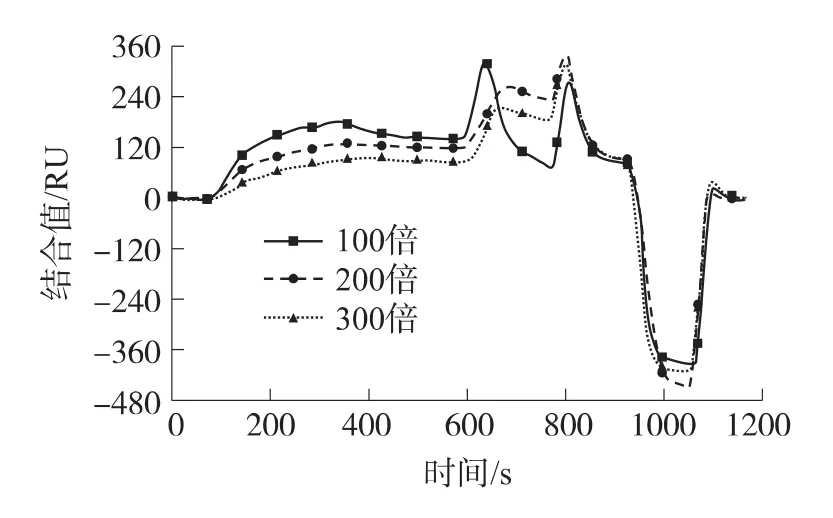
圖4 單次完整的測量過程,
3.2 穩定性
分析重復性實驗的12次測量結果,求得12次響應信號的均值約為123.6RU,標準偏差為2.34RU,RSD值為1.51%,響應信號的最大偏差在8RU之內。結果表明傳感器芯片表面偶聯的抗原結合牢固,抗體稀釋倍數和再生條件選擇合理。在該條件下,測試方法具有良好的重復性。
3.3 抑制標準曲線
分析不同濃度OA溶液的SPR測量結果,以SPR傳感器的響應結合值為縱坐標,OA濃度值的對數為橫坐標,得到OA標準曲線如圖5所示。結合值最低和最高濃度端分別由于飽和結合及抑制溶液中抗體濃度低而趨向于平穩,中間部分呈線性遞減的過程,很好的符合抑制模式的抗原抗體生物測量過程。用Sigmoidal非線性關系擬合,得方程Y=A2+(A1-A2)/(1+(x/x0)p),A1=113.0,A2=33.3,x0=182.7,p=2.4,擬合曲線的相關系數R2=0.993。
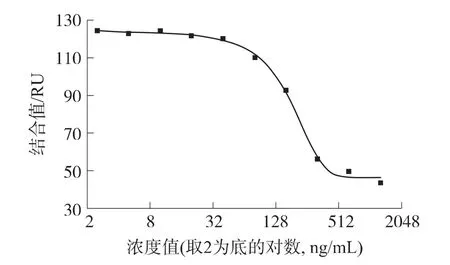
圖5 OA的標準曲線
FDA的《標準分析方法與步驟依據指南》[11]中定義的檢測限為DL=3.3σ/S,其中σ為重復性測量的標準偏差,S為標準曲線的斜率。由標準曲線測量點可得S=0.398RU·mL/ng,σ=2.34RU,進而可以計算出該方法的檢測限為19.4 ng/mL,半抑制濃度 IC50(Half-maximal Inhibitory Concentration)為177 ng/mL。由標準曲線及檢測限可確定其定量范圍為40 ng/mL~640 ng/mL。
由圖4可知,一次完整的SPR檢測過程包括結合、解離、再生及恢復四個過程,耗時約為15 min左右。在實際應用過程種,根據單次測量的響應值,由標準曲線可得到相應的OA濃度值。相比化學儀器分析法及酶聯免疫法,其快速定量過程是一大優勢,可滿足現場實時檢測的需求。
4 結論與展望
本文結合表面等離子共振技術與免疫檢測技術,以大田軟海綿酸為例,以點帶面,研究和建立了一種新型赤潮毒素的檢測方法。并基于所設計的表面等離子免疫檢測分析系統,分析評價了該方法的主要性能指標。研究表明,所建立的檢測方法,可以滿足國際上對于海水赤潮災害毒素警戒標準的檢測要求。所采用免疫檢測技術具有特異性,可直接分析海水中OA,省去了大量繁瑣的樣品前處理過程,縮短了樣品分析時間(單次樣品的分析時間僅為15 min);所設計的傳感器經再生后可重復使用上百次,且無需任何標記即可實現OA實時檢測,從而大大節省分析測試的成本。實驗結果表明,該系統實現OA檢測的檢測限未能明顯優于其他的檢測方法。但通過樣品富集[12]或抗體信號增強[13]等方法可以大大改善系統的檢測限,且所研究建立的新方法很好地克服了傳統分析方法操作繁瑣,檢測時間長,成本高或需要標記等不足。因此,本文建立的新方法為海水水質的在線分析檢測提供了新的選擇方案。
[1]曾呈奎,相建海.赤潮藻及其毒素生物監測新技術[M].濟南:山東科學技術出版社,1998.416-427.
[2]Horvitz W,Latimer G W.Official Methods of Analysis of AOAC International[R].Gaithersburg:AOAC Gaithersburg,2005.
[3]Diener M,Erler K,Hiller S,et al.Determination of Paralytic Shellfish Poisoning(PSP)Toxins in Dietary Supplements by Application of A New HPLC/FD Method[J].European Food Research and Technology,2006,224(2):147-151.
[4]黃愛君,黃海燕,劉建軍.麻痹性和腹瀉性貝類毒素的檢測方法研究進展[J].環境與健康雜志,2010,1:84-86.
[5]陳靜,周倩如,郭小琳,等.固相萃取—高效液相色譜串聯離子阱質譜法測定水中微囊藻毒素[J].中國衛生檢驗雜志,2009,8:1720-1724.
[6]Chu F S,Hsu K H,Huang X,et al.Screening of Paralytic Shellfish Posioning Toxins in Naturally Occurring Samples with Three Different Direct Competitive Enzyme-Linked Immunosorbent Assays[J].Journal of Agricultural and Food Chemistry,1996,44(12):4043-4047.
[7]劉仁沿,梁玉波,張芳,等.中國沿海貝類腹瀉性貝毒的酶聯免疫分析方法[J].大連海事大學學報:自然科學版,2008,34(002):33-36.
[8]趙前程,來鵬,秦成,等.ELISA與小白鼠生物法檢測腹瀉性貝類毒素的研究[J].食品科技,2009,011:287-292.
[9]趙曉芳,計融.國內外腹瀉性貝類毒素管理控制措施的比對分析[J].中國熱帶醫學,2006,6(2):350-354.
[10]謝永紅,王耀玲,程小麗,等.SPR生物傳感器在急性白血病髓系抗原CD33檢測中的應用[J].傳感技術學報,2011,24(1):1-4.
[11]Center for Drug Evaluation and Research,Center for Biologicals E-valuation and Research,Food and Drug Administration.Guidance for Industry:Analytical Procedures and Methods Validation—Chemistry,Manufacturing,and Controls Documentation Draft Guidance[S].Rockville:Department of Health and Human Services,2000.9-11.
[12]Liu X,Sun Y,Song D,et al.Sensitivity-Enhancement of Wavelength-Modulation Surface Plasmon Resonance Biosensor for Human Complement Factor 4[J].Analytical biochemistry,2004,333(1):99-104.
[13]Xu LG,Peng C,Xu CL,et al.Development of the ELISA for Detection of Microcystin by Using Magnetic Nanometer Particle Enrichment Antibody[J].Toxicology Letters,2008,180:S120-S120.

