含黃綠熒光蛋白基因的穿梭質粒表達載體的構建*
于德水, 高 娃**, 沙長青, 張淑梅, 高繼國
(1.東北農業大學生命學院,黑龍江哈爾濱150030;2.黑龍江省科學院高技術研究院,黑龍江哈爾濱150090;3.黑龍江省科學院微生物研究所,黑龍江哈爾濱150010)
隨著分子生物學技術的發展,分子標記技術日益成熟并用于根圍生態學研究。現有的報告基因主要有:β- 半乳糖苷酶(Lacz)、β- 葡糖苷酸酶(GUS)、分泌型胎盤磷酸酯酶(SEAP)、螢火蟲熒光素酶(LUC)等,但這些基因的檢測都需要底物和輔助因子,因而在活體中的應用受到限制。綠色熒光蛋白(green fluorescent protein,GFP)是近年新興的一種報告分子,該蛋白能夠自身催化形成發色結構并在紫外線或藍光激發下發出綠色熒光。作為報告基因,GFP是目前能在活細胞中表達的發光蛋白之一。作為熒光標記分子,GFP具有熒光強度高、不需要底物(或輔助因子)、無種屬特異性、相對分子量小、易與其他蛋白融合、對細胞無傷害、易于檢測、可在活細胞實時觀察等特點,而優于傳統的報告分子。GFP分子量相對較小,僅有27KD左右,它能與多種不同的蛋白質N端或C端融合而保持其天然蛋白的特性,是一種直觀性很強的遺傳標記物[1~3]。EYFP是GFP的突變體,是加強型GFP,具有檢測方便、熒光穩定、易于構建載體且對活細胞無毒害,對目的基因的功能也沒有影響,轉化后細胞可以繼續傳代等特點。目前成為重要的報告因子在動物、植物和微生物學中廣泛應用[4,5]。
本文采用基因重組技術將黃綠熒光蛋白基因重組到穿梭質粒表達載體上,構建了含黃綠熒光蛋白基因的大腸桿菌-枯草芽孢桿菌穿梭質粒表達載體,為生防枯草芽孢桿菌基因標記以及菌株定殖的研究提供必備的實驗材料。
1 材料與方法
1.1 材料
1.1.1 菌株與質粒
本研究所用菌株與質粒見表1。

表1 菌株與質粒Table1 Strains and plasmid
1.1.2 培養基與培養條件
大腸桿菌用LB培養基(蛋白胨10g,氯化鈉10g,酵母抽提物 5g,水 1000mL,pH7.0,121℃滅菌20min。),37℃培養震蕩培養18h。
1.1.3 試劑
限制性內切酶,T4DNA連接酶,DNA回收試劑盒,化學試劑:自大連寶生物工程公司。
1.1.4 抗生素與溶液
氨芐青霉素(Amp),工作濃度 50μg/mL;氯霉素(Cm),工作濃度 10μg/mL。
溶液Ⅰ:50mmol/L葡萄糖,25mmol/LTris.HCl(pH8.0),10mmol/LEDTA(pH8.0);
溶液Ⅱ:0.2mmol/LNaOH,1%SDS;
溶液Ⅲ:5mmol/L乙酸鉀60mL,冰乙酸11.5mL,雙蒸水28.5mL;
TE:10mmol/L Tris.HCl (pH8.0),1mmol/L EDTA(pH8.0);
RNase溶液:10mg RNase溶于1mL 10mmol/LTris.HCl(pH7.5),15mmol/L NaCl中,于100℃加熱15min,冷卻后保存于-20℃。
1.1.5 儀器
臺式高速離心機LG15-W,北京醫用離心機廠;電熱恒溫水浴鍋HWS24,上海一恒科技有限公司;電熱恒溫培養箱WMK-02,南京電器廠;紫外分光光度計LINDA,日本島津公司;電子分析天平AEL-160,日本島津公司;凝膠成像系統UVP,英國Cambridge紫外儀器有限公司。
1.2 方法
1.2.1 質粒提取
采用堿裂解法[6]從大腸桿菌中提取pEYFP和pHPS9質粒DNA。
活化含pEYFP和pHPS9質粒DNA的大腸桿菌,用-70℃保存的菌液劃線接種于LB加相應抗生素固體平板上,37℃過夜培養;取單菌落轉接于5mL LB+Cm(pHPS9)和 5mL LB+Amp(pEYFP)液體培養基中,37℃過夜培養;按1%接種量再分別轉接于50mL LB加相應抗生素的液體培養基中,37℃過夜培養。次日取50mL菌液,在4℃,4000r/min轉數下,離心10min,棄去上清液,用2mL含10mg Lysozyme的溶液Ⅰ溶解菌體,室溫放置5min,加入4mL溶液Ⅱ,溫和倒置數次使其混合均勻,置于冰上10min,再加入3mL溶液Ⅲ,快速倒置數次于冰上10min,以13000r/min轉數離心30min,向上清液中加入0.6倍體積異丙醇,室溫放置15min,在12000r/min轉速數下離心30min,加入0.5mLTE溶解沉淀,再加入RNA酶10μL,放入37℃水浴中反應1h,加入等體積酚、酚-氯仿、氯仿抽提,用100%乙醇沉淀質粒DNA,用70%冰冷的乙醇洗1次,沉淀干燥后,溶于50μL TE中,置于-20℃冰柜中備用。
1.2.2 雙酶切反應[7]
先用BamHI酶切 pEYFP和pHPS9質粒DNA,10μL反應體積中含1~2μg pEYFP或pHPS9質粒DNA,1μL 10×Bbuffer,1~2UBamHI,加入 ddH2O 補足體積。將反應管放于30℃水浴中2h后,置于70℃水浴10min,終止酶反應。再用EcoRI酶切,在上述反應液中加入 1~2U EcoRI,1μL 10×H buffer,加入ddH2O補足體積至20μL,將反應管放于37℃水浴中2h后,置于70℃水浴10min,終止酶反應。用酚-氯仿抽提酶切后的pHPS9質粒DNA,乙醇沉淀,用ddH2O溶解沉淀。酶切后的pEYFP進行1%瓊脂糖電泳,回收約714bp的EYFPDNA片段。DNA片段回收采用試劑盒。
1.2.3 連接反應
10 μL反應體積中含有1μL 10倍連接緩沖液,2UT4DNA連接酶,適當濃度比的EYFPDNA片段與pHPS9質粒DNA,置于22℃水浴中連接4~6h,終止連接反應。
1.2.4 感受態細胞制作與轉化
從平板上挑取E.coli.DH5α單菌落接種于5mLLB培養液中,37℃過夜培養,次日按1%接種量轉接于50mLLB培養液中,在37℃水浴搖床中快速震蕩培養至OD550=0.5。將培養液置于冰浴中10min之后,在4℃,5000r/min轉速下離心5min,收集菌體,將菌體重新懸浮于25mL冰冷的50mmol/L CaCl2,10mmol/L Tris.HCl溶液中,冰浴中至少放置20min,在4℃,5000r/min轉速下離心5min,將菌體再懸浮于2mL冰冷的50mmol/LCaCl2,10%甘油中,分成100μL體積一份,于4℃放置過夜后,立即放入-70℃冰箱中保存備用。
取100μL冷凍的感受態細胞放入冰浴中融化,加入 20μL 50mmol/LCaCl2,10mmol/L Tris.HCl溶液,再加入40~50ngDNA,混勻后,于冰浴中放置30min,立即放入42℃水浴中熱刺激2min,取出后加入100 μLLB培養液于37℃水浴中放置1h。取100μL培養液涂布于加有IPTG和X-Gal的LB平板上,然后將LB平板放置于37℃溫箱中過夜培養。
1.2.5 陽性重組子篩選與鑒定
隨機挑選單菌落,用煮沸法快提質粒DNA,先用1%瓊脂糖凝膠電泳初篩DNA分子量大于質粒載體(pHPS9)的重組子DNA,再用EcoRⅠ/BamHⅠ雙酶切方法進一步驗證重組子。
2 結果與討論
2.1 質粒DNA濃度與純度
用LB培養液過夜培養,取50mL菌液離心收集菌體,按方法所述提取質粒DNA,用紫外吸收法測定DNA純度,瓊脂糖電泳法測定DNA分子量大小。50mL菌液可以獲得30μg pEYFPDNA和26μg pHPS9 DNA,經測定,其 OD260∶OD280=1.76,瓊脂糖凝膠電泳表明DNA分子量與理論值相符。結果見圖2。
2.2 表達載體的構建
按照圖1構建表達載體。將EYFP基因連接到穿梭質粒表達載體pHPS9多克隆位點區。
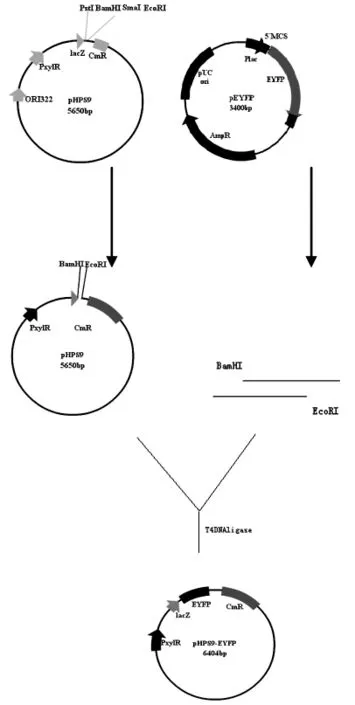
圖1 表達載體的構建圖Fig.1 Construction figure of expressing carrier
2.3 陽性重組子篩選與鑒定
10 μL連接液轉化100μL感受態細胞,涂2個LB+Cm平板,37℃培養18h。每個平板上均有200多個轉化子,隨機挑取10個轉化子,提取質粒DNA,并用EcoRⅠ/BamHⅠ雙酶切下與EYFP基因大小一致的DNA片段,證明該轉化子為陽性重組子。結果見圖2、3、4。
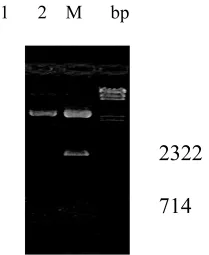
圖2 質粒pEYFP DNA電泳圖Fig.2 Electrophoresis map of plasmid pEYFPDNA EcoRⅠ/BamHⅠ雙酶切電泳圖
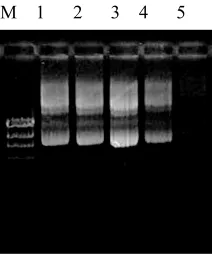
圖3 質粒pHPS9-EYFP DNA電泳圖Fig.3 Electrophoresis map of plasmid pHPS9-EYFPDNA
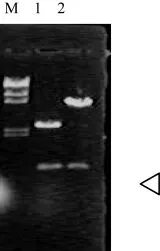
圖4 陽性重組子雙酶切結果Fig.4 Result of dual enzyme cut of positive recombinator M:λDNA/HindⅢMarker
3 結 論
利用DNA重組技術,成功地將黃綠熒光蛋白基因(EYFP)重組到大腸桿菌-枯草芽孢桿菌穿梭質粒表達載體pHPS9上,獲得了含EYFP基因的大腸桿菌-枯草芽孢桿菌穿梭質粒表達載體pHPS9-EYFP,從而為生防菌株的基因標記提供了必要的材料。
[1]姚震聲,陳中義,陳志誼.綠色熒光蛋白基因標記野生型生防枯草芽孢桿菌的研究[J].生物工程學報,2003,19(5):551~555.
[2]殷幼平,袁訓娥,李強.生防菌枯草芽孢桿菌CQBS03的綠色熒光蛋白基因標記及其在柑橘葉片上的定殖[J].中國農業科學,2010,43(17):3555~3563.
[3]車建美,劉波,張彥.青枯病生防菌蠟狀芽孢桿菌(ANTI-8098A)的綠色熒光蛋白基因(gfp)轉導及其生物學特性的變化[J].農業生物技術學報,2010,18(2):337~345.
[4]王金林,閔軍,周曉東.加強型黃綠色熒光蛋白和VEGF雙基因載體在肝細胞共轉染表達[J].中山醫科大學學報,2002,23(4):254~256.
[5]張淑梅,王玉霞,李晶.基因標記枯草芽孢桿菌BS-68A在黃瓜上定殖[J].生物技術,2006,16(4):73~74.
[6]都艷霞,沙偉,張梅娟.堿裂解法提取重組質粒DNA及PCR驗證[J].生物技術,2009,19(2)35~37.
[7]柴燕文,馬暉玲,謝小冬.pBI121-Lyz-GFP表達載體的構建及其在和田苜蓿愈傷組織中的轉化[J].農業生物技術學報,2008,16(5):842~846.

