一株光合細菌的鑒定及其處理大豆加工廢水試驗
盧海鳳,張光明,何春華
(哈爾濱工業大學市政環境工程學院,150090哈爾濱,zgm200@126.com)
自20世紀60年代日本科學家M.Kobayashi等發現光合細菌(PSB)具有能夠凈化水質的作用以來,光合細菌就一直受到關注[1].光合細菌是一大類在厭氧條件下進行不放氧的光合作用細菌的總稱,其分布廣泛,種類繁多.文獻[2-3]將其劃分為綠硫細菌、紅硫細菌、紅螺菌3科.其中紅螺菌能在厭氧光照的條件下以低級脂肪酸、多種二羧酸、醇類、糖類、芳香族化合物等低分子有機物及二氧化碳等作為光合作用的電子供體進行光能異養生長,而且能在微氧黑暗條件下,以上述有機物為呼吸基質,進行好氧異養生長.另外,光合細菌還具有繁殖速度快(優于厭氧法)、能耗低(優于好氧法)和無需污泥處置[3]等優點在污水治理領域逐步得到推廣應用[4-10].光合細菌菌體無毒、含有多種營養物質,如蛋白質、多種B族維生素、泛酸、輔酶Q等生理活性物質以及菌綠素、類胡蘿卜素等天然色素,具有很強的回收價值[11-16].基于光合細菌在水處理和資源回收等方面的優勢,對從土壤中富集分離出的一株新型光合細菌進行了生理生化以及菌種鑒定,并初步探討了其對大豆加工廢水的處理效果,發現在自然光微氧條件下,該菌株對大豆加工廢水的COD具有較好的降解作用,比傳統的光照厭氧及黑暗好氧條件下利用PSB處理高濃度有機廢水在工程上的應用更具有現實意義.
1 實驗
1.1 實驗設備
主要實驗設備見表1.
表1 主要實驗設備
1.2 實驗方法
1.2.1 菌種形態及生理生化性質鑒定實驗
1)菌種單、復染色試驗:參考文獻[17];
2)原子力顯微鏡掃描:將原始菌液1 000 r/min離心10 min,取上清液3 000 r/min離心10 min,棄上清沉淀部分加入pH為7.2的磷酸鹽緩沖液2 mL,洗滌離心10 min,如上洗滌3~5次即可.將洗滌好的菌體加入磷酸鹽緩沖液少許并稀釋到合適的質量濃度進行原子力顯微拍照;
3)菌種的碳源利用試驗:參考文獻[17];
4)菌種吸收峰點試驗:將菌液用無菌水稀釋至OD660=1.000左右,將該菌液在紫外分光光度計上100~1 000 nm波長內進行掃描,記錄峰點;
5)Sherlock MIS鑒定試驗:詳見sherlock MIS系統操作說明書;
6)光密度OD660:國標法,詳見文獻[18].
1.2.2 處理大豆加工廢水條件及效果實驗
1)廢水:采用人工配水方式,用豆漿配制初始COD 為8 000~12 000 mg·L-1的污水;處理溫度為26~28℃;
2)投菌量:采用稱重法設置投菌量(干質量)為8、40、160、400、960、1 920 mg·L-1的 6 個處理;
3)光照及氧氣條件:光照厭氧(光強為1 000 lx)、自然光微氧(保持溶解氧 DO<0.5 mg·L-1)以及黑暗好氧(保持DO介于2.0~4.0 mg·L-1)3個處理,投菌量為120 mg/L;
4)COD:國標法,詳見文獻[18];
5.統一規范,把好項目資料關。規范基礎工作是審計項目順利開展的前提和保障,審計組長在強化審計項目質量的同時,要擯棄“重成果、輕基礎”的錯誤導向,按照“規范、全面、標準”的要求,實行審計基礎工作標準化管理,保證審計資料歸檔的及時性、準確性、完整性,促進審計質量和工作效率的提高。
5)生物量采用烘干法,即MLSS測定方法,詳見文獻[18].
2 結果與討論
2.1 菌種及生理生化性質鑒定
2.1.1 光合細菌Z08單染色試驗及原子力掃描鏡試驗
由圖1,2可知,該菌的細菌菌體為球狀,單個細菌的直徑約為0.3~1.0 μm.光合細菌Z08復染色過程中的顏色變化為:紫色→紅色→無色→紫色,故Z08為G-.
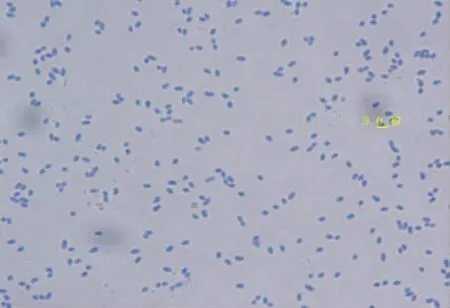
圖1 100倍光學顯微鏡下Z08菌體圖像
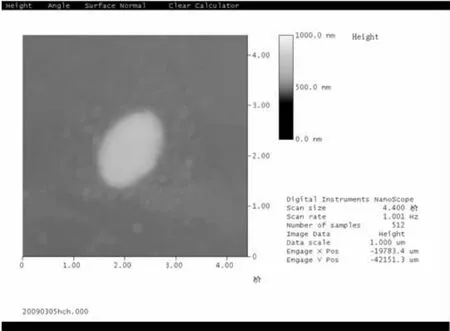
圖2 光合細菌Z08的原子力鏡掃描照片
2.1.2 光合細菌Z08的碳源利用試驗
由表2可知,該菌能夠在以乙醇、果糖、葡萄糖、甘油、甘露糖、甘露醇、山梨醇等小分子有機物為碳源的培養基中生長,說明該菌能夠利用此類有機物進行新陳代謝;而不能利用丙酸鈉、硫代硫酸鈉、甲基纖維素、油酸鈉及蛋白質作為碳源進行代謝.
2.1.3 光合細菌Z08的菌液特征吸收峰點試驗
2.1.4 光合細菌菌種鑒定
經微生物鑒定自動化系統Sherlock MicrobialIdentification System(MIS)鑒定,該菌種為球形紅單假單胞菌:Rhodobacter-sphaeroides(Rhodopseudomonas sphaeroides),MIS圖譜見圖3,對照的標準圖譜來源于美國MIDI公司,相似度為0.838(相似度>0.7鑒定可靠).

表2 Z08的碳源利用情況
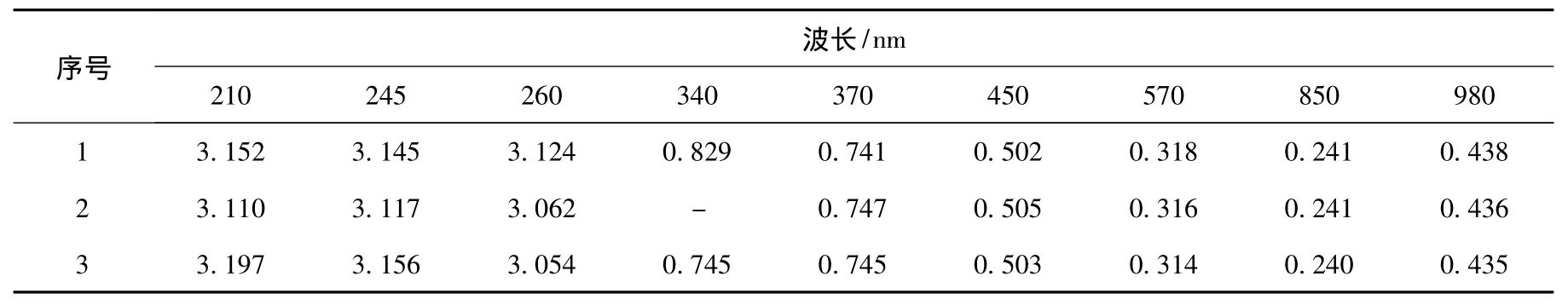
表3 菌液特征吸收峰點
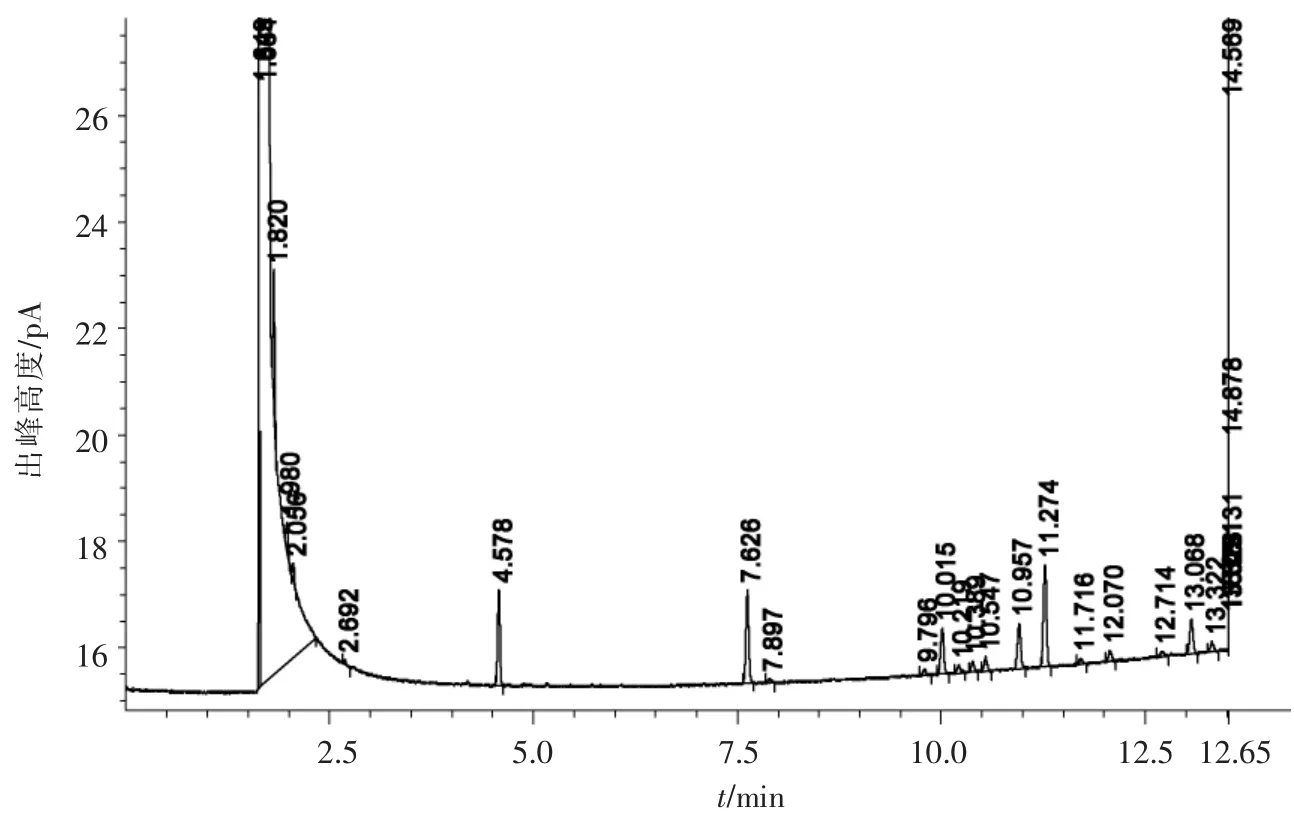
圖3 GH-1脂肪酸-IC法鑒定圖譜
圖4為該菌株16srDNA序列鑒定結果,根據測序結果分析:該菌株16S rDNA序列與Rhodobacter sphaeroides KD131 (CP001151)、Rhodobacter sphaeroides ATCC 17029(CP00578)、Rhodobacter sphaeroides IFO 12203(D16425)等相似性為100%.可以確定其分類地位屬于Rhodobacter sphaeroides.
2.2 處理大豆加工廢水條件優化及效果
2.2.1 投菌量
如圖5所示,各處理組的COD去除率隨處理時間的增加逐漸升高,前72 h增加最快,72 h后數值變化趨于平緩,逐漸達極限值.投菌量為160與400 mg·L-1的處理組在第72小時時,COD的降解率分別達86.8%與81.9%,在96 h時,上述數值分別達93.7%與90.5%;菌種添加量為960與1 920 mg·L-1的處理組中,前96 h時的COD去除率均小于菌種投加量為160與400 mg·L-1的組合,而在第96小時以后,其去除率數值與160和400 mg·L-1的處理組相差不大;菌種添加量為8、40與80 mg·L-1的處理組COD去除率在每個時間點上均小于其他菌種添加量≥160 mg·L-1的4個處理組.綜合考慮每個處理組的COD降解效果、菌種添加量的經濟性與處理時間的長短可以得出,利用Z08處理大豆加工廢水最佳的投菌量為160~400 mg·L-1,處理時間為72 h.
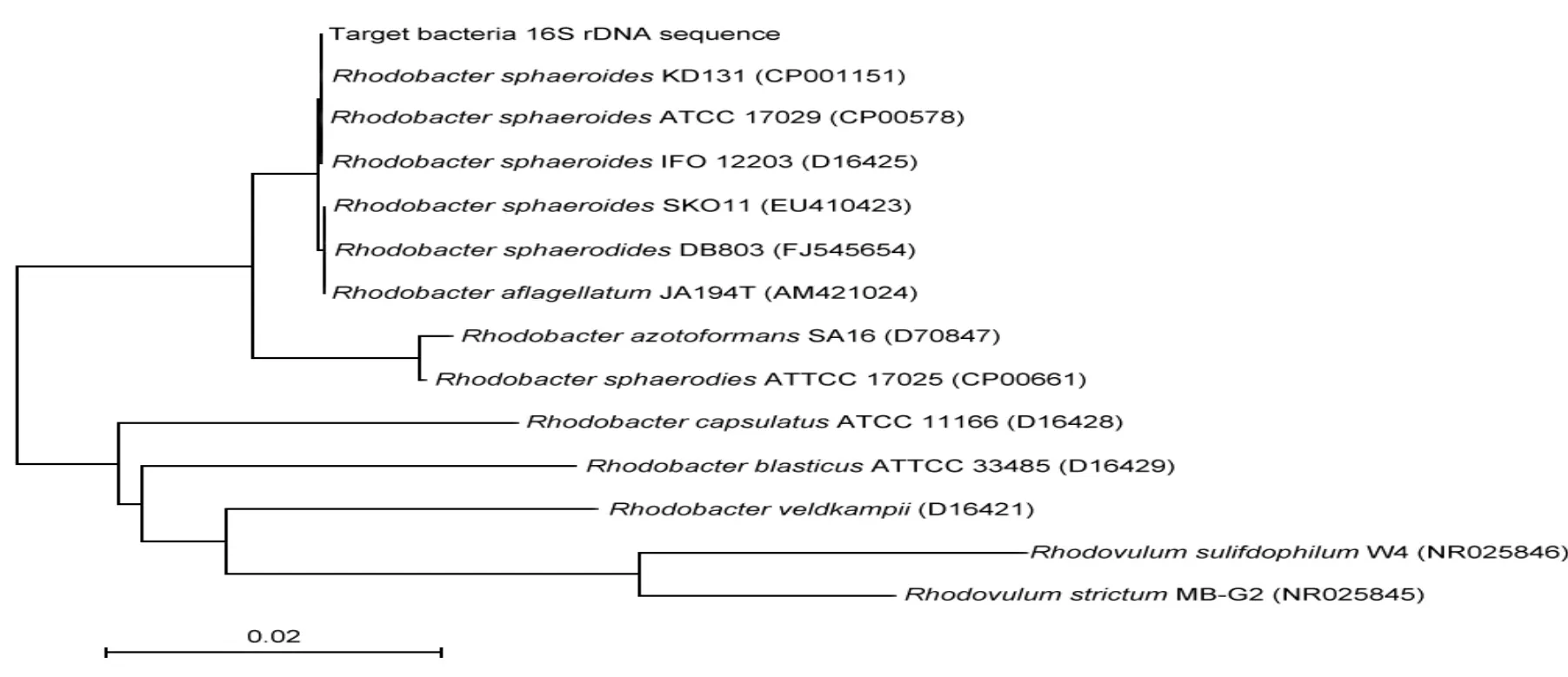
圖4 球形紅假單胞菌(Rhodopseudomonas sphaeroides)進化樹
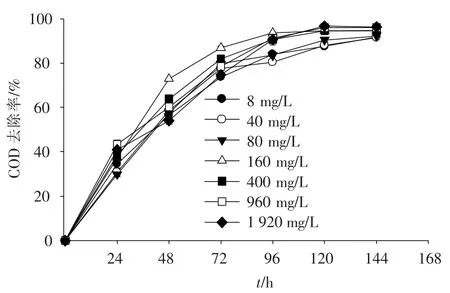
圖5 大豆加工廢水中COD去除率隨投菌量變化
2.2.2 光照氧氣
從圖6中可以看出,各處理組的COD值隨處理時間的增加呈下降趨勢,且同一時間點上,各組COD去除率的趨勢為黑暗好氧>自然光微氧>光照厭氧;在前72 h內,各組COD值下降最快,72 h后各組COD值變化相對平緩,逐漸達到處理極限值;在第72小時時,各組COD去除率相差不大,而在第168小時時,各組對COD的去除率為:黑暗好氧(95.1%)>自然光微氧(91.9%)>光照厭氧(83.4%).另外,在第72小時時,各處理組的菌體產量分別為:自然光微氧(2 125 mg·L-1)>光照厭氧(1 350 mg·L-1)>黑暗好氧(862.5 mg·L-1),綜合處理效果、經濟節能性以及菌體產量,自然光微氧為最佳處理條件.從COD去除效果的角度考慮,自然光微氧條件下對污水中COD的去除效果與黑暗好氧條件下的相差不大,且優于光照厭氧條件.而高濃度有機廢水由于透光性差,氧氣傳質差,需要通過設置高光強的照明器以及高強度的曝氣來分別控制污水處理過程中的嚴格光照厭氧與黑暗好氧條件,因此,相比之下,在自然光微氧條件下的PSB處理高濃度有機廢水工藝在工程上的應用更具有現實意義.
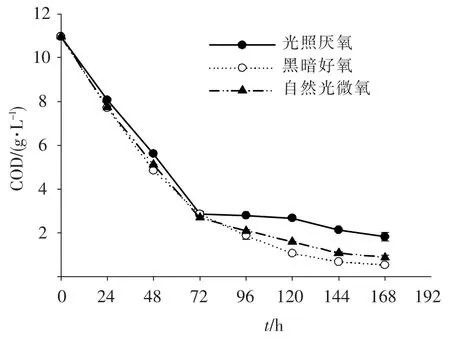
圖6 大豆廢水中COD質量濃度隨光照氧氣組合變化
3 結論
1)從土壤中富集分離的菌株Z08經Sherlock MIS系統鑒定及16S rDNA序列測定,判斷其為Rhodobacter sphaeroides,菌體為球狀,單個細菌的直徑約為0.3~1.0 μm,屬于革蘭氏陰性菌.Z08能夠在以乙醇、果糖、葡萄糖、甘油、甘露糖、甘露醇、山梨醇等小分子有機物為碳源的培養基中生長,而不能利用丙酸鈉、硫代硫酸鈉、甲基纖維素、油酸鈉及蛋白質作為碳源進行代謝.
2)處理溫度為26~28℃條件下,投菌量為160~400 mg·L-1時,Z08對大豆加工廢水 COD的去除率最佳.
3)在不同的光照氧氣組合條件中,自然光微氧組合處理條件最佳,第72小時時對COD的去除率達73.5%,菌體產量與光照厭氧及黑暗好氧兩個處理組相比達到最大,為2 125 mg·L-1.
[1]小林正泰(日).光合細菌處理高濃度有機廢水[J].發酵與工業,1978,36(9):753-760.
[2]R.E希坎南.伯杰氏細菌鑒定手冊[M].8版.北京:北京科學出版社,1984.
[3]東秀珠,蔡妙英.常見細菌系統鑒定手冊[M].北京:科學出版社,2001.
[4]BAI H,ZHANG Z,YANG G,et al.Bioremediation of cadmium by growing Rhodobacter sphaeroides:kinetic characteristic and mechanism studies[J].Bioresource Technology,2008,99(16):7716-7722.
[5]EROGLU E,GUNDUZ U,YUCEL M,et al.Photosynthetic bacterial growth and productivity under continuous illumination or diurnal cycles with olive mill wastewater as feedstock[J].International Journal of Hydrogen Energy,2010,35:5293-5300.
[6]KAEWSUK J,THORASAMPAN W,THANUTTAMAVONG M,et al.Kinetic evelopment and evaluation of membrane sequencing batch reactor(MSBR)with mixed cultures photosynthetic bacteria for dairy wastewater treatment[J].Journal of Environmental Management,2010,91:1161 -1168.
[7]LU H F,ZHANG G M,DAI X,et al.Photosynthetic bacteria treatment of synthetic soybean wastewater:direct degradation of macromolecules[J].Bioresource Technology,2010,101:7672-7674.
[8]MYUNG K K,CHOI K M,YIN C R,et al.Odorous swine wastewater treatment by purple non-sulfur bacteria,Rhodopseupdomonas pulustris,isolated from eutrophicated ponds[J].Biotechnology Letter,2004,26:819-822.
[9]PONSANO E H G,PAULINO C Z,PINTO M F.Phototrophic growth of Rubrivivax gelatinosus in poultry slaughterhouse wastewater[J].Bioresource Technololgy,2008,99(9):3836-3842.
[10]SIRIANUNTAPIBOON S,SRIKU M.Reducing red color intensity of seafood wastewater in facultative pond[J].Bioresource Technology,2006,97(14):1612-1617.
[11]TIANA Y,YUEA T,YUANA Y,et al.Improvement of cultivation medium for enhanced production of coenzyme Q10 by photosynthetic Rhodospirillum rubrum[J].Biochemical Engineering Journal,2010,51:160-166.
[12]秦娟.光合細菌成分的研究及光合細菌制劑降血脂藥效學初步篩選[D].太原:山西醫科大學,2009.
[13]李福枝,劉飛,曾曉希,等.光合細菌(PSB)應用的研究進展[J].食品與機械,2009,24(1):152-156,158.
[14]王劍秋,管云濤,騰飛.光合細菌法降解淀粉廢水積累菌體蛋白的研究[J].清華大學學報:自然科學版,2007,47(3):348-351.
[15]李福枝,劉飛,鄧靖.沼澤紅假單胞菌中類胡蘿卜素的提取與分析[J].生物技術,2007,11(1):51-53.
[16]LORRUNGRUANG C,MARTTHONG J,SASAKI K,et al.Selection of photosynthetic bacterium Rhodobacter sphaeroides 14F for polyhydroxyalkanoate production with two-stage aerobic dark cultivation[J].Journal of Bioscience and Bioengineering,2006,102(2):128-131.
[17]呂春梅.環境污染微生物學實驗指導[M].哈爾濱:哈爾濱工業大學出版社,2006.
[18]國家環保局水和廢水分析方法編寫組.水和廢水監
測分析方法[M].北京:中國環境出版社,1989.

