水產養殖用水生物脫氮技術的初步探索
倫艷霞 (天津市海納德動物藥業有限公司 天津300456)
隨著人們對水產品需求的增加,水產養殖業從傳統的養殖模式向集約化、工廠化模式轉變。在集約化養殖模式中,大量人工飼料的投喂、有機肥料的施加、水產養殖動物排泄的糞便、死亡動植物的殘骸構成了水體中有機物來源的主體,進而使水體的理化條件不斷惡化。水體中氮素含量超標,并積累了大量的氨氮、亞硝酸鹽等有害物質,最終給養殖戶造成巨大的經濟損失。[1-2]生物脫氮技術以其無污染、脫氮徹底和安全等優點被認為是目前最經濟、有效、可行性高的水體除氮技術。[3-4]
本實驗通過定向富集,從天津靜海縣某一常年養殖池塘中分離得到一株具有高效降解亞硝態氮能力的反硝化細菌,并在實驗室條件下,對該菌株的天然養殖水體中的反硝化特性進行了研究,為在生產實踐中開發應用反硝化細菌提供了有益的指導。
1 材料和方法
1.1 菌種分離
從天津靜海縣某一常年養殖池塘中采集水樣,取1 mL水樣加入到裝有100 mL滅菌液的富集培養基中,置30℃、130 rpm環境中富集培養3~4天,待培養基渾濁;取1 mL培養液進行梯度稀釋,將稀釋液分別涂布于溴百里酚培養基(BTB培養基),置30℃環境中培養1~2天,用接種環挑取不同形態單菌落于新的富集培養基中置30℃、130 rpm環境中震蕩過夜培養。重復劃線培養2~3次,直至平板菌落形態單一,無其他形態的菌落為止。挑選產氣快、氣泡多的菌株,進一步檢測培養基中亞硝態氮和總氮的含量。篩選一株產氣快、可迅速降解亞硝態氮和總氮的菌株進行實驗。
1.1.1 菌體形態和生理、生化鑒定依據文獻[5]進行。
1.1.2 反硝化活性檢測。挑取單菌落于反硝化培養基中過夜培養,按1%的接種量(前培養物OD600 nm為1)接種到裝有100 mL含有1.98 mg/L亞硝態氮的LB培養基中,置30℃,靜置密閉培養。第2天重新補加亞硝態氮至6.74 mg/L,繼續培養。每隔一定時間(2 h)取樣,測定培養基中剩余的C(NO2-)及菌體的濁度。
1.1.3 篩選出的菌株在天然養殖水體中的反硝化特性。
1.2 水樣采集
2010年7月8日從天津靜海縣某一養殖池塘于早上5~6點采集水樣;pH值為7.9,硝態氮濃度約為4.21 mg/L;亞硝態氮濃度約為0.08 mg/L;化學耗氧量COD為19.81~21.50 mg/L。
1.3 反硝化活性檢測
水樣經脫脂棉過濾后分為兩份:一份加入NaNO2作為富含亞硝態氮的水樣;另一份加入NaNO2和KNO3作為同時富含兩種氮素的水樣,加入最適合的碳源(0.2 g/L乙醇),使其中的碳氮摩爾比達到10∶1,分裝于500 mL的血清瓶中。按1%的量加入純培養后的菌株,培養72 h后檢測水樣中硝酸鹽和亞硝酸鹽的含量。以不加菌的水樣作為對照。另一組不加碳源的水樣,考察碳源對菌株反硝化活性的影響。亞硝酸鹽采用N-(1-萘基)-乙二胺光度法;硝態氮采用紫外分光光度法測定;總氮采用堿性過硫酸鉀法;CODMn采用酸性高錳酸鉀法;菌體量采用濁度法和平板計數法。
1.4 碳氮摩爾比試驗
水樣過濾后,加入不等量的最適合碳源(0.2 g/L乙醇),使其碳氮摩爾比分別為4.6∶1,8∶1,12∶1。按1%的量接入菌體,每天定時取樣,檢測水樣中的亞硝酸鹽的含量。
1.5 接菌量試驗
水樣過濾后,接入不等量的菌體,使菌濃度分別為3.0×106CFU/L、3.0×107CFU/L、3.0 ×108CFU/L、3.0 ×109CFU/L,72 h后檢測水樣中亞硝態氮含量。
2 結果與討論
2.1 菌株的分離與鑒定
經過富集、篩選和純化,得到一株在接種后72 h即產生大量氣泡、迅速降解亞硝態氮和總氮的菌株。該菌株為革蘭氏陽性菌、產芽孢,可進行葡萄糖發酵,接觸酶陽性,7%NaCl中生長,可水解淀粉和酪素,初步鑒定該菌株為芽孢桿菌屬。
2.2 菌株在天然養殖水體中的反硝化特性
2.2.1 反硝化活性檢測 從表1中可以看出,由于硝態氮可以同時作為微生物生長的營養鹽和反硝化的電子供體被利用,所以無論是否添加碳源,水樣中的硝酸鹽都有一定程度的下降,未發生積累。對照水樣中的氮素含量在兩種情況下無明顯變化,說明水樣自身所含有的微生物不具有顯著的反硝化能力,不會對實驗結果產生干擾。
接菌水樣在未添加碳源時,亞硝態氮的濃度由6.04 mg/L上升到6.31 mg/L,表明水樣中發生了微弱的反硝化作用。說明天然水樣中雖然含有一定量的有機質,但它們主要是一些未被降解的或較難生物降解的有機物,難以被反硝化細菌作為碳源利用。添加碳源時,投菌水樣中的亞硝態氮降到了0.007 4 mg/L,幾乎被完全降解,降解速率達到0.1 mg/(L·h),同時血清瓶中檢測到有N2O產生。說明當可利用碳源充足時,典型的養殖水環境即可滿足菌株進行高效反硝化作用的要求,使亞硝態氮轉化為含氮氣,徹底脫離水體。這對于治理養殖水體的亞硝態氮污染是非常有利的。
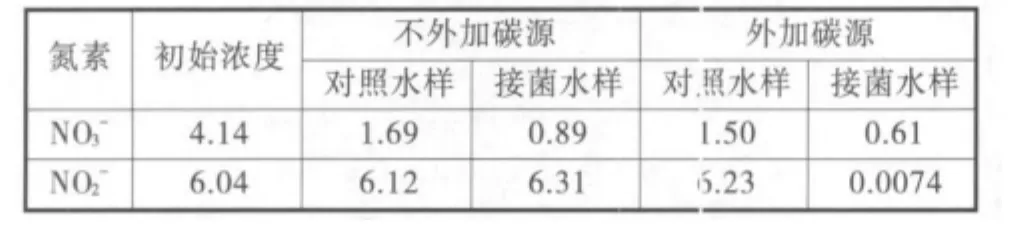
表1 菌株在富含亞硝態氮的天然養殖水體中的反硝化活性
從表2中可以看出,不添加碳源時,投菌水樣中的硝態氮含量由43.20 mg/L下降到35.66 mg/L,而亞硝態氮含量由6.04 mg/L上升到10.36 mg/L。說明當水體同時富含這兩種氮素時,菌株優先利用硝態氮作為反硝化電子的供體,即硝酸鹽的還原先于亞硝酸鹽的還原。當在水樣中添加乙醇時,硝態氮濃度降為2.25 mg/L,亞硝態氮濃度降為0.17 mg/L,降解率分別達到94.79%和97.75%。說明菌株雖然是采用亞硝酸鹽定向富集得到的,但它依然具有完整的反硝化酶系,且其硝酸鹽還原酶活性相當高。
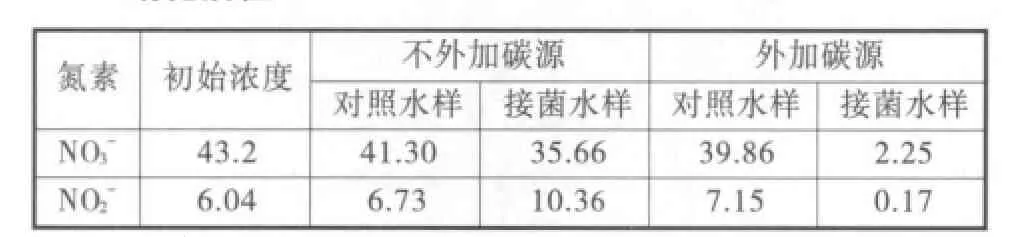
表2 菌株在富含硝態氮和亞硝態氮的天然養殖水體中的反表2 硝化活性
兩次實驗結果表明該菌株不僅可應用于富含亞硝態氮的水體,在同時富含硝態氮和亞硝態氮的水體中也可快速將兩種氮素除去,具有廣泛的適用性。
2.2.2 碳氮摩爾比對反硝化作用的影響 水體中的C、N摩爾比是影響脫氮系統除氮效果的一個重要因素。無氧條件下,反硝化作用所需碳與硝態氮和亞硝態氮之和的理論比值為4.6∶1;在Bardenpho工藝中,為達到充分脫氮,COD/TKN應大于10.0~11.1。丹麥的一些研究確定COD/TKN應大于8.3~12.5。[6-8]當碳氮摩爾比為4.6∶1時,水樣中亞硝態氮含量隨著接菌時間的增加逐漸升高;碳氮摩爾比為8.0∶1和12.0∶1的水樣,變化趨勢比較一致。在接菌的第2天亞硝態氮濃度達到一個極值,第3天迅速降到了最低,之后的10天亞硝態氮一直都維持在最低濃度,血清瓶中檢測到有N2O生成。這表明菌株在處理試驗所用水樣時,碳氮比為8.0∶1時即可達到良好的脫氮效果。
2.2.3 投菌濃度試驗 天然水體中存在著相當數量的土著微生物,它們和試驗投加的菌體存在著相互競爭的關系。為了確保所投加的微生物能在天然水體中發揮應有的反硝化作用,有必要從實際應用的可操作性出發,確定合適的投菌濃度。
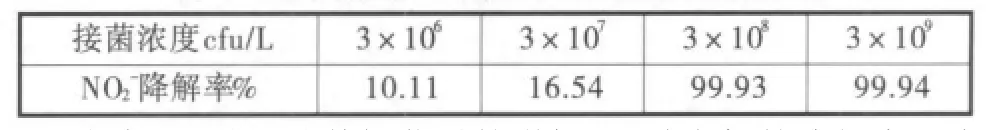
表3 接菌濃度對菌株反硝化特性的影響
由表3可知,隨著投菌量的增加,亞硝態氮的降解率逐漸升高;當投菌濃度達到108CFU/L時,菌株即可在水體中發揮高效的反硝化作用。采用LB培養基,對天然水樣中的可培養中溫細菌進行計數,測得微生物濃度約為1.12×108cfu/L。在這種培養條件下,淡水中僅有約0.25%的微生物可被檢測到,[9]說明水樣中實際的微生物濃度要遠遠大于108cfu/L,即試驗投加的菌體數量要遠遠小于土著微生物,表明該菌株在天然水體中具有較強的生存能力和環境適應能力。
目前該菌株已在國內多個池塘養殖水進行了試驗,均取得了良好的脫氮效果。芽孢桿菌具有很強的生命力和旺盛的繁殖能力,易于生產、運輸和保藏,能適應各種不良的環境條件,因此該菌株具有開發成微生態制劑,應用于污染水體生物脫氮的巨大潛力,前景十分廣闊。■
[1]胡家文,姚維志.養殖水體富營養化及其防治 [J].水利漁業,2005,25(6):74-76.
[2]魏泰莉,余瑞蘭,聶湘平,等.水中亞硝酸鹽對彭澤鯽血紅蛋白及高鐵血紅蛋白的影響[J].大連水產學院學報,2001,16(1):67-71.
[3]李軍,楊秀山,彭永臻.微生物與水處理[M].北京:化學工業出版社,2002:378-380.
[4]M oreno B,G ómezM A,G onzález2López J,et al.Inoculation ofa submerged filterforbiologicaldenitrification ofnitrate pollutedgroundw ater:a comparative study[J].J H azard M ater,2005,117(2-3):141-147.
[5]東秀珠,蔡妙英.常見細菌系統鑒定手冊[M].北京:科學出版社,2001:62-65.
[6]鄭平,徐向陽,胡寶蘭.新型生物脫氮理論與技術[M].北京:科學出版社,2004:55-74.
[7]張光亞,陳美慈,韓如易,等.一株異養硝化細菌的分離及系統發育分析[J].微生物學報,2003,43(2):156-159.
[8]傅利劍,郭丹釗,史春龍,等.碳源及碳氮比對異養反硝化微生物異養反硝化作用的影響[J].農村生態環境,2005,21(2):42-45.
[9]葉姜瑜,羅固源,吉芳英,等.污水生物處理功能微生物的多樣性[J].重慶大學學報(自然科學版),2005,28(10):119-123.

