米曲霉A-1固體發酵產胞外高活性植酸酶工藝研究
覃擁靈 何海燕
磷是動物體必需的常量元素,攝取不足會導致動物生產性能下降、酸堿失衡,嚴重者易患骨質疏松癥或佝僂病。飼料是動物體磷的主要來源,植物是飼料的主要來源,植物中的磷大部分(60%~70%)以植酸磷的形式存在[1]。飼料中的磷可分為無機磷和有機磷,其中有機磷是以植酸磷的形式存在。植酸[6-磷酸肌醇,myo-inositol(1,2,3,4,5,6)hexakis phosphate],常存在于種子、谷物、胚芽、米糠中。植酸不以單獨的游離態存在,與一些礦物元素鈣、鎂或鉀的復鹽(如肌醇六磷酸鈣鎂)和蛋白質以絡合物形態廣泛存在于植物中。因為其強螯合能力,影響其螯合的金屬及蛋白質的吸收,被認為是抗營養因子(anti-nutritive factor)[2-3]。
植酸酶 (Phytases,myo-inositol hexakisphosphate phosphohydrolase;EC 3.1.3.8和EC 3.1.3.26),即肌醇六磷酸水解酶,是催化植酸及其植酸鹽水解成肌醇與磷酸(或磷酸鹽)一類酶的總稱[1,4-5]。植酸的利用率因動物種類的不同而不同,反芻動物瘤胃中的微生物能產生植酸酶,對植酸磷的利用率比較高,成年反芻動物可高達90%[4]。單胃動物消化道中只有很少的植酸酶,且活性很低,所以不能很好地利用飼料中的植酸磷,使得植酸磷隨糞便排入環境,既浪費資源,又污染環境。在飼料中添加植酸酶不僅可以解除植酸的抗營養作用,提高動物對飼料的利用率,還可以減少無機磷在飼料中的添加量,從而減少單胃動物對無機磷和植酸磷的排除量,最終減少磷對環境的污染[4-5]。植酸酶的主要來源于動物、植物和微生物,但是動物、植物中植酸酶活性很低,穩定性也比微生物來源的植酸酶差,因此目前研究都集中于微生物植酸酶[4]。
前期試驗通過紫外誘變后得到一株酶活高遺傳穩定性優良的高產植酸酶菌種——米曲霉(Aspergillus oryzae)A-1菌株,在飼料工業上有潛在應用價值[6]。本課題利用本地來源充足、價格低廉的農業副產品桑桿、蔗渣、棉籽殼、板栗殼作為培養基碳源開展固體發酵產植酸酶條件優化研究,同時研究表面活性劑誘導產胞外酶及酶提取工藝,提高固體發酵產植酸酶得率。
1 材料與方法
1.1 菌種
實驗室選育的米曲霉(Asper gillusoryzae)A-1菌株[6]。
1.2 PDA斜面培養基
依照諸葛健(1994)[7]的方法配制。
1.3 菌種活化及種子培養
取已經活化的米曲霉A-1新鮮斜面種,在無菌超凈工作臺中將斜面種用生理鹽水洗下制成孢子液,利用生理鹽水配制成孢子含量為1×107個/ml的孢子液,取100 ml的孢子液置于250 ml三角瓶中,160 r/min恒溫搖床30℃振蕩培養12h,使孢子處于預萌發狀態,備用接種。
1.4 固體發酵產酶培養基
①桑桿固體發酵培養基:6 g粉碎的桑桿、4 g麩皮;②蔗渣固體發酵培養基:6 g蔗渣、4 g麩皮;③板栗殼渣固體發酵培養基:6 g粉碎的板栗殼渣、4 g麩皮;④棉籽殼固體發酵培養基:6 g天然棉籽殼、4 g麩皮。
營養鹽液:5 g NH4NO3、0.5 g KCl、0.5 g MgSO4·7H2O、0.3 g MnSO4·7H2O、0.3 g FeSO4·7H2O、0.2 g NaCl、0.5 g NH4Cl,溶于 1 000 ml蒸餾水中。
所有固體培養基材料均粉碎至100目(篩孔尺寸0.150 mm),以上4種固體發酵培養基均各加入30 ml營養鹽液于250 ml錐形瓶中,自然pH值,121℃滅菌20 min。
1.5 不同時間固體發酵產酶及酶液的提取
取107個孢子轉入4種固體發酵生產植酸酶培養基中,30℃培養,培養3~6 d后提取酶液。按10:1(v/m)加入dd H2O,40℃、200 r/min恒溫搖床2 h,8層紗布過濾,4℃、5 000 r/min離心20 min,上清液即為粗酶液[8]。粗酶液4℃冰箱中保存,待測酶活時用。
3次平行試驗,取平均值。
1.6 不同溫度產酶研究
取米曲霉A-1菌株107個孢子轉入4種固體發酵產植酸酶培養基中,將已接種的固體產酶培養基統一放到恒溫培養箱中,30~50℃,每隔5℃一個梯度,培養適宜時間后提取酶液。
1.7 培養基初始pH值對產植酸酶的影響
調節培養基初始pH值為3~6,考察培養基初始pH值對產植酸酶的影響。
1.8 不同氮源對產酶的影響
以營養鹽液中的不同氮源培養米曲霉:NH4Cl、NH4NO3、(NH4)2SO4、花生餅粉、黃豆餅粉、蛋白胨,試驗方法同1.5。
1.9 表面活性劑對產酶的影響
固體培養基中添加0.2%~0.7%吐溫80,研究表面活性劑吐溫80對產酶的影響[9-10]。
1.10 酶液的提取優化
參照1.5提取法,添加2%不同鹽液[9]:CaCl2·2H2O、CaCO3、CaSO4·2H2O、KCl,優化酶液提取工藝。
1.11 植酸酶的酶活檢測方法[11-13]
采用2009年制定的中華人民共和國國家標準:飼用植酸酶活性的測定——分光光度法進行測定,酶活力單位定義:樣品在植酸鈉濃度為 5.0 mmol/l,溫度37℃,pH值5.5的條件下,每分鐘從植酸鈉中釋放出1 μmol無機磷,即為1個酶活單位,以 U表示。
2 結果與分析
2.1 不同固體碳源及不同時間產植酸酶研究
向4種固體產酶培養基中接入米曲霉孢子懸液1 ml(107個孢子),于30℃恒溫培養箱中培養。每隔1 d按照以上的酶液提取方法定期取出一定量酶液,測其酶活(見表1)。試驗結果表明,第4 d所產的植酸酶酶活最高,推測米曲霉產植酸酶應該為與生長無相關型發酵,產物在菌種生長穩定期合成,時間過長營養供應不足,菌體死亡后自溶活性降低,最適發酵時間為4 d。
試驗結果表明,桑桿、蔗渣、板栗殼、天然棉籽殼均可以固體發酵產植酸酶,第4 d酶活最高,其中蔗渣為碳源的培養基植酸酶活性較高,活力為71.2 U/g,以下固體發酵試驗優化選用蔗渣為碳源。
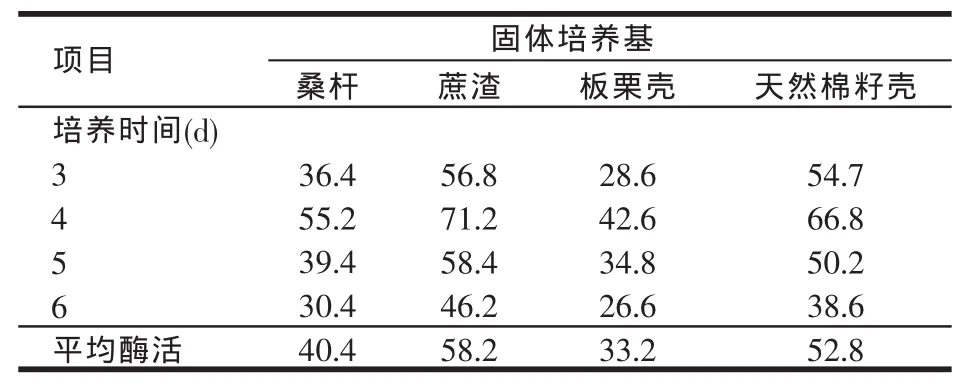
表1 固體碳源和培養時間對產植酸酶酶活的影響(U/g)
2.2 培養基初始pH值對產植酸酶的影響(見圖1)
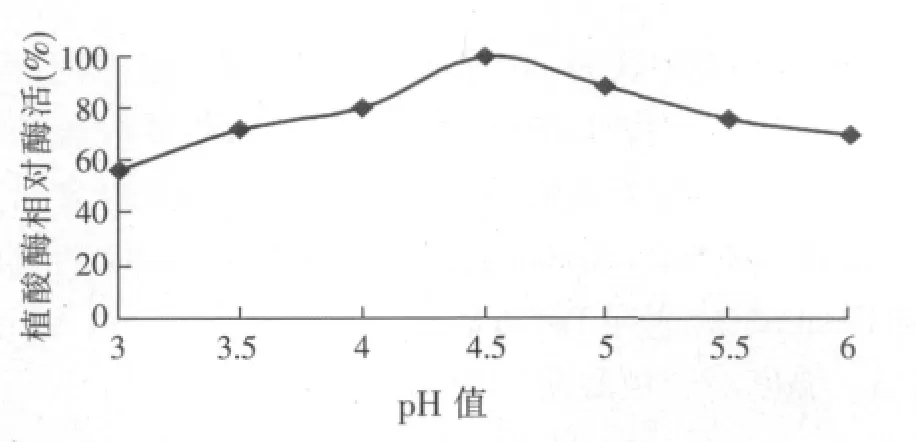
圖1 pH值對產植酸酶的影響
30℃,不同pH值培養4 d。培養基最佳初始pH值產酶酶活最高,設該pH值條件下酶活為100%,測定不同初始pH值條件下產酶的相對酶活作圖。測定蔗渣天然固體培養基pH值為6,試驗結果顯示,pH值為4.5時,米曲霉A1菌株所產的植酸酶酶活最高,比天然培養基提高20%,達到85.4 U/g。pH值是微生物代謝的綜合反映,由試驗結果推測,pH值4.5為酶的最適pH值;pH值4.5影響米曲霉A1細胞膜所帶電荷發生改變,從而改變細胞膜的通透性,促進植酸酶排出細胞外,提高整體酶活。
2.3 氮源對產植酸酶的影響(見圖2)

圖2 不同氮源對產植酸酶的影響
氯化銨等6種氮源被用于固體發酵產植酸酶,30℃培養4 d。設氯化銨為氮源時酶活為100%,以不同氮源與相對酶活作圖。由圖2可知,花生餅粉、黃豆餅粉、蛋白胨這些有機氮源產酶相對較低,硝酸銨可以明顯提高產酶能力,比氯化銨為氮源提高32%,達到112.8 U/g,以下試驗選用硝酸銨為氮源。
2.4 吐溫80對產胞外植酸酶的影響(見圖3)
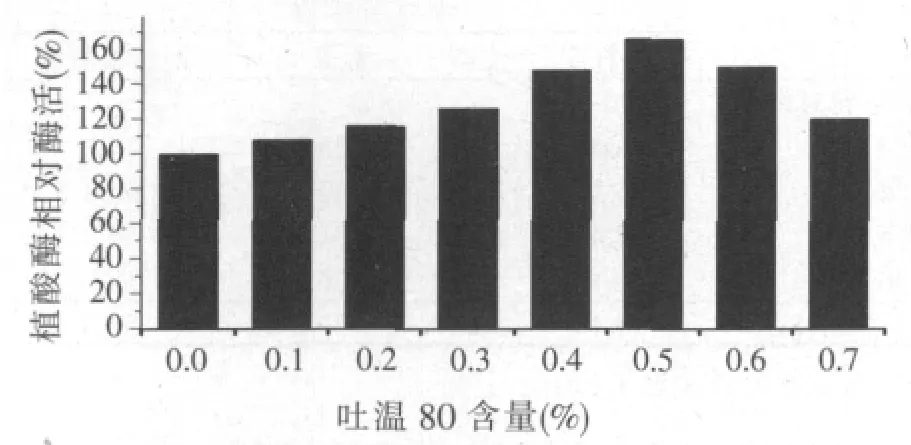
圖3 吐溫80對產植酸酶的影響
Ebune等[8]認為,吐溫80可以刺激微生物生長,合成更多植酸酶[10],同時,吐溫80可以明顯改善細胞滲透性,誘導胞外植酸酶的生產[11]。當吐溫80含量為培養基的0.5%(w/w)時,酶活比未添加吐溫80的對照組增加66%,達到187.2 U/g。
2.5 溫度對產植酸酶的影響(見圖4)
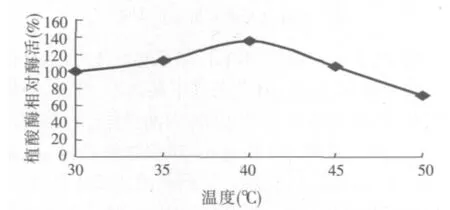
圖4 溫度對產植酸酶的影響
溫度是發酵過程一個很重要的影響因子,較高的溫度可以加速微生物體內生物化學反應過程,提高催化合成植酸酶的酶活性。由圖4可知,當培養溫度為40℃時,酶活比30℃培養溫度提高36%,為254.6 U/g。但過高的溫度影響微生物的生長,產酶能力下降。
2.6 酶液的提取優化(見表2)
與不添加鹽液的空白對照組(H2O)相比,添加2%不同鹽液 CaCl2·2H2O、CaCO3、CaSO4·2H2O、KCl,可以提高固體發酵產植酸酶得率,推測這些鹽液可以改變細胞通透性,利于胞內植酸酶排出,其中添加CaCl2·2H2O植酸酶得率最高,相對酶活比空白對照試驗增加32%,酶活達到336 U/g。
3 結論
以實驗室保存的米曲霉A1菌種為出發菌株,研究4種固體培養基發酵產植酸酶,結果表明,蔗渣所產植酸酶活性最高,以NH4NO3為氮源,添加0.5%表面活性劑吐溫80可以誘導產胞外植酸酶,CaCl2·2H2O更利于酶的提取,40℃培養4d,酶活達到336U/g。
蔗渣以纖維素及半纖維素為主要成分,纖維素含量達45%~50%,半纖維素22%~30%,表皮組織的木質素含量約占19%~23%。蔗渣的木質素分子質量和聚合度低,含豐富的多糖類物質。甘蔗渣是我國甘蔗糖廠數量最大的纖維殘渣副產物,年產量約為2 200萬噸左右。蔗渣來源豐富、價格低廉[14],簡單粉碎處理就可以作為固體碳源。本試驗對培養基的氮源、培養溫度和pH值等進行發酵條件優化,進一步提高了米曲霉固體發酵產植酸酶的得率和酶活,將會產生可觀的效益。
[1]Lei X G,Porres J M.P hytase enzymology,applications,and biotechnology[J].Biotechnol.Lett.,2003,25:1787-1794.
[2]Lei X,Pao K,Elwyn R M,et al.Supplemental microbial phytase improves bioavailability of dietary zinc to weanling pigs[J].Nutr.,1993,123:1117-1123.
[3]SharmaCB,GoelM.Myo-inositolhexaphosphateas potential inhibitor ofα-amylasesofdifferentorigins[J].Phytochemistry,1978,47:201-204.
[4]Mullaney E J,Daly C B,Ullah A H J.Advances in phytase research[J].Appl.Microbiol.,2000,47:56-61.
[5]謝英利,楊海龍,吳明江.植酸酶發酵生產的研究進展[J].飼料工業,2011,32(2):36-39.
[6]覃擁靈,何海燕.產植酸酶菌種的選育及發酵條件初步研究[J].廣西輕工業,2011(8):14-16.
[7]諸葛健,玉祥業.微生物實驗技術手冊[M].北京:中國輕工業出版社,1994:367.
[8]Ebune A,S Al-Asheh,Z Duvnjak.Effects of phosphate,surfactants and glucose on phytase production and hydrolysis of phytic acid in canola meal by Aspergillus ficuum during solid state fermentation[J].Biores.Technol.,1995,54:241-247.
[9]Mandviwala T N,Khire J M.Production of high activity thermostable phytase from thermotolerantAspergillusnigerin solid state fermentation[J].Journal of Industrial Microbiology&Biotechnology,2000,24:237-243.
[10]Al-Asheh S,Duvnjak Z.The effect of surfactants on the phytase production and the reduction of the phytic acid content in canola meal by Aspergillus carbonarius during a solid state fermentation process[J].Biotechnology Letters,1994,16(2):183-188.
[11]張英.飼料中植酸酶活性檢測方法的比較與研究[J].飼料工業,2010,31(22):54-57.
[12]劉志偉,黃玉亭,張鐵鷹,等.國標法測定植酸酶活性存在問題的探討[J].中國飼料,2006(18):29-31.
[13]中華人民共和國質量監督檢驗檢疫總局.GB/T18634—2009飼用植酸酶活性的測定——分光光度法[S].北京:中國標準出版社,2009.
[14]王允圃,李積華,劉玉環,等.甘蔗渣綜合利用技術的最新進展[J].中國農學通報,2010,26(16):370-375.

