大腸桿菌植酸酶a ppA2基因真核表達載體的構建及在細胞中的表達
白立景,鞠輝明,牟玉蓮,楊述林,李 奎,陳明勇
(1.中國農業大學動物醫學院,北京 海淀 100193;2.中國農業科學院北京畜牧獸醫研究所,北京 海淀 100193)
植酸酶(phytases)是廣泛存在于動植物及多種微生物中的一種磷酸酶,可以催化植酸(肌醇六磷酸)和植酸鹽水解成肌醇和磷酸(或磷酸鹽)。自然界中,豆類等油料作物及谷物中的植酸是磷的主要存儲形式,由于一些單胃動物缺少植酸酶而不能利用這些形式的磷,所以只能通過在飼料中添加無機磷來滿足正常生長及代謝需要,而動物體內的植酸磷不能利用而通過糞便排出體外,造成磷資源的浪費和環境的磷污染。通過在畜禽飼料中添加植酸酶促進植酸磷的利用是國內外普遍采用的手段[1]。生產中應用的植酸酶大多通過工程菌產生,按照目前的技術體系,很難在短時間內通過工程菌的方法大幅度提高表達效率,因此利用真核表達系統,通過哺乳動物的生物反應器制備植酸酶是一個高效低成本的方法[2]。本試驗應用RT-PCR技術從大腸桿菌中擴增得到植酸酶ap p A2基因,構建了app A2基因真核表達質粒pcDNA-ap p A2,并在豬 PK15細胞進行了初步表達,為通過生物反應器制備植酸酶研究奠定了基礎。
1 材料與方法
1.1 材料 pcDNA3.1(+)質粒、DH5α大腸桿菌感受態細胞、埃希大腸桿菌菌株、PK15細胞系,由本院保存。Liperfectamine 2000購自Invitrogen生物公司;胎牛血清和DMEM培養基購自GIBCOL BRL公司;限制性內切酶 HindⅢ、EcoRⅠ購自Fermantas公司;Ex-Tag E及定量PCR試劑購自寶生物工程(大連)有限公司;T 4 DNA連接酶購自Promega公司;植酸鈉購于Sigma公司。
1.2 pcDNA-app A2真核表達載體的構建 根據已經公布的植酸酶app A2基因序列,設計并合成1對引物P1及P2,并在引物中設計HindⅢ、EcoRⅠ酶切位點(劃線部分),以埃希大腸桿菌中為模板,用高保真酶擴增植酸酶app A2基因,按常規方法組成總反應體系,PCR擴增程序為 98℃10s,68℃2 min,循環30次。引物序列如下:
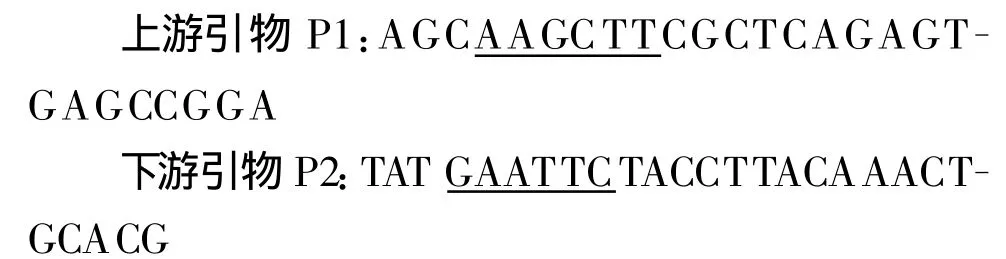
PCR產物鑒定純化后用Hin dⅢ、Eco RⅠ雙酶切,同時用 Hin dⅢ、Eco RⅠ雙酶切 pcDNA3.1(+)載體,將PCR擴增產物和酶切后的載體連接,轉化DH5α感受態大腸桿菌,挑選單個菌落培養后提取質粒,得到重組表達質粒pcDNA-ap p A2,而后進行PCR和酶切鑒定;同時將鑒定正確的質粒進行測序。
1.3 pcDNA-app A2載體的細胞水平表達檢驗以pcDNA3.1(+)質粒為對照,分別將pcDNA和pcDNA-ap p A2質粒用S ca I酶切線性化后純化,進行細胞轉染,經G418篩選,3周后擴大培養,部分細胞用以測定細胞內植酸酶活性,部分細胞提取總RNA,反轉錄成cDNA,以此為模板,以豬GAPD H基因為內參(引物為 GAPDH-L1和GAPDHR1),進行熒光定量PCR,測定 ap p A2表達量(引物為 app A2-RT L1和 ap p A2-RTR1)。按照 ABI定量試劑說明書進行,PCR擴增程序為95℃5 min;94℃20 s,退火溫度56℃30 s,72℃1 min,循環 40次,72℃延伸5 min。引物見下:
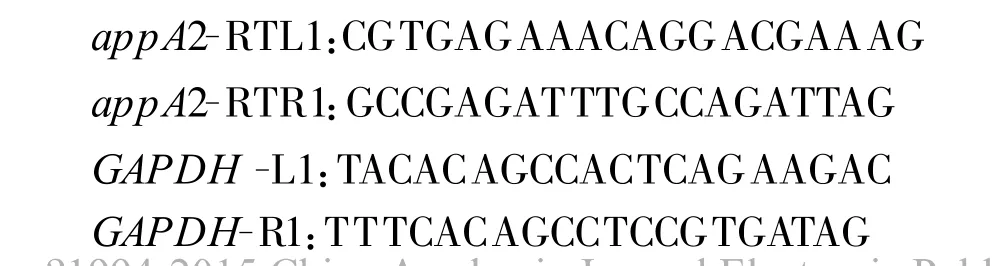
1.4 細胞內植酸酶活性的測定 分別收集試驗組和對照組細胞并計數,反復凍融,破碎細胞,離心,收集細胞上清即為酶粗提液,調節p H值為5.5,采用文獻[3]改進的鉬酸銨顯色法測定細胞內植酸酶活性。植酸酶活性以相對OD值表示,重復2~3次。本試驗中酶活性單位定義為在37.0℃、p H值5.50條件下,每分鐘從0.005 mol/L的植酸鈉溶液中釋放出1μmol/L的無機磷所需要的酶量,即為1個酶活單位,以FTU/μL表示。
2 結果與分析
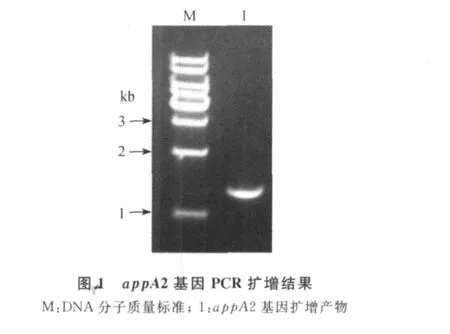
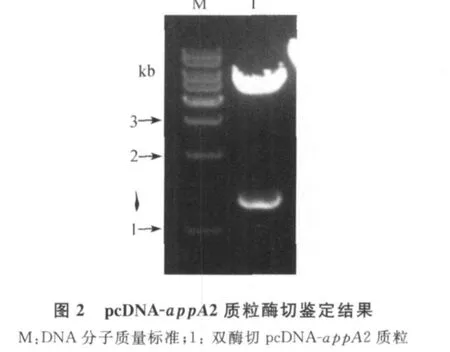
2.1 pcDNA-app A2真核表達載體的構建 從大腸桿菌提取總RNA,進行RT-PCR擴增,經瓊脂糖凝膠電泳檢查,得到一條約1.3 kb的特異性片段(圖1),與預期結果基本一致。用質粒提取試劑盒提取 pcDNA-app A2重組表達質粒,經 Hin dⅢ、Eco RⅠ雙酶切鑒定,可見在約5.4 kb和1.3 kb處各出現一條目的條帶,5.4 kb的目的條帶為pcDNA3.1(+)載體,均和預期目的條帶大小基本一致(圖2)。將酶切鑒定正確的重組質粒經全自動測序,鑒定結果與Gen Bank登錄序列完全一致,表明pcDNA-app A2重組表達載體構建成功。
2.2 pcDNA-app A2載體的細胞水平表達檢驗 圖3為熒光定量PCR儀顯示結果,其中縱坐標以log10值為單位,各組值為每組目的基因表達水平和內參表達水平的比值。以對照組細胞相應基因表達為參照基數1,試驗組表達水平值為對照組相應基因表達的倍數。檢測結果表明,構建的重組表達載體能有效表達外源基因app A2。以對照組細胞內appA2表達量為基準(log0=1),重組表達載體組表達量是對照組的1686.55倍(圖3)。
2.3 細胞內植酸酶活性的測定 采用改進的鉬酸銨顯色法測定植酸酶活性,首先由磷標準溶液測得磷標準曲線,得到回歸方程為y=0.2783x+0.0842,回歸系數為R2=0.9942。對照磷標準曲線,重組表達質粒組細胞內植酸酶活性分別為0.239、0.221 FTU/μL及0.244 FTU/μL,對照組細胞內植酸酶活性為0.082、0.075 FTU/μL及 0.088 F TU/μL,兩組分別平均為0.235±0.023 F TU/μL及0.082±0.015 FT U/μL,兩者差異極顯著(P<0.01)文藝(圖4),表明我們制備的pcDNA-ap p A2真核表達載體能有效表達植酸酶基因,并且具有好的植酸酶活性。
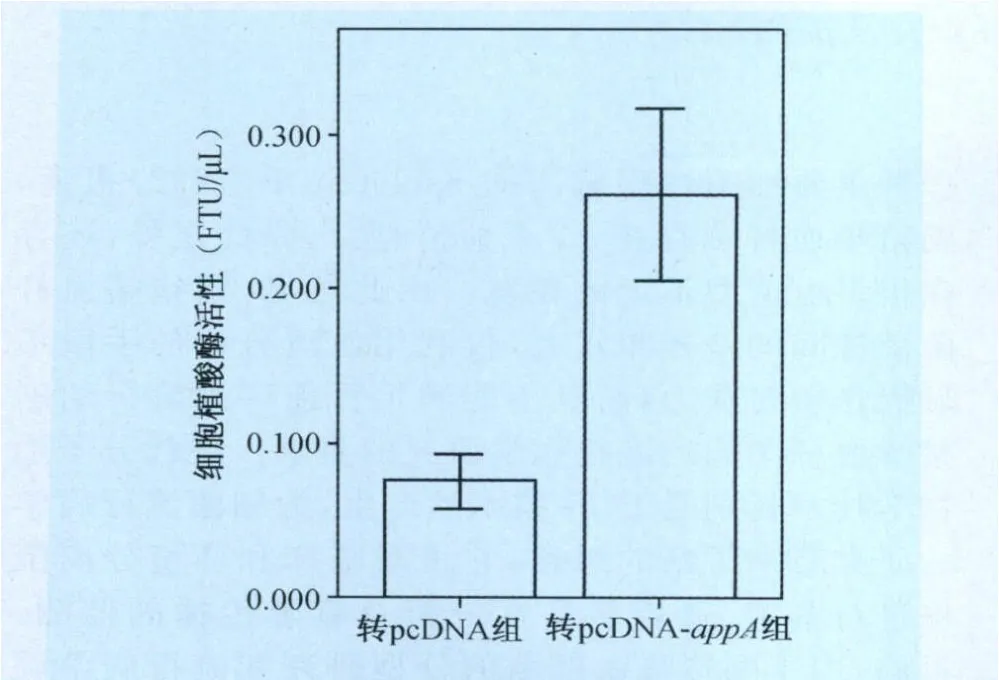
圖4 細胞內植酸酶活性測定結果
3 討論
植酸酶已被公認為一種新型營養型飼料添加劑,生產中用植酸酶代替飼料中添加的無機磷,能使動物磷排泄量減少,同時能增加動物對飼料中蛋白質、脂肪及微量元素和維生素的利用率[10],因此植酸酶作為動物飼料添加劑在生產中需求量非常大,但植酸酶在天然材料中表達量低而且活性也很低,很難滿足生產需要。近年來利用生物工程技術對植酸酶進行了改造,通過多種微生物[4-6]等作為植酸酶的表達系統取得了很大的進展,但每一類表達系統都有其自身特點和不足[4]。目前植酸酶的生產和應用主要面臨3個主要問題:一是生產中尚未獲得具有商業價值耐高溫的植酸酶,因為制備顆粒飼料時高溫處理是必需的技術環節;二是植酸酶的pH值使用范圍窄,很難適應動物胃內的酸性環境;三是植酸酶作為飼料添加劑必須抵抗胃腸道內的多種蛋白酶的水解作用。上述3個問題大大降低了植酸酶的利用率,因此通過構建植酸酶真核表達載體在動物體內表達植酸酶基因,有望避免植酸酶作為飼料添加劑時遇到的上述困難。
目前,已有眾多試驗研究從土壤和水體中的真菌及細菌基因組序列中克隆出植酸酶基因,單植酸酶的比活力相差很大。其中,來自埃希氏大腸桿菌的植酸酶是目前發現的比活性最高的植酸酶,在已知植酸酶中是具有廣泛應用前景的一種[5]。試驗結果表明,我們已成功構建植酸酶ap p A2基因真核表達載體,為下一步通過生物反應器制備植酸酶奠定了基礎。
[1] Lei X G,Ku P K,Miller E R,etal.Supplementing corn-soybean meal diets w ith microbial phytase lin early improves phy tate phosphoru s u tilization by w ean ling pig s[J].J Anim Sci,1993,71(12):3359-3367.
[2] Clark A J.T he m amm ary gland as a bioreactor:exp ression,processing,and production of recombinan t protein s[J].J Mammary Gland Biol Neoplasia,1998,3(3):337-350.
[3] 譚寶玲,陳靜,馮建文.植酸酶活性測定方法[J].廣東飼料,2006,15(5):43-44.
[4] Haefner S,Knietsch A,S cholten E,et al.Biotechn ological production and applications of phytases[J].Ap pl Microbiol Biotechnol,2005,68(5):588-597.
[5] Mik sch G,Kleist S,Friehs K,et al.Overex pression of the phy tase from Escherichia coli and its extracellular p roduction in bioreactorS[J].Appl Microbiol Biotechnol,2002,59(6):685-694.
[6] T ran T T,M am o G,Mattiasson B,et al.A thermostable phy tase from Bacillus sp.MD2:cloning,ex pression and highlevel production in E scherichia coli[J].J Ind Microbiol Biotechnol,2009,146(2):468-477.

