通過膜分離法純化豬瘟疫苗的效果分析
武桂梅,王振輝,張桂榮,劉 軍
(1.吉林農業科技學院動物科學學院,吉林吉林132101;2.吉林正業生物制品股份有限公司,吉林 吉林 132101)
目前,用于預防畜禽傳染病的疫苗都是沒有純化的。疫苗中含有大量的制苗材料來源的蛋白質及抗生素,無疑是接種動物的各種不良反應的過敏原,嚴重干擾疫苗蛋白抗原的免疫應答,大大減少中和抗體的產生,導致一些畜禽個體免疫失敗[1]。本試驗采用膜分離技術對豬瘟病毒的純化濃縮,顯著提高了免疫效果。
1 材料與方法
1.1 微濾/超濾管式陶瓷(有機)膜分離系統(型號:S Y-MU-2-500) 管式陶瓷膜元件孔徑0.80μm、0.60 μm、0.45μm、0.22 μm;管式有機膜元件(改良纖維素)5K由本院生物制藥實驗室提供。
1.2 豬瘟疫苗病毒細胞培養液 吉林正業生物制品股份有限公司提供90000 m L效力檢驗不合格(病毒最小感染量≥10-4/mL)的豬瘟細胞培養液及合格的常規豬瘟凍干活疫苗(500頭份,批號20080109)。
1.3 試劑與實驗動物 中國農業科學院哈爾濱獸醫研究所生產的豬瘟陽性血清(批號20080206)、豬瘟陰性血清(批號20080110)、豬瘟正向間接血凝診斷液(批號20080309)、豬瘟病毒脾淋毒(最小感染量≤10-5/m L)均由吉林正業生物制品股份有限公司提供。仔豬由吉林農業科技學院種豬場提供;健康家兔、小鼠、豚鼠由吉林正業生物制品股份有限公司健康動物舍提供。
1.4 不同膜組合對豬瘟病毒液的純化與濃縮[2]每組膜純化濃縮處理30000 mL不合格的豬瘟病毒細胞培養液,分三組進行:1組(0.80μm、5K、0.22 μm)陶瓷(有機)膜過濾器;2組(0.60μm、5K 、0.22 μm)陶瓷(有機)膜過濾器;3組(0.45μm、5K 、0.22 μm)陶瓷(有機)膜過濾器。先分別用0.80μm、0.60μm、0.45μm 陶瓷膜過濾雜蛋白,再用5K有機膜濃縮病毒,最后用0.22μm陶瓷膜除菌處理。
1.5 雜蛋白去除率與無菌檢驗[2-3]三組純化的豬瘟病毒液分別用紫外分光光度計檢測雜蛋白去除率;分別用硫乙醇酸鹽培養基(T.G)、酪胨瓊脂培養基(G.A)、葡萄糖蛋白胨水培養基(G.P)按文獻中的方法進行無菌檢驗。
1.6 純化濃縮的豬瘟病毒液效力檢驗[3-4]三組純化的豬瘟病毒液分別稀釋為10-4、10-5、10-6三個滴度,每個滴度分別用3.0 kg左右的健康家兔2只,每只家兔耳靜脈注射1 m L。家兔接種后,每天上下午各測體溫1次,48~96 h后,每隔6 h測體溫1次,根據體溫反應和無體溫反應兔攻擊豬瘟病毒脾淋毒后的體溫測定結果,判定純化濃縮的各組豬瘟病毒液的最小感染量。
1.7 純化濃縮的豬瘟病毒液安全檢驗[3-4]三組純化的豬瘟病毒液分別進行10倍稀釋,分別皮下注射體重 18~22 g小鼠各5只,每只0.2 mL;肌肉注射體重350~ 400 g豚鼠各2只,每只1 m L,均觀察10 d;肌肉注射無豬瘟母原抗體10 kg左右的仔豬各4頭,每頭5 m L,飼養觀察21 d,同時設同批對照小鼠5只、豚鼠2只、仔豬 4頭,按要求飼養在非免疫區,判定結果。
1.8 純化濃縮的豬瘟凍干活疫苗成品檢驗 分別將三組純化濃縮合格的豬瘟病毒液添加常規的豬瘟凍干活疫苗保護劑,按照豬瘟疫苗凍干曲線進行凍干制造成品。其成品的無菌檢驗、效力檢驗、安全檢驗分別按1.5、1.6、1.7項進行。
1.9 純化濃縮的豬瘟凍干活疫苗成品免疫試驗
1.9.1 仔豬分組與免疫[5-6]根據試驗內容,選用28日齡斷奶前仔豬80頭(母原抗體平均≤4log2),隨機平均分為4組。第 1、2、3組每頭仔豬對應接種三組純化濃縮的豬瘟凍干活疫苗1.0頭份;第4組為常規疫苗免疫對照組,每頭仔豬接種常規豬瘟活疫苗1.0頭份,四組免疫仔豬均在相同條件下飼養90 d監測抗體消長規律。
1.9.2 抗體測定[7-8]分別于免疫后第0、7、14、21 、28、35、42、49、56、63、70、77 、84 天對 4 組試驗豬耳靜脈采血,分離血清,用豬瘟正向間接凝集診斷試劑盒測定豬瘟抗體。每組試驗豬的抗體效價均以各自的幾何平均值表示。
2 試驗結果與分析
2.1 雜蛋白去除率與無菌檢驗結果 1組的陶瓷膜是0.80μm,孔徑最大,只有大分子雜蛋白被截留除去,所以雜蛋白去除率較低,為63.1%,濃縮除菌收獲量最多為10800 m L;3組的陶瓷膜是 0.45 μm,孔徑最小,多數雜蛋白被截留除去,所以雜蛋白去除率最高,為79.4%,但濃縮除菌收獲量最少,為4700 mL;2組純化效果介于1組和3組之間。結果見表1。
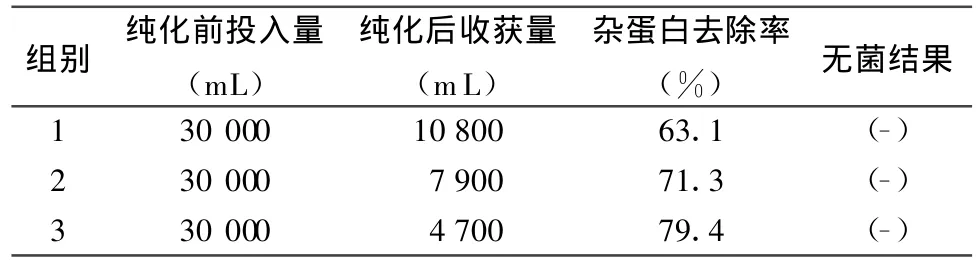
表1 豬瘟疫苗病毒液純化濃縮雜蛋白去除率與無菌檢驗結果
2.2 純化濃縮的豬瘟病毒液凍干前后效力檢驗、安全檢驗結果 3組凍干疫苗由于純化濃縮平均去除雜蛋白達到71.27%,大大減少雜蛋白對最小感染量和安全檢驗的影響,達到檢驗一次通過率,全部合格。結果見表2。
2.3 純化濃縮的豬瘟凍干活疫苗成品免疫抗體檢測結果 通過純化濃縮的凍干活疫苗的免疫和常規疫苗免疫對照試驗檢測的數據,繪制出抗體消長曲線,結果見圖1。3組純化濃縮的凍干活疫苗免疫28 d時:1組抗體平均升至最高,為8.3log2稀釋倍數,平均抗體升高為5.9log2稀釋倍數;2組抗體平均升至最高,為8.7log2稀釋倍數,平均抗體升高為6.6log2稀釋倍數;3組抗體平均升至最高為9.3log2稀釋倍數,平均抗體升高為7.2log2稀釋倍數;而常規的弱毒凍干活疫苗抗體平均升至最高為6.8log2稀釋倍數,平均抗體升高為4.8log2稀釋倍數。免疫至84 d時,三組純化凍干疫苗平均抗體增加8.8log2稀釋倍數,比普通豬瘟疫苗平均抗體增加3.9log2稀釋倍數,差異極顯著(P<0.01)。免疫63~84 d時,三組純化凍干疫苗抗體滴度仍然高于免疫前水平,而普通常規的凍干疫苗抗體滴度顯著下降到免疫前水平。
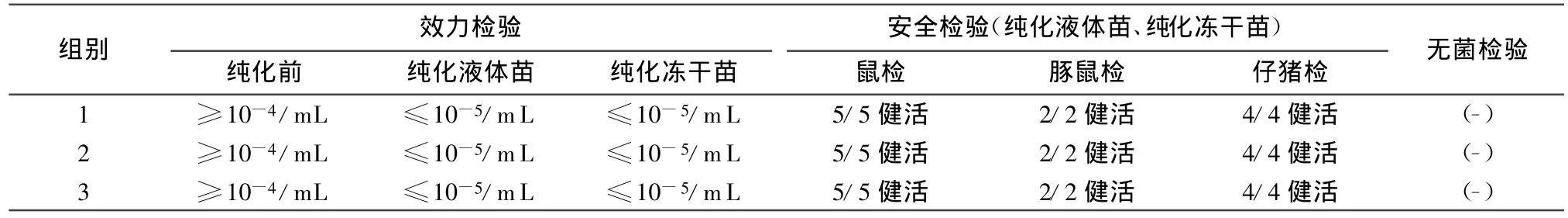
表2 純化濃縮的豬瘟疫苗病毒液凍干前后效力檢驗、安全檢驗結果
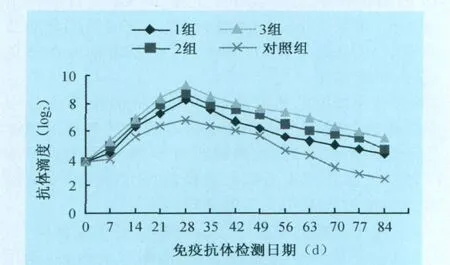
圖1 抗體消長曲線
3 討論
本試驗采用不同孔徑的微孔濾膜及不同分子量截留值的超濾膜組件,可連續進行雜蛋白的去除純化、濃縮、除菌操作。而結構完整的豬瘟病毒[9]粒子粒徑大小為34~50 nm,正好介于所選陶瓷(有機)膜孔徑之間。由結果證明:1組的0.80μm陶瓷膜濾除雜蛋白效果最差,為63.1%,免疫效果比2、3組差,但比常規苗好;2組的0.60μm陶瓷膜濾除雜蛋白效果較好,為71.3%,免疫效果介于1、3組之間;三組的0.45μm陶瓷膜濾除雜蛋白效果最好,為79.4%,免疫效果最好。
陶瓷(有機)膜純化與濃縮工藝可將效價不合格的豬瘟病毒培養液變成合格的疫苗,提高了疫苗的產量與經濟效益,而且純化濃縮的凍干活疫苗免疫效果顯著高于常規的凍干活疫苗免疫效果。從圖1的抗體曲線明顯看出,三組純化的凍干活疫苗免疫抗體效價上升快,抗體消長時間比普通常規的疫苗免疫抗體延長達3周左右,其中3組抗體消長效果最好,因為它的純度最高;1組抗體消長比2組、3組稍差,這說明疫苗的雜蛋白的含量干擾免疫抗體的消長變化。而常規的疫苗抗體消長效果大大低于三組純化的疫苗免疫效果,充分證明雜蛋白的含量對免疫的影響。
[1] 王金華.豬瘟疫苗注射變態反應1例[J].黑龍江畜牧獸醫,2002,3:58-59.
[2] 吳梧桐.生物制藥工藝學[M].2版.北京:中國醫藥科技出版社,2006:325-363.
[3] 姜平.獸醫生物制品學[M].2版.北京:中國農業出版社,2003:251-256.
[4] 中華人民共和國農業部.獸用生物制品質量標準[S].北京:中國農業科技出版社,2001:120.
[5] 李明義,劉志軍,徐太輝,等.豬瘟組織滅活疫苗與豬瘟弱毒凍干活疫苗免疫效力的比較[J].中國獸醫科技,2004,34(4):44-46.
[6] 李明義,白志娟,王莉娟,等.豬瘟滅活疫苗抗體消長規律動態研究[J].中國預防獸醫學報,2005,27(5):385-388.
[7] 沈紹新,戴愛玲,李曉華,等.IHA與 ELIS A檢測豬瘟病毒抗體的比較[J].動物醫學進展,2009,30(9):20-23.
[8] 周相華,韓喜連.豬瘟免疫接種抗體效價檢測試驗[J].中國動物檢疫,2006,23(7):35-36.
[9] 殷震,劉景華.動物病毒學[M].2版.北京:科學出版社,1997:304-323,652-664.

