運(yùn)用滲透性膨脹和超聲顯微成像彈性技術(shù)研究關(guān)節(jié)軟骨的力學(xué)特性
王青,鄭永平
1.香港理工大學(xué) 醫(yī)療科技及資訊學(xué)系,香港;2. 南方醫(yī)科大學(xué) 生物醫(yī)學(xué)工程學(xué)院,廣東 廣州 510515
運(yùn)用滲透性膨脹和超聲顯微成像彈性技術(shù)研究關(guān)節(jié)軟骨的力學(xué)特性
王青1,2,鄭永平1
1.香港理工大學(xué) 醫(yī)療科技及資訊學(xué)系,香港;2. 南方醫(yī)科大學(xué) 生物醫(yī)學(xué)工程學(xué)院,廣東 廣州 510515
關(guān)節(jié)軟骨是覆蓋在關(guān)節(jié)骨表面的重要承重組織,其結(jié)構(gòu)與成分的變化均會(huì)造成軟骨的退化,從而最終導(dǎo)致骨關(guān)節(jié)炎等疾病的發(fā)生,因此研究關(guān)節(jié)軟骨的力學(xué)性質(zhì)具有重要意義。該研究通過(guò)改變關(guān)節(jié)軟骨外溶液的離子濃度引起軟骨的滲透性膨脹行為,結(jié)合超聲顯微彈性成像技術(shù),依據(jù)超聲回波計(jì)算得到軟骨不同深度的位移變化量,繪制軟骨內(nèi)部組織彈性成像并預(yù)測(cè)了隨深度變化的軟骨軸向模量。該研究表明利用超聲顯微彈性成像技術(shù)可以有效觀測(cè)軟骨內(nèi)部由滲透壓力引起的膨脹行為, 并可以描述關(guān)節(jié)軟骨的力學(xué)性質(zhì),為研究關(guān)節(jié)軟骨早期病變提供一個(gè)有效可行的方法。
關(guān)節(jié)軟骨;滲透性膨脹;彈性成像;超聲顯微彈性成像
1 概論
關(guān)節(jié)軟骨是一種十分特殊的結(jié)締組織,覆蓋在活動(dòng)關(guān)節(jié)骨組織上,其表面光滑,可減小關(guān)節(jié)運(yùn)動(dòng)時(shí)的摩擦力,分散壓力負(fù)荷。關(guān)節(jié)軟骨的基質(zhì)主要由水、膠原與蛋白多糖組成[1-3]。膠原呈網(wǎng)架排列,決定軟骨的形狀和張力剪力特性;蛋白多糖多呈大分子聚合體狀態(tài);蛋白多糖和水使得軟骨富有彈性。研究發(fā)現(xiàn)蛋白多糖攜帶負(fù)電荷,吸引陽(yáng)性離子來(lái)保持其電中性[1-3]。因此,組織間隙內(nèi)產(chǎn)生膨脹壓力,膨脹壓力的大小主要由 Donnan 滲透壓決定,還受負(fù)電荷之間的靜電排斥力的影響[1-3]。同時(shí)膨脹壓力受到膠原纖維網(wǎng)架結(jié)構(gòu)的限制,蛋白多糖的彈性和膠原纖維的張力之間保持著平衡,這個(gè)平衡在維持關(guān)節(jié)軟骨的正常生物力學(xué)特性方面起到重要作用[3]。在骨關(guān)節(jié)炎等病變條件下,軟骨的結(jié)構(gòu)與組成發(fā)生改變,如水分的增加,蛋白多糖的解體,膠原網(wǎng)架結(jié)構(gòu)的破壞等,上述力平衡被打破 , 軟骨的生物力學(xué)特性亦隨之變化。過(guò)去的研究顯示,對(duì)關(guān)節(jié)軟骨膨脹效果的觀察與測(cè)量可以預(yù)測(cè)關(guān)節(jié)軟骨退化疾病[4-5]。
引起關(guān)節(jié)軟骨膨脹的常用方法是通過(guò)改變軟骨外溶液的離子濃度,產(chǎn)生滲透壓,從而破壞膨脹壓力與膠原纖維張力之間的力平衡。近來(lái)有研究者用光學(xué)方法描述關(guān)節(jié)軟骨的膨脹行為[5-8],雖取得較好結(jié)果,但光學(xué)方法只能觀察軟骨樣品的外橫截面變化,卻無(wú)法觀察內(nèi)部變化。鄭永平等人研發(fā)的超聲顯微成像系統(tǒng)可實(shí)時(shí)觀測(cè)樣本內(nèi)部變化[9-10],不僅可以探測(cè)軟骨蛋白多糖與胰蛋白酶之間的相互作用[11-12],而且在研究軟骨隨深度變化的膨脹行為方面,取得了良好進(jìn)展[13-14]。
目前,超聲彈性成像成為臨床研究的熱點(diǎn)。超聲彈性成像的基本原理是對(duì)組織施加一個(gè)內(nèi)部(包括自身的)或外部的激勵(lì),組織內(nèi)部將產(chǎn)生位移或應(yīng)變分布方面的變化,利用超聲成像方法,結(jié)合數(shù)字信號(hào)/圖像處理技術(shù),估計(jì)出組織內(nèi)部的相應(yīng)情況,從而間接或直接反映組織內(nèi)部的彈性模量等力學(xué)屬性的差異。由于腫塊組織與正常軟組織有明顯的彈性系數(shù)(應(yīng)力/應(yīng)變)差異,它們對(duì)激勵(lì)產(chǎn)生不同響應(yīng),產(chǎn)生不同的位移和形變,因而超聲彈性成像技術(shù)在探測(cè)病變軟組織,如肝臟、前列腺、乳房等,取得了良好的效果[15-17]。結(jié)合軸向壓力與超聲顯微成像,鄭永平等人發(fā)展了二維高頻超聲顯微彈性成像系統(tǒng),成功獲得了關(guān)節(jié)軟骨的彈性圖像[18]。
本文通過(guò)調(diào)控軟骨外溶液離子濃度,引入滲透壓力,刺激軟骨發(fā)生膨脹,利用高頻超聲顯微彈性成像系統(tǒng),實(shí)時(shí)觀測(cè)軟骨內(nèi)部組織的變化,繪制彈性圖像,建立四參數(shù)三相模型估計(jì)軟骨不同深度的軸向模量。
2 方法
2.1 軟骨滲透性膨脹實(shí)驗(yàn)
關(guān)節(jié)軟骨樣品取自新鮮成年牛的膝蓋骨,放入 -20℃冰箱待用。實(shí)驗(yàn)開(kāi)始前,取出軟骨樣品,放在生理鹽水(0.15 mol/L 的氯化鈉溶液)中解凍 3 h。

圖1 滲透壓引起的軟骨膨脹行為的M模式超聲圖像
實(shí)驗(yàn)時(shí),圓柱形樣品的軟骨表面向上,軟骨下連接的骨組織向下,固定于容器底部的凹槽內(nèi)。容器中注入2mol/L 的氯化鈉溶液(高滲鹽水),液面漫過(guò)超聲換能器。軟骨表面與溶液接觸,周圍用橡皮泥膠黏住以防止溶液從側(cè)面滲入,目的在于模擬軟骨在體內(nèi)的狀態(tài),同時(shí)認(rèn)為軟骨只在一個(gè)方向(軸向)上膨脹,以便計(jì)算其單軸軸向彈性模量。觀測(cè)1h后,達(dá)平衡狀態(tài)。本實(shí)驗(yàn)選擇該狀態(tài)(軟骨外溶液為 2 mol/L 氯化鈉)為參考狀態(tài),在參考狀態(tài)下離子被有效屏蔽,膨脹效果可忽略不計(jì)[8,19]。平衡后,30 s 之內(nèi)迅速用 0.15 mol/L 氯化鈉溶液代替 2 mol/L 氯化鈉溶液。換液后,外溶液的離子濃度低于軟骨內(nèi)部的離子濃度,這種不平衡產(chǎn)生 Donnan 滲透壓[1],在滲透壓力的作用下,軟骨內(nèi)外離子流動(dòng),使得軟骨膨脹,1h之后軟骨接近一個(gè)新平衡狀態(tài)。圖1為軟骨膨脹的M模式超聲圖像。
2.2 超聲顯微彈性成像系統(tǒng)
超聲顯微彈性成像系統(tǒng)如圖2所示,包括、一個(gè)50MHz聚焦超聲換能器(Panametrics, Waltham, MA, USA,聚焦長(zhǎng)度 12.7 mm,超聲波束直徑為 0.1 mm)、一臺(tái)寬帶超聲脈沖發(fā) 射 接 收 器(5601A 型 , Panametrics, Waltham, MA, USA)、一塊由超聲脈沖發(fā)射接受器觸發(fā)的 500 MHz 八位數(shù)據(jù)采集卡(CompuScope 8500PCI 型 , Gage, Canada)、 一 套 電 機(jī) 驅(qū)動(dòng) 的 三 維 支 架 系 統(tǒng) (Parker Hannifin Corporation, Irvine, CA, USA)、一個(gè)實(shí)驗(yàn)平臺(tái)、一臺(tái)計(jì)算機(jī)和自行開(kāi)發(fā)的信號(hào)采集與處理軟件。盛放樣品的容器固定在實(shí)驗(yàn)平臺(tái)上,超聲換能器固定于三維支架系統(tǒng)的機(jī)械臂上。計(jì)算機(jī)控制機(jī)械臂三維運(yùn)動(dòng),可將換能器調(diào)置到軟骨樣品上方合適的位置,在膨脹實(shí)驗(yàn)中驅(qū)動(dòng)機(jī)械臂完成對(duì)樣品的掃描。
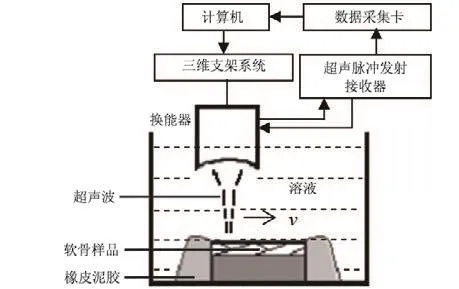
圖2 超聲顯微彈性成像系統(tǒng)組成框圖
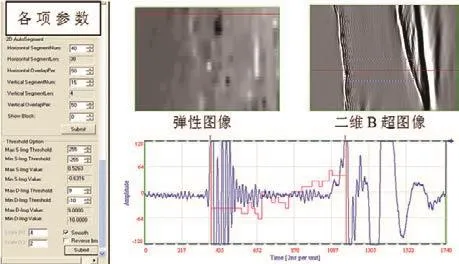
圖3 超聲顯微彈性成像系統(tǒng)的信號(hào)采集與處理軟件界面二維B超圖像中的虛線框?yàn)楦信d趣區(qū)域。
軟骨表面、組織內(nèi)部、及軟骨與骨的界面產(chǎn)生的超聲回波由超聲脈沖發(fā)射接收器接收放大后,經(jīng)數(shù)據(jù)采集板采集再存入計(jì)算機(jī)。通過(guò)信號(hào)采集與處理軟件,以一維超聲信號(hào)和二維超聲圖像實(shí)時(shí)觀測(cè)滲透壓引起的軟骨膨脹行為。計(jì)算軟骨內(nèi)部位移分布時(shí),在超聲圖像內(nèi)選擇感興趣區(qū)域,該區(qū)域又被劃分為 40×15 個(gè)子區(qū)域,兩幀圖像的時(shí)間間隔Δt 為 1.6 min,由信號(hào)采集與處理軟件自動(dòng)計(jì)算每塊子區(qū)域的位移值并繪制膨脹過(guò)程中軟骨內(nèi)部組織位移變化的分布圖。信號(hào)采集與處理軟件界面如圖3所示。
2.3 軟骨三相模型
1991 年 Lai WM 等人提出軟骨三相理論[20],三相理論認(rèn)為關(guān)節(jié)軟骨由膠原-蛋白多糖構(gòu)成的基質(zhì)固相、組織間液的液相、以及 Na+和 Ca2+等離子作為第三相組成。比較兩相理論(軟骨僅由固相和液相組成)[21],三相理論更全面地描述了軟骨的力學(xué)特性[19-20]。膨脹過(guò)程,滲透性負(fù)載與力學(xué)負(fù)載類似 , 可導(dǎo)致軟骨組織形變。基于三相理論,三相模型可以描述關(guān)節(jié)軟骨的材料屬性,提取軟骨的彈性模量[19,22]。
膨脹壓是關(guān)節(jié)軟骨總應(yīng)力的主要部分,與軟骨的成分、電荷及水的分布相關(guān)。研究顯示,蛋白多糖、膠原纖維、電荷密度和水分隨軟骨深度不均勻地分布[23]。因而,膨脹引起的應(yīng)變亦隨軟骨深度的變化而變化,建立軟骨三相模型時(shí)必須考慮這個(gè)不均勻性,才能準(zhǔn)確描述膨脹引起的應(yīng)變。我們建立了四參數(shù)三相模型[22],如圖4 所示。
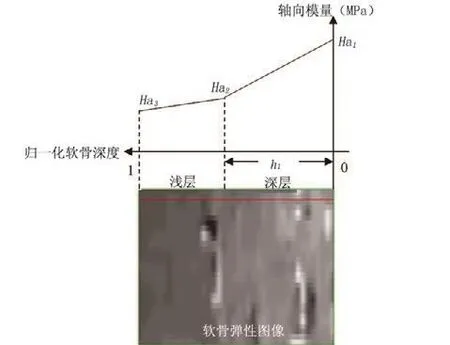
圖4 軟骨四參數(shù)三相模型
在模型中,軟骨分為兩層 : 第一層為軟骨深層,厚度(即分層位置)為h1,底部與骨組織相連,材料屬性主要由軸向模量Ha1,Ha2和泊松比νs三個(gè)參數(shù)確定,并假設(shè)從軟骨 -骨界面開(kāi)始到第一層和第二層的分界面之間,軸向模量從Ha1到Ha2線性變化 ; 第二層為軟骨淺層, 材料屬性由軸向模量Ha2,Ha3和泊松比νs 三個(gè)參數(shù)確定,同樣假設(shè)從第一層和第二層的分界面開(kāi)始到軟骨表面之間,軸向模量也是線性變化。由于考慮了中間分界面的軸向模量,從理論上說(shuō)該模型比單層模型更準(zhǔn)確描述軟骨。四個(gè)參數(shù)Ha1,Ha2,Ha3和h1結(jié)合軟骨的生化參數(shù)(固定電荷密度 C0F和水體積分?jǐn)?shù) φ0W),根據(jù)因離子濃度變化而引起的軟骨膨脹狀況,就可以描述軟骨的生物力學(xué)特性。
軟骨組織不同深度的膨脹位移量根據(jù)實(shí)時(shí)超聲回波信號(hào)運(yùn)用互相關(guān)跟蹤算法計(jì)算[13,22],得到應(yīng)變場(chǎng)。由于軟骨組織成分分布的不均勻性和軟骨的膨脹,超聲在關(guān)節(jié)軟骨中傳播速度的變化必須考慮。我們測(cè)定了始末時(shí)刻超聲在軟骨組織中的傳播速度,實(shí)驗(yàn)測(cè)量數(shù)據(jù)按照始末時(shí)刻差值的深度比例進(jìn)行了線性補(bǔ)償[22]。把實(shí)驗(yàn)計(jì)算的應(yīng)變數(shù)據(jù)作為模型的輸入數(shù)據(jù),預(yù)測(cè)得到關(guān)節(jié)軟骨樣品的軸向模量。
3 結(jié)果
根據(jù)超聲回波信號(hào),利用二維互相關(guān)跟蹤算法[18],計(jì)算出不同時(shí)刻的組織內(nèi)部因膨脹而引起的位移分布圖像,如圖5 所示。當(dāng)氯化鈉溶液的離子濃度從 2 mol/L 突然減少到 0.15 mol/L 時(shí),滲透壓使得組織產(chǎn)生較大變形,但隨著時(shí)間的延長(zhǎng)至約 10 min,可以看到內(nèi)部的形變減小,趨于平衡。
根據(jù)膨脹引起的位移分布,計(jì)算得到的軟骨樣品在不同深度的應(yīng)變量。根據(jù)四參數(shù)三相模型,預(yù)算得到由深到淺的三個(gè)軸向彈性模量參數(shù)Ha1,Ha2和Ha3,軟骨樣品的分層位置h1=0.7±0.2(軟骨厚度歸一化后的位置)。表1列出軟骨樣品在不同深度的力學(xué)屬性參數(shù)。

圖5 軟骨樣品的外溶液濃度從2 mol/L 減少到0.15 mol/L后,不同時(shí)刻的組織內(nèi)部因膨脹而引起的位移分布圖像

表1 四參數(shù)三相模型的預(yù)測(cè)結(jié)果 :軟骨組織不同深度的應(yīng)變量ε與軸向模量Ha
4 討論
關(guān)節(jié)軟骨的膨脹行為及力學(xué)特性的改變是關(guān)節(jié)炎初期的重要指征[2,5,24]。本研究通過(guò)滲透壓力引入軟骨的膨脹行為,運(yùn)用超聲顯微成像技術(shù),繪制出軟骨膨脹時(shí)內(nèi)部組織的動(dòng)態(tài)變化,建立四參數(shù)三相模型,研究關(guān)節(jié)軟骨的隨深度變化的彈性模量,更準(zhǔn)確地描述軟骨的力學(xué)特征。
與光學(xué)等其他方法[4-8]相比,超聲技術(shù)可以對(duì)組織內(nèi)部的變化進(jìn)行無(wú)損觀測(cè),使用實(shí)時(shí)二維超聲彈性成像技術(shù)成功地繪制出軟骨組織內(nèi)部變化情況[18]。而利用軟骨外溶液的離子濃度的變化引起滲透壓力,無(wú)需在樣品上施加額外壓力,因此該方法很適合小樣品的檢測(cè),而且將小型超聲轉(zhuǎn)換器裝在內(nèi)窺鏡上,則更有希望成為臨床軟骨病變檢測(cè)技術(shù)[13,25-26]。
Narmoneva 等人[5,6,8]認(rèn)為軟骨組織的材料屬性是隨深度變化而變化的 , 建立了三個(gè)參數(shù)的模型,雖然把淺層軟骨組織的軸向模量看作是線性變化的 , 但是卻把深層軟骨組織的模量看作是不變的。而過(guò)去的研究表明,軟骨的組織成分包括蛋白多糖、膠原纖維、電荷密度和水分均隨深度不均勻地分布[23]。本研究建立了四參數(shù)三相模型,假設(shè)深層軟骨組織的軸向模量亦為線性變化,由于增加了對(duì)中間分界面的軸向模量的估計(jì),因而從理論上講,與單相模型和三參數(shù)三相模型相比,該模型能更準(zhǔn)確地描述隨深度變化的軟骨組織的力學(xué)特征。這也說(shuō)明 , 運(yùn)用超聲顯微彈性成像技術(shù),基于滲透性膨脹建立關(guān)節(jié)軟骨的四參數(shù)三相模型,可以有效地以無(wú)損方式測(cè)量關(guān)節(jié)軟骨的材料屬性。
總之 , 超聲顯微彈性成像技術(shù)對(duì)關(guān)節(jié)軟骨膨脹行為、力學(xué)特征和材料屬性的估計(jì),對(duì)軟骨組織進(jìn)行性病變的研究,以及人工關(guān)節(jié)軟骨材料的研制都有重要意義。除此之外 ,該研究對(duì)于臨床骨關(guān)節(jié)炎的早期診斷具有潛在的應(yīng)用價(jià)值,對(duì)材料的多孔介質(zhì)力學(xué)研究以及其他相關(guān)領(lǐng)域的研究也具有借鑒意義。
[1]Mow VC, Gu WY, Chen FH. Structure and function of articular cartilage and meniscus [M]. Basic Orthopaedic Biomechanics and Mechano-Biology.3rd ed.Philadelphia: Lippincott Williams & Wilkins,2005:181- 258.
[2]Mow VC, Hung CT. Biomechanics of articular cartilage [M].editors. Basic biomechanics of the musculoskeletal system [M].3rd ed.Philadelphia:Lippincott Williams & Wilkins,2001: 67-107.
[3]王青,鄭永平.關(guān)節(jié)軟骨的生物力學(xué)特性[M].肌肉骨骼系統(tǒng)基礎(chǔ)生物力學(xué).第3版.北京:人民衛(wèi)生出版社,2008:41-67.
[4]Maroudas A. Balance between swelling pressure and collagen tension in normal and abnormal cartilage[J]. Nature,1976, 260(5554):808-809.
[5]Narmoneva DA, Cheung HS, Wang JY, et al.Altered swelling behavior of femoral cartilage following joint immobilization in a canine model [J]. Journal of Orthopaedic Research,2002,20: 83-91.
[6]Flahiff CM, Narmoneva DA, Huebner JL,et al.Osmotic loading to determine the intrinsic material properties of guinea pig knee cartilage [J]. Journal of Biomechanics,2002,35:1285-1290.
[7]Setton LA,Tohyama H,Mow VC.Swelling and curling behaviors of articular cartilage [J].Journal of Biomechanical Engineering,1998,120:355-361.
[8]Narmoneva DA,Wang JY,Setton LA.Nonuniform swellinginduced residual strains in articular cartilage [J]. Journal of Biomechanics,1999,32:401-408.
[9]Zheng YP, Ding CX, Bai J,et al.Measurement of the layered compressive properties of trypsin-treated articular cartilage: an ultrasound investigation[J]. Med Biol Eng Comput,2001,39: 534-541.
[10]Wang Q,Zheng YP.Non-contact evaluation of osmosisinduced shrinkage and swelling behavior of articular cartilage in situ using high-frequency ultrasound [J].Instrumentation Science & Technology,2006,34(3):317-334.
[11]Wang Q, Zheng YP, Qin L, et al. Real-time ultrasonic assessment of progressive proteoglycan depletion in articular cartilage [J]. Ultrasound in Medicine and Biology,2008,34(7): 1085-1092.
[12]Wang Q, Zheng YP. Ultrasound Biomicroscopy Imaging for Monitoring Progressive Trypsin Digestion and Inhibition in Articular Cartilage[J].Ultrasound in Medicine and Biology,2009,35(9):1535-1545.
[13]Zheng YP, Shi J, Qin L,et al.Dynamic depth-dependent osmotic swelling and solute diffusion in articular cartilage monitored using real-time ultrasound [J].Ultrasound in Medicine and Biology,2004,30(6):841-849.
[14]Wang Q, Zheng YP. Ultrasound measurement of swelling behaviors of articular cartilage in situ [M]. Biomechanical Systems Technology-Volume 1:Computational Methods.Singapore: World Scientific,2007:271-296.
[15]Chenot J, Melodelima D, N'djin WA, et al.Intra-operative ultrasound hand-held strain imaging for the visualization of ablations produced in the liver with a toroidal HIFU transducer: first in vivo results[J]. Physics in Medicine and Biology,2010,55(11):3131-3144.
[16]Tsutsumi M,Miyagawa T,Matsumura T,et al.Real-time balloon inflation elastography for prostate cancer detection and initial evaluation of clinicopathologic analysis[J].AJR Am J Roentgen ol,2010,194(6):W471-W476.
[17]Zhi H, Xiao XY, Yang HY,et al. Ultrasonic elastography in breast cancer diagnosis: strain ratio vs 5-point scale [J].Acad Radiol,2010,17(10):1227-1233.
[18]Zheng YP, Bridal SL, Shi J, et al.High resolution ultrasound elastomicroscopy imaging of soft tissues: System development and feasibility [J].Phys Med Biol,2004,49: 3925-3938.
[19]Narmoneva DA, Wang JY, Setton LA.A noncontacting method for material property determination for articular cartilage fromosmotic loading [J].Biophysical Journal,2001,81(6): 3066-3076.
[20]Lai WM, Hou JS, Mow VC. A triphasic theory for the swelling and deformation behaviors of articular cartilage [J].Journal of Biomechanical Engineering, 1991,113(3): 245-258.
[21]Mow VC, Kuer SC, Lai WM.Armstrong CG. Biphasic creep and stress relaxation of articular cartilage in compression: Theory and experiments[J].Journal of Biomechanical Engineering,1980,102: 73-84.
[22]Wang Q, Zheng YP, Niu HJ,et al.Extraction of mechanical properties of articular cartilage from osmotic swelling behavior monitored using high-frequency ultrasound[J].Journal of Biomechanical Engineering,2007,129(3): 413-422.
[23]Mow VC,Guo XE.Mechano-electrochemical properties of articular cartilage: their inhomogeneities and anisotropies [J]. Annual Review on Biomedical Engineering,2002,4:175-209.
[24]Wang Q, Zheng YP, Niu HJ. Changes in triphasic mechanical properties of proteoglycan-depleted articular cartilage extracted from osmotic swelling behavior monitored using high-frequency ultrasound[J]. Molecular and Cellular Biomechanics,2010,7(1):45-58.
[25]Huang YP, Zheng YP. Intravascular ultrasound (IVUS): a potential arthroscopic tool for quantitative assessment of articular cartilage[J]. The Open Biomedical Engineering Journal,2009,3:13-20.
[26]Hattori K, Takakura Y, Ishimura M,et al.Differential acoustic properties of early cartilage lesions in living human knee and ankle joints [J]. Arthritis & Rheumatism,2005,52(10): 3125-3131.
Study on Elasticity of Articular Cartilage using Osmosis-Induced Swelling and Ultrasound Elastomicroscopy
WANG Qing1,2, ZHENG Yong-ping11.Department of Health Technology and Informatics,The Hong Kong Polytechnic University,Hong Kong, China; 2. School of Biomedical Engineering, Southern Medical University, Guanzhou Guangdong 510515, China
Articular cartilage is important weight-bearing connective tissue covering the articulating bony ends in diarthrodial joints. The structural or component changes of articular cartilage induce degenerations of the tissue and consequently cause osteoarthritis (OA). In this study, we used osmosis loading to induce swelling behavior of articular cartilage and apply ultrasound elastomicroscropy to map the depth-dependent deformations in the tissue. The intrinsic layered material parameters of the articular cartilage were extracted using a triphasic model. Results showed that the ultrasound elastomicroscropy system could investigate the mechanical properties of articular cartilage associated with osmosis-induced swelling behavior of articular cartilage in a non-contact way. This method could be potential to assess the progressive degeneration of cartilage for the early diagnosis of OA.
articular cartilage; osmosis-induced swelling; elastography; ultrasound elastomicroscopy
R445.1
B
10.3969/j.issn.1674-1633.2011.01.004
1674-1633(2011)01-0013-04
2010-11-01
香港研究資助局和香港理工大學(xué)(PolyU5199/02E, PolyU 5245/03E, J-BB69)基金項(xiàng)目支持。
鄭永平,教授。
通訊作者郵箱:ypzheng@ieee.org

