1A型糖尿病預防的分子生物學機制
喬治
大部分但并非所有的1型糖尿病患者表現免疫介導的疾病形式,即T細胞介導的特異性β細胞破壞而致的1A型糖尿病。對NOD鼠模型的相關研究顯示,1型糖尿病發病的根本原因涉及種系編碼序列,由其形成的三分子復合物構成胰島素肽段B:9-23,此肽段由主要組織相容性復合物II(MHC)的I-Ag7 分子提呈,且能被具有特異性α鏈序列的T細胞受體識別。利用遺傳學檢查、自身抗體檢測及測量代謝性指標,現已能夠預測1A型糖尿病的發生。免疫治療可延遲β細胞破壞,但尚不能徹底預防β細胞破壞的發生。隨發病率的增加,估計約有100萬美國人患有或將發生1A型糖尿病,因此預防1A型糖尿病已成為重要的國際目標。為達此目標,需對現在尚處試驗階段的免疫療法進行不斷改善,以及進一步了解1型糖尿病發病機理中自身免疫性三分子復合物的作用。
1A型糖尿病患者既面臨著嚴重的糖尿病慢性并發癥,亦需面臨酮癥酸中毒、低血糖狀態等危及生命的急性并發癥。人們不斷研究嘗試多種治療途徑,試圖治愈疾病或至少顯著減輕1A型糖尿病給患者及其家屬帶來的沉重負擔。由于可提供血糖“實時”信息,對低血糖或明顯高血糖進行及時預警,持續血糖監測已改善了眾多1型糖尿病患者的生活質量。數個研究小組正致力于研究閉環胰島素泵,在發達國家,此類“智能”胰島素泵很有希望迅速成為胰島素依賴型糖尿病患者的標準治療。此外,胰腺移植(長期)及胰島移植(短期)可治愈1型糖尿病,但對于大多數病人而言,此類移植的免疫抑制治療相關風險不可接受。除異體免疫外,自身免疫也可能限制上述移植治療的效果。
1型糖尿病免疫相關領域發展迅速,相關出版物已有上千篇,本綜述重點關注的是一個相對簡單的假設,即自身免疫性1型糖尿病是慢性T細胞效應所致特異性β細胞破壞的結果,而這種靶向效應的主要分子決定因子固定于基因組內。
盡管存在明顯的表型差異,在分子水平上NOD鼠與1型糖尿病患者間存在驚人的相似。本文將首先探討NOD鼠的疾病發病機制(相對易于證誤),而后討論1型糖尿病患者的發病機制,最后對相關臨床試驗的進展情況進行總結。我們相信NOD鼠1型糖尿病的根本病因是基因組的三個編碼序列,如圖1所示。我們認為相關的序列是:胰島素肽段B:9-23序列;易感MHC I-Ag7序列;T細胞受體(TCR)特異性Vα序列。
自身免疫性三分子復合物
B:9-23胰島素肽段
NOD鼠糖尿病發生必需的三分子復合物的第一個組分是胰島素的一段肽段,即氨基酸9-23。越來越多的證據顯示,針對胰島素的自身免疫反應是NOD鼠1A型糖尿病發病機制的中心。Daniel等成功克隆來自NOD鼠胰島的T細胞,他們的實驗成果對于確定作用于胰島素的T細胞在1A型糖尿病發病過程中發揮作用極其重要。他們發現絕大多數CD4 T細胞克隆起源于對胰島素有反應的胰島,且在那些對胰島素有反應的胰島中,由B:9-23肽段刺激者超過90%。這些T細胞克隆能夠加速NOD鼠的糖尿病發展,其中一些亞群還能在免疫缺乏小鼠中誘導糖尿病。T細胞克隆及針對胰島自身抗體的轉基因TCR能夠導致或預防糖尿病。在本文中,盡管我們著重討論的是CD4 T細胞,但CD8 T細胞,包括作用于胰島素B15-23序列的T細胞,同樣具有非常重要的作用。II類等位基因(可能為CD4 T細胞)在決定人類及動物模型患糖尿病的風險方面起決定作用。
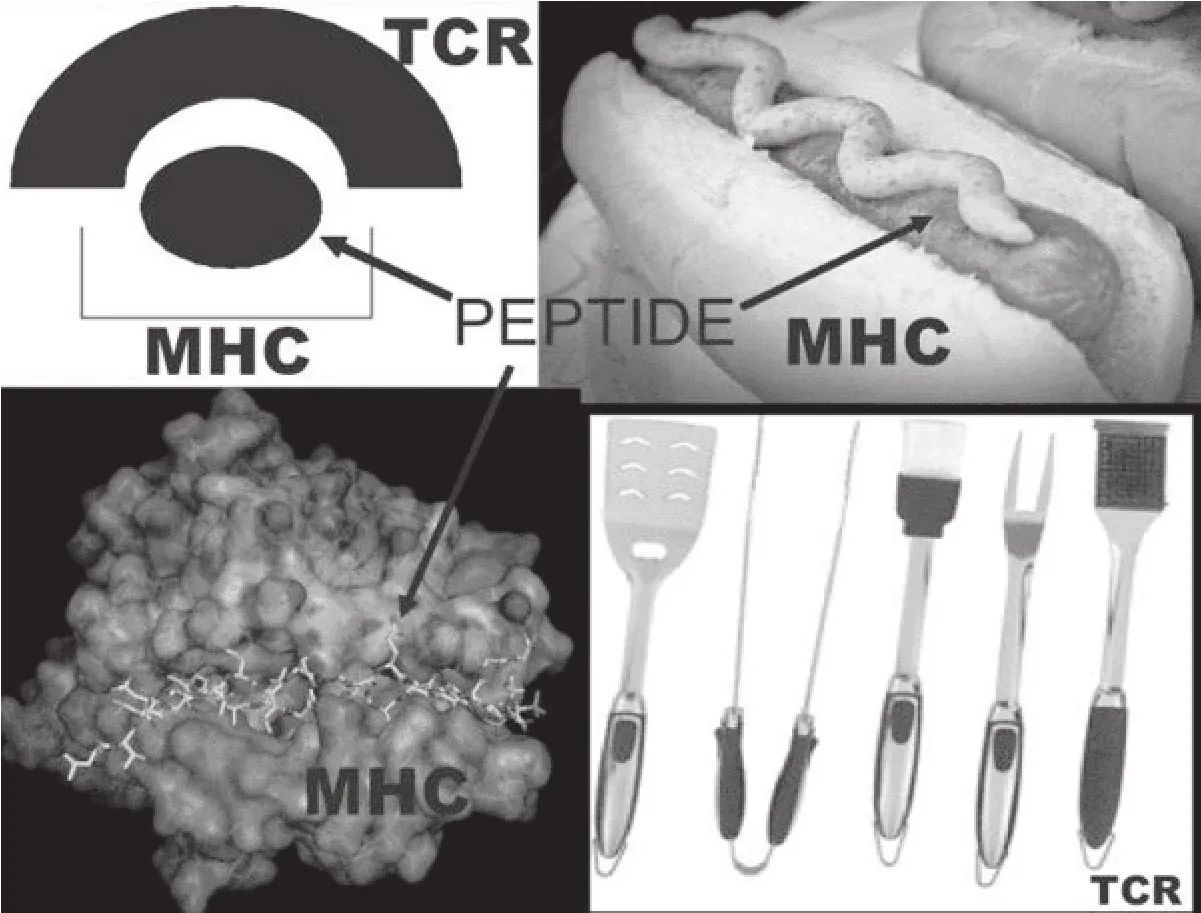
圖1 NOD鼠II類表達分子的始動致病性三分子復合物:I-Ag7/胰島素肽氨基酸B鏈9-23/具TRAV5D-4*04的TCR
鼠類有兩個胰島素基因。去除胰島素基因1可在90%的NOD鼠中預防糖尿病的發生;去除胰島素基因2則急劇加速糖尿病的發展。兩個胰島素基因在胰島均有表達,但胸腺僅有胰島素基因2表達。胸腺上皮細胞分泌的小劑量胰島素誘導的免疫耐受效應或許是NOD鼠胰島素基因敲除細胞株具不同表型的原因。然而,刪除其他自身抗原基因如GAD65,IGRP,IA-2,IA-2beta等,并不會改變NOD鼠糖尿病進程。
為了測試以胰島素為靶向目標是否為糖尿病發展所必須,我們聯合敲除胰島素基因1及胰島素基因2。為預防代謝性糖尿病在雙重胰島素基因敲除者中的發生,我們將一個具有變異胰島素B:9-23肽段的前胰島素基因轉入受試對象。之所以選擇這種特殊的變異,是因為Daniel等培養的抗B:9-23T細胞克隆不是由這種突變肽段刺激而來。僅有變異胰島素基因的NOD鼠不發生糖尿病,不表達胰島素自身抗體,亦不發生胰島炎,雖然針對胰島自身反應及胰島炎癥反應的保護作用并不完全。通過移植具正常胰島素基因序列的胰島、以天然B:9-23肽段免疫、或轉導天然胰島素基因替代缺乏的天然胰島素基因序列可恢復胰島素自身抗體的生成。這些后續研究性質復雜,因為雖然移植的胰島具有天然胰島素基因,但胰腺內源性胰島并不具備此類基因。為了證明將表達天然B:9-23基因的胰島移植至雙重基因敲除的小鼠可誘導糖尿病的發生,研究者將小鼠胰島細胞轉輸入一只胰島表達天然B:9-23基因的免疫缺乏小鼠。引人注意的是,被移植至腎被膜下方的表達天然B:9-23基因序列的胰島在4周后誘導了胰島素自身抗體生成,說明特異解剖學位置(例如胰腺)或胰島素B:9-23肽段的表達皆非糖尿病發展所必需。
考慮到NOD鼠T細胞可識別的胰島自身抗體數量,抗原識別等級成為重要問題。許多研究者證明誘導對胰島素“隱性”免疫耐受的技術可預防糖尿病。Krishnamurthy等的近期研究揭示,對胰島素的免疫反應是對主要胰島自身抗原IGRP的免疫反應的“上游”效應。值得注意的是,盡管IGRP CD8反應性T細胞在NOD鼠模型中作用突出,為誘導胰島素耐受而引進的具I-E-啟動子驅動的胰島素原的小鼠不生成IGRP反應性T細胞。即使是以IGRP為靶目標的、對胰島素反應被阻斷的TCR轉基因小鼠,也并不自行發生糖尿病。因此,對于IGRP的免疫反應是針對胰島素原的免疫反應的下游效應,且并非糖尿病病程進展所必需。現階段尚無法回答,針對除胰島素之外的所有胰島自身抗原的反應是否為疾病進展所必需,因為數種重要的自身反應性T細胞克隆的目標抗原未知,或尚未在NOD鼠中進行相關基因敲除實驗。(例如chromagranin,BDC2.5T細胞的靶抗原)
基因敲除實驗說明特異性胰島自身抗原無關鍵作用,但這并不能排除這些自身抗原在分子間表位擴散后具有重要作用的可能性。檢測此類自身抗原或針對此類自身抗原的T細胞反應可能對糖尿病預測有重要意義,且用此類抗原進行免疫治療可能能夠誘導顯性免疫耐受。一旦NOD鼠已發生糖尿病,僅具有B16:A突變的胰島素基因序列的胰島移植物迅速被破壞。這說明一旦自身免疫反應開始,針對非胰島素分子的抗胰島自免反應已足夠破壞胰島,或者在移植物所處環境中對B16:A序列的識別改變了抗原表位,這足以導致β細胞被破壞。值得注意的是,與移植胰島不同,具變異B16:A序列的胰腺內胰島能夠抵抗從致病性NOD鼠獲得的細胞轉移所致破壞。這說明在存在抗原表位擴散的情況下,雖然無法起到完全的保護性作用,B:9-23基因序列的缺乏仍具重要作用。
至今為止,基因敲除試驗只能通過敲除胰島素基因以影響糖尿病的發展。與之不同,眾多的胰島自身抗原及其相關多肽能被用于多種途徑來預防NOD鼠的糖尿病進展。這些對糖尿病的顯著抑制作用通常是通過提高調節性T細胞功能而達到的。有證據表明,調節性CD4,CD8甚至B淋巴細胞在影響糖尿病發展中發揮作用。通過鼻腔給藥或皮下注射(特別是以完全弗氏佐劑為溶液)胰島素B:9-23肽段,可預防糖尿病。值得注意的是,皮下注射胰島素B:9-23肽段可能通過激活CD4 T細胞誘導胰島素自身抗體生成,這些抗體結合于胰島素而非免疫性肽段。即使是正常的Balb/c小鼠對胰島素B:9-23肽段亦產生上述反應。在有合適的II類分子(如,NOD鼠的I-Ag7或Balb/c鼠的I-Ad,二者具有相同的I-A α鏈序列)存在的情況下,肽段誘導胰島素自身抗體產生,其機制可能是抗B:9-23 CD4T細胞被活化。雖然胰島自身抗體被誘導生成,除非固有免疫系統被激活(例如,通過注射多聚-IC),否則不會產生胰島炎。
I-Ag7
鼠類動物的CD4 T細胞的TCR可識別表達于II類抗原提呈分子家族的I-E及I-A分子表面溝槽內的目標肽段,而CD8 T細胞可識別表達于I類抗原提呈分子家族的K、D分子表面溝槽內的目標肽段。人類中相應的分子是DQ(對應I-A)、DR(對應I-E)、HLA-A,-B,-C(對應K、D)。上述抗原提呈分子具有高度多態性。圍繞溝槽的氨基酸序列與肽段結合,從而決定免疫反應的靶向目標。在人類及1型糖尿病的鼠類模型中,II類分子對于NOD鼠糖尿病發生起著重要作用。基因效應非常巨大,僅8只糖尿病小鼠即可證明。這些糖尿病小鼠均具有純合的NOD特異性主要組織相容性區域(表達I-Ag7不表I-E),這8只小鼠為NOD鼠和正常對照小鼠的雜交后代。II類分子可能通過改變TCR譜以及提高T細胞識別特異性肽段的能力而發揮作用。特殊的是,I-Ag7分子及人類DR4相關DQ8分子、DR3相關DQ2分子均具有特別的結合袋9,這種結構缺乏天冬氨酸。相關假設推測,這種天冬氨酸的缺乏有利于自身抗原性肽段的呈遞,此類肽段具剩余電荷,能夠與特殊的結合袋9結構相結合。然而,近期與Kappler實驗室合作的研究有相反發現,即為致病性TCR識別的B:9-23肽段在另一個低親和力區識別肽段。胰島素在鼠類及人類的胸腺由特殊胸腺上皮細胞產生,且能導致胰島素反應性T細胞的清除。可能胸腺內具有以B:9-23為靶向目標的TCR的T細胞很少在低親和力區遭遇肽段,故得以逃避中樞(如胸腺)免疫刪除。這些逃避了中樞免疫刪除的T細胞隨后在胰腺內極高胰島素濃度環境下,即可破壞胰島β細胞。
具有TRAV5D-4*04α鏈片段的TCR
三分子復合物的第三個組分是由α鏈及β鏈組成的TCR. 由基因片段的隨機選擇及重組,形成了數十億種獨特的TCR。TCR的最終構象類似具6個指狀結構(互補決定域/CDR)的長管,其中三個CDR由α鏈提供,其余三個CDR由β鏈提供。正是這些指狀結構與MHC多肽結合,繼之活化具TCR的T細胞。經典的對目標肽段的識別通常需要所有CDR共同參與,其中,CDR3一般占主導地位。CDR1與CDR2由基因組編碼,同時具有Vα和VβTCR片段。與之不同,CDR3的α鏈由隨機結合的Vα及Jα基因片段的交界處編碼,其β鏈由V,D,J的交界處編碼。此外,結合并不精確,可能出現核苷酸的增加或丟失,引起CDR3序列的變異。
考慮到I-Ag7的獨特性及B:9-23肽段與自身免疫性糖尿病發病相關,或許,NOD鼠的抗B:9-23肽段TCR可能具有異常。對Wegmann等發現的TCR克隆來源的TCR進行測序,結果顯示其中大部分具有特異性的Vα片段,該片段被稱為TRAV5D-4*04(注:每一種獨特的Vα片段都被賦予相應的數字編號)。意外的是,CDR3的N端及TCRβ鏈不具保守性。故我們認為,如果我們建造小鼠模型,使其表達保守的Vα鏈,同時不限制其β鏈,允許其形成多種不同的β鏈,則可能誘導胰島自身免疫反應的發生。通過采用Vignali等發明的技術,我們建立了具多種不同α鏈序列(包括TRAV5D-4*04)的轉基因及逆基因小鼠模型。絕大部分的小鼠體內產生了胰島素自身抗體,其中的部分小鼠發生了糖尿病。通過從此類小鼠獲得融合TCR,我們估計每100個具包含抗B:9-23α鏈的TRAV5D-4*04片段的TCR中有1個與B:9-23發生反應。
以胰島素為目標的三分子復合物中的兩個組分為多種(TRAV5Dα鏈序列)或所有(胰島素B:9-23序列)鼠類品系共有。換而言之,具I-Ag7是NOD鼠的一種獨特屬性。其他與維持免疫耐受狀態或環境因素(或缺乏保護性環境因素如特定病毒感染)有關的遺傳多態性影響自身免疫的激活。考慮到能以B:9-23肽段為目標的T細胞數目可能極大,我們認為NOD鼠β細胞與免疫系統間的互相作用與蜂群相似。一旦免疫耐受狀態被打破,眾多共享TCR的共同特征T細胞處于以胰島素為目標的預備狀態中。
上述假設尚未接受一系列關鍵的測試。例如,一個重要的預測是:敲除TRAV-5D-4*04基因片段可預防糖尿病及胰島素自身抗體產生,類似于B:9-23胰島素肽段突變的效果。除了在基因方面反駁共有的Vα序列非常關鍵的假設,人們也在積極探索能特異性阻斷上述三分子復合物的治療手段。
我們正通過兩種途徑對以NOD鼠三分子復合物為目標的治療進行研究。Ostrov利用DOCKING程序對NCI圖書館內為藥物實驗設計的140,000個候選分子進行篩選,從而確定了一系列小分子。我們與他合作,確定了能夠調節抗B:9-23TCR信號的小分子(A Michels,數據尚未發表)。我們認為與I-Ag7的特殊袋狀結構結合的小分子家族既能增強亦能抑制TCR對于B:9-23肽段的反應,還可以改變NOD鼠中占主導地位的TRAV5D-4*04B:9-23T細胞的特異性細胞因子反應。
此外,我們發現相關證據,證明識別B:9-23肽段的抗體在I-Ag7的溝槽結構結合,能夠阻止體外實驗中B:9-23肽段的表達(L Zhang,數據尚未發表)。在此基礎上,誘導此類具疾病預防能力的抗體生成的實驗即將進行。
人類1型糖尿病的階段劃分
1986年,我們建立了一個1A型糖尿病的慢性自身免疫發展過程的模型,將疾病的發病機理劃分為一系列的階段(圖2)。至今仍無相關技術能夠直接評定β細胞量,因此,關于復發-緩解疾病進程是否與β細胞破壞有關以及一些患者的β細胞破壞是否是急性過程的討論一直存在。在上述模型中,考慮到不同個體異質性,圖2 的X軸沒有強調精確的時點。不同個體以不同速度向顯性糖尿病進展,同卵雙生子之一發生糖尿病與其同胞出現胰島自身抗體之間的時間可以相差數十年。通過多個研究及疾病預防實驗,我們發現有可能預測1A型糖尿病的發生,這個可能性在此模型中得到強調。
第1階段 遺傳易感性
盡管1A型糖尿病通常受多基因遺傳影響,有兩種十分罕見的與糖尿病相關的自身免疫反應綜合征屬于“單基因”遺傳范疇:APS-1(1型自身免疫性多內分泌腺病綜合征),IPEX綜合征(免疫失調,多內分泌病變,腸下垂,X連鎖)。
IPEX綜合征由FoxP3基因突變引起,此轉錄因子對調節性T細胞發展起重要作用。缺乏FoxP3的患兒將發生超強的自身免疫反應,且約80%患兒會發生1型糖尿病。糖尿病癥狀可在患兒出生后數天內即顯現。此綜合征充分證明了調節性T細胞的重要性,除非致病性T細胞受到控制,否則大多數人都可能發生1型糖尿病。對于被診斷為此種致命性自身免疫綜合征的患兒,可考慮進行骨髓移植,以提供調節性T細胞。另一種正在探索中的可能療法是培養表達FoxP3、具調節能力的抗原特異性T細胞株。
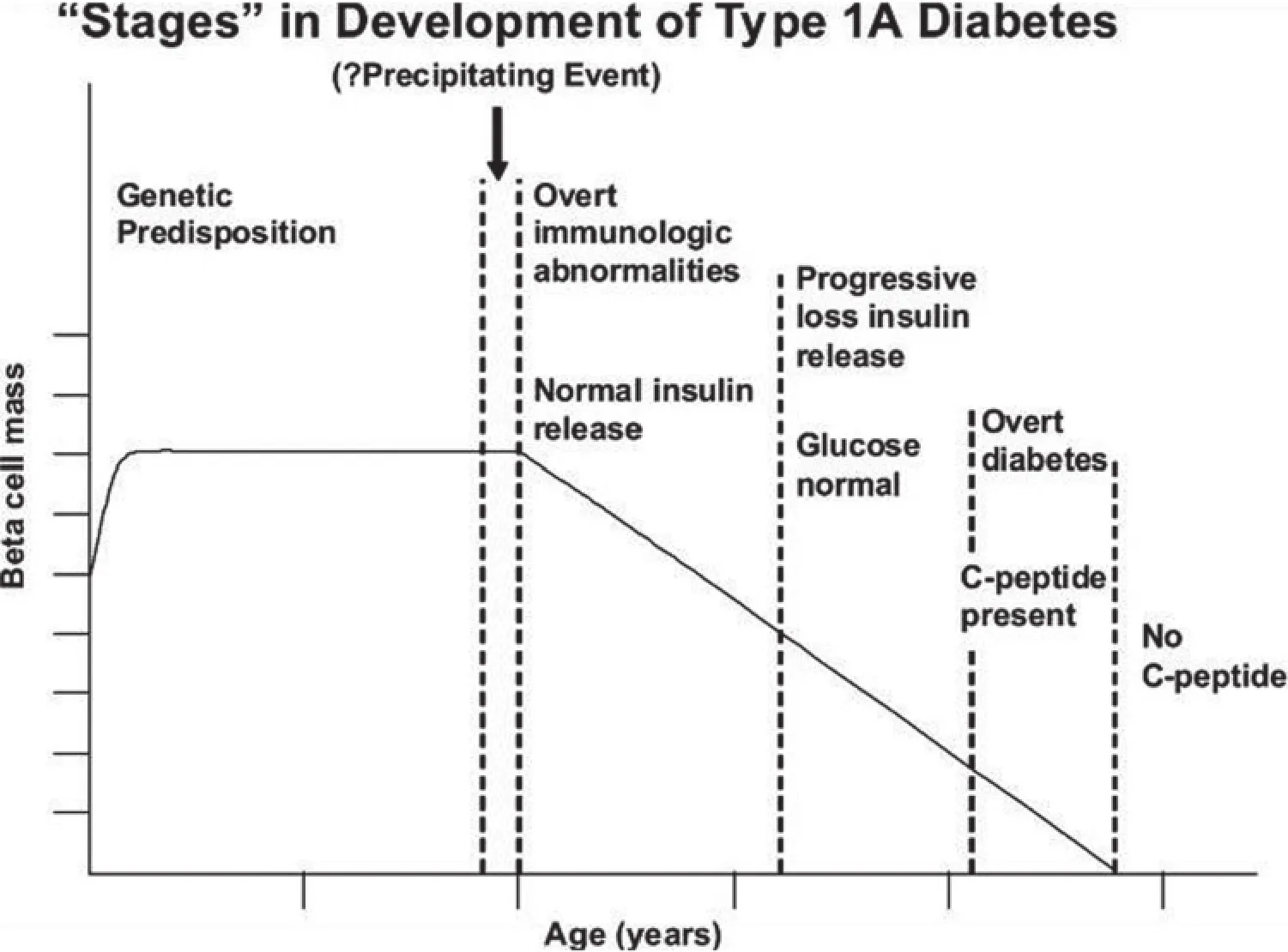
圖2 強調疾病慢性進展屬性的1A型糖尿病發展進程模型。
APS-1較IPEX綜合征常見,且在少數種群(如伊朗人群、猶太人群)中發病率稍高,但總體來說仍十分罕見。APS-1的特征是粘膜念珠菌病、Addison氏病及甲狀旁腺功能低下,其病因為AIRE(自身免疫反應調節者)基因突變。此病通常以常染色體隱性方式遺傳,然而亦有一個存在顯性突變的家族被報導,且兩種遺傳方式的動物模型均已建立。AIRE基因對于增強如胰島素等外周抗原在胸腺髓質上皮細胞內的表達起重要作用。少量“外周”(如胸腺外)抗原如胰島素及胸腺內表達的抗原與自身反應性T細胞的陰性選擇及避免自身免疫反應有關。APS-1患者逐漸發生一系列自身免疫失調,且比特定疾病表達更多的自身抗體。值得注意的是,據報導,所有APS-1患者均具有針對干擾素α的自身抗體。約18%的APS-1患者發生1型糖尿病,其糖尿病的發展受保護性HLA等位基因DQB1*0602及胰島素基因多態性的影響。
總之,上述兩種綜合征是自身免疫性糖尿病遺傳因素起決定作用的極端例子,證明一個或兩個維持免疫耐受狀態所必需的通路被打破將導致疾病的發生。當控制免疫耐受的基因突變程度超過維持避免自身免疫反應發生的正常多基因狀態時,人們易于發生1型糖尿病。
APS-2綜合征較APS-1綜合征更常見。APS-2綜合征的臨床特征是同一個體發生多種自身免疫失調(如1A型糖尿病,Addison氏病,甲狀腺炎,腹腔疾病等)。它復雜的遺傳機制類似1A型糖尿病,但與之不完全相同。特別是,Addison氏病的最高危HLA基因型(DR3/4-DQ2/8)為DRB1*0404而非DRB1*0401或DQB1*0302。患1A型糖尿病的病人發生APS-2的一系列自身免疫失調的可能性增加,特別是Addison氏病、腹腔疾病、甲狀腺自身免疫反應以及惡性貧血。我們通過一系列測試對1型糖尿病患者進行常規篩查,目的是排除相關聯的針對腎上腺、小腸、甲狀腺的自身免疫反應,這些檢查包括:通過檢測21羥化酶抗體檢查Addison氏病(陽性率1.5%),通過檢測轉谷氨酰胺酶抗體檢查腹腔疾病(陽性率10%),通過檢測TSH檢查甲狀腺疾病。在診斷為1型糖尿病1年內,約三分之一的病人已經有一種或多種針對其他靶器官的自身抗體表達。
1A型糖尿病已經成為研究的最透徹的復雜遺傳性疾病之一。大約每300個美國公民中有1人患有1A型糖尿病,而約每20個糖尿病患者1級親屬中就有1人患1A型糖尿病。我們還觀察到,父親為1型糖尿病患者的兄弟姊妹及后代患1型糖尿病的風險高于母親為1型糖尿病患者的后代。經過長期隨訪發現,大多數1型糖尿病患者的同卵雙生子發生胰島自身免疫反應(>70%)與糖尿病(>60%)。同卵雙生子的兩人發生糖尿病的時間可相差30年。然而,異卵雙生子發生糖尿病的風險與兄弟姊妹沒有區別,約為5%。
如上所述,盡管存在很強的遺傳傾向,絕大多數(>90%)1A型糖尿病患者不具有患糖尿病的一級親屬。雖然40%丹佛市人群攜帶高危HLA等位基因DR3或DR4,其中僅有2.4%的人口攜帶最高危基因型,即DR3與DR4,且這種雜合子個體占青少年糖尿病患者的30%。因此,在總人群中易感等位基因攜帶率較高的情況下,從父母雙親遺傳得來HLA基因型對于1型糖尿病的發展非常重要。
與NOD鼠模型相似,1A型糖尿病的主要基因決定因素是II類MHC基因DQ、DR和DP(依此順序)的多態性。最高危基因表型由1個DRB1*0301-DQA1*0501-DQB1*0201單倍體型和另一個DR4單倍體型(DRB1*0401-DQA1*0301-DQB1*0302,簡記為DR3/4-DQ2/8)構成。約30%~50%患1A型糖尿病的患兒攜帶這種基因表型(注:患者發病年齡越輕,攜帶此基因表型的可能性越大)。在總人群中攜帶此基因表型者患1A型糖尿病的絕對風險約為5%。DRB1*0403等位基因降低DR4單倍體型攜帶者的患病風險,一些DP等位基因也能改變風險(如DPB1*0402)。此外,有數種HLA等位基因具有極強的保護作用。DQB1*0602的保護作用尤其明顯,總人口中約20%攜帶此等位基因,但僅1%的1A型糖尿病患者攜帶該等位基因。
由Marian等牽頭的DAISY研究,測試了科羅拉多州丹佛市超過30,000名新生兒的HLA表型,繼之對總體中超過1,000名攜帶HLA高危基因的患兒及1,000名HLA無關的一級親屬進行隨訪。1型糖尿病患者的同胞患病率是患者后代的數倍,盡管患者的同胞及后代均有與先證者相同的一半基因組。可能有多個遺傳及環境因素共同造成同胞患病率較高,但最簡單的解釋是MHC內基因表現其他多態性而增加特定單倍體型的風險。攜帶兩個與先證者同胞相同的HLA單倍體型的DR3/4-DQ2/8同胞,與只攜帶一個/或不攜帶與先證者同胞相同的HLA單倍體型的DR3/4-DQ2/8同胞相比,具有極高的糖尿病患病風險。這一現象說明了上述解釋的可能性。DAISY研究中此類同胞的胰島自身免疫反應被激活的風險高達70%,且此類同胞占了DAISY研究中所有進展為胰島自身免疫及稍后的糖尿病狀態患兒中的大部分。在DAISY研究中,通過對DR,DQ及DP的分型,可確定總人群中約有20%的高危人群。然而,占總人口約20%的DR3/DR4雜合子個體的患病風險遠低于約占70%的與先證者具相同DR3/4表型的個體,這意味著MHC中尚存額外的基因多態性有待發掘。我們找到相關證據表明其中一個位點位于MHC端粒酶端,且特定的HLA I類等位基因與此風險有關,特別是表達于2%~4%患者中的HLA-B39。另外,HLA-A24與早發性1A型糖尿病相關。值得注意的是,HLA B39的表達可增加DR8單倍體型的患病風險。
考慮到MHC數百萬的堿基對的多個幾乎完全保守的單倍體型(其中兩個最為大家熟知的保守單倍體型為HLA-A1,B8,DR3單體型及HLA-A30,B18,DR3“Basque”單體型),尋找MHC中的那些非HLA疾病決定因子十分困難。“Basque”單體型較A1,BB,DR3單體型風險更高,盡管兩種單體型的DR和DQ等位基因序列相同。考慮到兩種單體型均具DR3,二者的糖尿病罹患風險均升高。
因為一些特定的HLA等位基因可提供巨大的保護作用,人們開始考慮是否此類等位基因能夠運用于糖尿病治療或家庭計劃中。這些具保護作用且決定患病風險的等位基因可能是決定以哪些特定自身分子結構為靶向的“正常”HLA等位基因。例如,對1A型糖尿病具保護作用的DR2-DQB1*0602單倍體型是多發性硬化的最高危單體型。
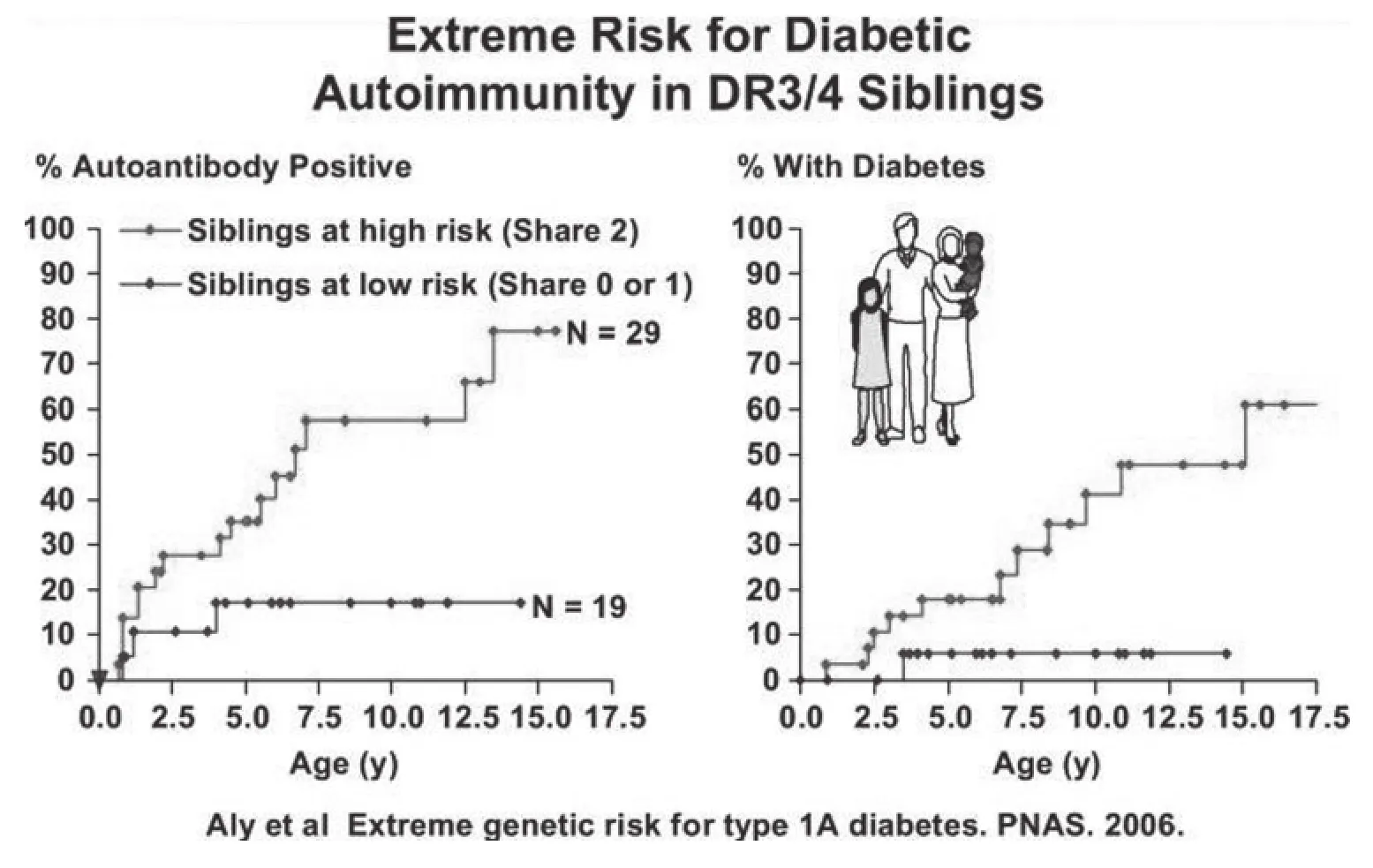
圖3 與先證者同胞兩個單倍體型均相同的、攜帶DR3/4-DQ2/DQ8等位基因的同胞發生胰島自身免疫及糖尿病所處極限風險
人們現已在識別與遺傳風險有關的非MHC位點方面取得了較大進展,超過40個位點已得以確認。但多數此類遺傳位點的優勢比(OR值)小于1.2(注:OR值為1.0意味無風險,MHC的OR值>6),其總和影響遠小于MHC對糖尿病的影響。繼MHC之后,下一個最重要的位點是胰島素基因。胰島素基因一個序列的5’端的保護性多態性增加胸腺胰島素的表達,降低糖尿病風險,而這可能是通過增加胸腺內對以胰島素為靶向目標的T細胞的刪除實現的。
PTPN22基因是第三個重要的基因位點。一個氨基酸(R640W)的改變即可增加糖尿病的發病風險,其OR值約為2。PTPN22基因編碼的分子(lyp)是一種淋巴細胞特異性酪氨酸磷酸化酶,與疾病相關的多態性增加對TCR信號通路的抑制,可能是通過功能獲得機制實現。這種功能獲得究竟如何影響糖尿病發病風險尚不清楚,但主流假設是它可以減少胸腺內T細胞的陰性選擇。另外,亦有許多特定的基因包括CTLA4、CCR5、IL2受體及許多包含一個或多個潛在相關基因的位點被發現。一種與干擾素信號通路相關的解旋酶(IFIh1)有幾個少見的變異,這些變異與患病風險相關,也與單核苷酸多態性相關。似乎所有已確認的位點均通過作用于免疫系統而影響糖尿病患病風險。有趣的是,與2型糖尿病相關的基因多態性基本對1型糖尿病的發展無影響,盡管也有報導稱TCF7L2基因多態性與成人隱匿性自身免疫性糖尿病相關聯。總的來說,1A型糖尿病與2型糖尿病的遺傳學機制可能不同,1A型糖尿病主要是一種免疫介導的疾病。
關于與1型糖尿病風險相關的罕見基因變異的研究幾乎還未起步,但可能存在多個這樣的變異。此外,MHC的單個或多個位點尚有待研究,其中的一些位點可能能夠調節疾病風險,且其調節能力可能遠超已發現的MHC外的共同變異的調節作用。多個共同通路引起對1型糖尿病的易感性,包括以多肽抗原(I類和II類HLA)為靶向的T細胞;以胰島素原/胰島素為靶向的T細胞,特別是TCR信號通路(例如PTPN22,CTLA4);免疫耐受機制維持(例如,foxP3、AIRE)以及新生兒免疫反應(例如IFIh1)。現在已經可以識別與已知HLA基因型/單體型相關的1A型糖尿病的高危或極高危個體,此外,胰島素位點及PTPN22對識別糖尿病高危個體亦有一定幫助。OR值小于1.2的位點的SNPs對于遺傳學預測無幫助,但很可能有助于闡明重要的發病機制。雖然可以通過HLA分析(如DR3/4雜合子)識別極高危個體,但他們僅構成不到一半的1A型糖尿病患者,且近50年來存在著DR3/4攜帶者中糖尿病患者比例下降的趨勢。應對總體人群中的高危個體進行與1型糖尿病患者家屬類似的預防性測試。這樣,如果將基因篩查與胰島自身抗體檢查相結合,有可能在糖尿病初發時即預防其發病、降低死亡率。
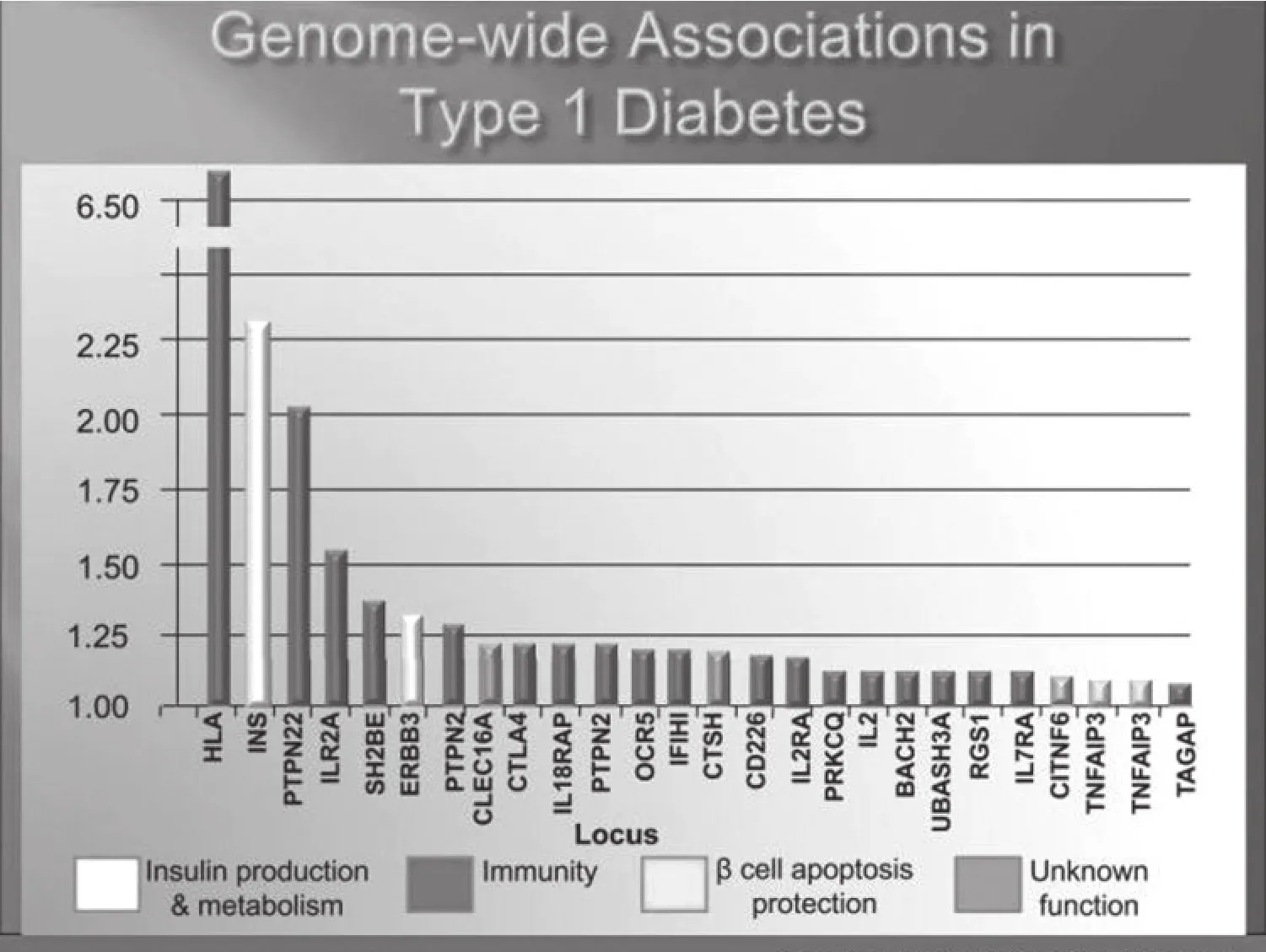
圖4 1型糖尿病的全基因組關聯性研究結果
第2階段:環境觸發
過去的20年間,我們獲得的關于環境因素對1型糖尿病影響的相關認識甚少。盡管如此,過去20年間西方國家1型糖尿病發病率成倍增長的事實,清楚的說明了環境方面的決定因素十分重要。發病率的增長速度如此之快,單純以人群基因變異已無法解釋。為此提出的一個重要假設是“衛生學”假設,即感染性疾病的減少導致多種免疫性疾病發病增加,包括哮喘和糖尿病。據報道,若將NOD鼠與BB鼠于無菌環境中飼養,其糖尿病發病情況發生改變。近期研究亦指出動物模型中的小腸內微生物群可調節糖尿病的發展。另一個假設提出,胰島素抵抗從某種程度上加速1型和2型糖尿病的發展速度,且盡管二者的MHC存在區別,但1型和2型糖尿病有相似的遺傳學病因。雖然與肥胖相關的胰島素抵抗可能通過降低胰島素分泌影響1型糖尿病進展,但近期的遺傳學分析不支持上述“衛生學”假說。
值得注意的是,一些藥物能誘導1A型糖尿病的發展。尤其值得注意的是,干擾素治療與動物模型中糖尿病發生相關,而對于人類,干擾素治療能誘發胰島素自身抗體產生、加速糖尿病進展、導致酮癥酸中毒。甲巰咪唑、青霉胺和硫辛酸(如含巰基藥物)能誘導自身抗體生成,且有時抗體滴度很高,足以對代謝產生影響(例如,胰島素自身免疫綜合征:與DRB1*0406相關的Hirata病)。
其他可能的環境影響因子包括飲食因素,有報道稱牛奶、早期引入谷類食物、ω-3脂肪酸水平降低及維生素D水平降低均影響糖尿病患病風險。目前,大規模實驗及前瞻性研究可以對這些假設進行嚴格的檢測。值得注意的是,代謝物組學及mRNA序列分析現均被用于識別抗胰島自身抗體出現前可能的異常狀態。因為此類方法需要分析多個參數指標,同時檢測上千個可能的指標,故可能產生許多假陽性結果,使重復性試驗變得至關重要。這既是此方法的優勢,同時又是潛在的缺點。
在發現1A型糖尿病為慢性免疫性疾病之前,有許多關于病毒感染誘導糖尿病的研究。因此,研究者們在患者糖尿病發病時尋找病毒感染的證據,包括研究糖尿病發病時死亡患者的胰腺。其中,研究最多的是先天性風疹病毒感染及腸道病毒感染,雖然現在尚無法確定其重要性。主要的困難是在糖尿病發生數年前誘導胰島自身免疫反應,以及觸發胰島自身免疫的病毒可能有多種、普遍存在于體內、在短時間內發揮作用。上述認識均來自于小鼠模型的病毒誘導的自身免疫性糖尿病的相關研究。
通過研究糖尿病抵抗性BB鼠模型,發現感染KRV可誘導糖尿病,人們獲得了1A型糖尿病的最佳動物模型。抗糖尿病性BB鼠作為正常對照鼠類而被培養,它們缺乏BB鼠類原始品系的淋巴細胞減少癥,而正是BB鼠的這一特征使其自發性發生糖尿病。一部分BB-DR鼠自發性發生糖尿病,隨后的研究發現這些小鼠被KRV病毒感染,于是人們發現KRV感染可誘導糖尿病發生。現在我們知道,多個具有相同II類MHC等位基因(如RT1-U)及特定TCR位點的的鼠類品系,在被數種不同病毒感染或以包括Toll樣受體(TLR)激動劑的免疫誘導劑刺激時,均可發生糖尿病(以不同疾病發展速度)。多聚IC是一種病毒RNA模擬物,也是TLR3的激動劑,給予在胰島β細胞表面表達B7分子的鼠類多聚IC,小鼠也發生糖尿病。在這個模型中,多聚IC誘導干擾素α生成。抗干擾素α的抗體阻斷糖尿病發展,而干擾素本身誘導糖尿病發生。KRV并不感染胰島β細胞,且只需短時間被呈遞即可誘導糖尿病。如果一種病毒可在人類中誘發糖尿病,那么,我們認為,依靠相對短時間內監視個體的急性感染與胰島自身抗體的最初表達可以發現這樣的病毒,且此種具誘導作用的病毒應該普遍存在于體內。
第3階段:活化的自身免疫
免疫細胞化學(ICA)試驗檢測一系列與多個已知自身抗原(除胰島素外)反應的自身抗體,且其結果對于確定靶向分子十分重要。對ICA試驗進行標準化及解釋試驗結果很困難,因為存在個體異質性,且試驗需要利用冰凍的人類胰腺組織作為酶作用物。
胰島自身抗體的表達是存在胰島自身免疫反應的最佳標志。現已確認四種主要的胰島自身抗原(即胰島素、GAD65、IA-2和Znt8),且國際學術研討會已證實檢測這些自身抗體的試驗的可靠性。ZnT8是最近被確認的自身抗原,它是胰島特異性鋅離子轉運體,在將鋅離子轉運至胰島素分泌顆粒的運輸中發揮作用。有趣的是,ZnT8的一個導致單個氨基酸改變的普遍多態性是抗ZnT8自身抗體的主要目標。攜帶特定ZnT8變異的純合子患者體內通常產生針對其本身基因組編碼的變異體的自身抗體,這證明了此靶向作用本質為自身免疫反應。
預測1A型糖尿病的最簡單方法是:四種“生化”自身抗體中有兩種或兩種以上的表達即預示個體有患糖尿病的風險。現在尚不知為何這樣的組合性預測如此有效,但無效假設是這僅與統計學的概率有關。結合二項分布原理及Bayers原理,可以計算結合自身抗體檢測的陽性率及陰性率的預測值。特別是通過計算可獲得利用現有四個試驗檢測出一個或多個、兩個或多個胰島自身抗體的概率。若這些試驗以第99百分位數值為界,約有4%的正常個體也可能出現一個或多個自身抗體陽性反應,然而只有0.06%的正常人出現兩個及以上抗體陽性。若以第95位百分位數值為界,相應的假陽性率是1.4%。無論出自研究或臨床目的,當試驗的假陽性率達5%,聯合多個試驗將導致問題產生,可能造成1A型糖尿病低風險人群(例如臨床診斷為2型糖尿病的患者)胰島自身抗體的檢測結果混亂。對于此類人群,以第95位百分位數值為界,可保持診斷的特異性(如1.4%的假陽性率),而不出現一個或多個自身抗體的表達。
“生物學”的胰島自身抗體假陽性結果并不代表缺乏與自身抗原結合的自身抗體,亦不等于確定存在自身抗體的表達。可能存在真正的自身抗體表達,然而尚受它們識別的抗原表位、自身抗體的水平、缺乏多重自身抗體的表達等多個因素的影響,因此自身抗體表達并不一定意味著糖尿病患病風險增高。低親和力胰島素自身抗體可單獨存在,而大多數具此類自身抗體的兒童并不會進展為糖尿病,即是很好的證明。最近,Hampe等報告,正常人具有個體基因型抗體,去除這種抗體后,正常血清對GAD65呈陽性反應。該實驗系統復雜,且存在人單克隆抗GAD65自身抗體從微珠上被洗脫的可能。此新發現有待進一步研究的檢測。
類似的,缺乏所有胰島自身抗體的表達并不等同于不存在1A型糖尿病。在對兒童的糖尿病進程的隨訪過程中,常可觀察到自身抗體表達的波動,可表現為一抗體水平降低而另一抗體水平升高。有一小部分自身抗體陽性的兒童在糖尿病發病前所有自身抗體表達均消失。如果患兒出現糖尿病表現但不表達四種標準生化自身抗體中的任意一個,按程序應考慮單基因突變糖尿病,因為糖尿病的罕見形式,如DIDMOAD/Wolfram綜合征等,將對治療的選擇(如使用磺脲類藥物)及疾病預后產生極大影響。據估計,缺乏胰島自身抗體的糖尿病患兒中有10%屬于單基因突變糖尿病。
胰島素自身抗體非常獨特,因為其滴度水平及陽性率與糖尿病發病時的年齡呈負相關關系。在引入胰島素治療數周內,幾乎所有的個體均表達胰島素抗體,現階段尚無法區分此抗體與胰島素自身抗體。胰島素自身抗體通常(但并不一定)是患兒出生后體內第一個出現的抗體,隨后依次出現的是GAD65,IA-2,ZnT8。總的來說,應該盡量避免使用標準化ELISA法測試這些抗體,然而,一種新型GAD檢測方法運用抗GAD自身抗體取代標準ELISA法中的GAD自身抗原檢測,這種方法在國際研討會中獲得好評。
臨床上可能需要即時篩查測驗以檢測胰島自身抗體,而且如果預防性治療被引入臨床實踐,這種需要將變得迫切。現在大部分的檢查費用主要是標本運輸至實驗室及相關文書工作的花費。如果可應用即時篩查測驗,則可以在醫生辦公室內直接進行抗體檢測,根據結果可建議進一步行確認實驗,以及對表達一種及一種以上自身抗體的異常個體進行疾病分期。現在實驗室最難掌握的檢測技術是胰島素自身抗體的測量,而多數檢測GAD65、IA-2和ZnT8抗體的液態放射性分析技術在國際研討會上已獲得一致好評。
第4階段:進行性代謝異常
可以通過多種途徑來評價糖尿病患者的代謝異常進展狀況。其中特異性最高的一種方法是經靜脈的葡萄糖耐量試驗。大部分病程在1年內的糖尿病患者接受葡萄糖注射后,產生1+3分鐘胰島素分泌,分泌量少于正常對照的第一位百分位數值。此法也是采用靜脈注射途徑的最不方便的方法之一。口服葡萄糖耐量試驗亦能高效預測患者的病情惡化程度。在諸如DAISY的研究中,我們利用指尖采血法測量A1C水平。研究結果表明,絕大多數(但并非所有)糖尿病患兒的A1C水平于顯性糖尿病發生前1~2年內在正常范圍內逐漸升高。隨著A1C水平漸升,則應采用口服葡萄糖耐量試驗以明確糖尿病的診斷。
第5階段:顯性糖尿病
顯性1A型糖尿病的進展通常十分迅速,或許這對于器官特異性自身免疫性疾病而言屬于正常情況。在表達21羥化酶自身抗體的顯性Addison氏病患者中,可以觀察到類似的ACTH值急劇增加。可能大多數1A型糖尿病患者在患病數月甚至一年后才確診為糖尿病,故他們的A1C水平升高,有些患者血糖水平甚至超過1,000mg/dl。在糖尿病發病時死亡的患兒,對他們進行評估的首位衛生工作者通常未能做出糖尿病的診斷,而延誤治療數天可能造成致命性的后果。在如DAISY之類的研究中,在預先確定有患糖尿病風險的兒童中,可以避免此類糖尿病以急性發病形式呈現。一旦糖尿病發生,之后對于疾病進程的隨訪應以C肽分泌能力的降低為首要監測指標。
第6階段:胰島素依賴階段
關于長病程的1型糖尿病患者體內C肽和β細胞數量上的殘存存在爭議。例如,有證據表明一些兒童期起病的長病程糖尿病患者胰腺內尚殘存一些表達胰島素的細胞,同時亦存在β細胞凋亡。幸運的是,通過由Atkinson發起的nPOD項目,大部分從捐獻遺體獲得的胰腺可迅速被用于組織學分析,其優勢之一是可獲得整體形式的胰腺,故可對器官的多個部分進行分析。從1型糖尿病患者及非糖尿病患者捐獻的遺體獲得的胰腺均被進行分析,切片圖片展示于網站上(www.jdrfnpod.org)以便國際性科研。研究者可用臺式電腦觀察這些切片,效果與通過顯微鏡觀察一致。現已明確,部分兒童期起病的臨床診斷為1型糖尿病的患者體內仍有大量的β細胞,這些患者胰島內的任意地方都有β細胞,但可能這些患者并無1A型糖尿病,他們的疾病可能與發生在美國小部分人口中的、具酮癥傾向的糖尿病有關。nPOD項目中大多數長病程的兒童期起病糖尿病患者胰腺的胰島內無β細胞,大約10%的患者有少量具胰島素分泌功能的胰島組織含β細胞。這種小葉區尚存β細胞的異質性有可能解釋此類患者的1A型糖尿病病程進展緩慢。這種情況使人聯想到白癜風患者成片的皮膚中黑色素細胞的破壞(圖5)。
預防β細胞破壞的試驗
雖然多種干預措施都未能成功地在診斷后預防1型糖尿病的進展或β細胞的破壞,我們正在進入一個有數種能夠減輕β細胞破壞的免疫療法時代,數個相關Ⅲ期臨床試驗正在進行或在計劃中。然而,我們仍缺乏有關其長期療效、安全性、發揮療效途徑等方面的關鍵信息,因此尚需進一步研究。從大體上可將這些免疫療法分為兩種,一種對機體整體發揮免疫抑制及免疫調節作用,另一種為抗原特異性的免疫療法。以現有資料來看,免疫抑制/免疫調節試驗有效的可能性更大,但其風險亦更高。在本文中,我將重點討論四種療法,它們均從一定程度上(因為缺乏“陽性”試驗,而大規模的對照試驗數目亦十分有限)被證明有效。
美國國立衛生研究所(NIH)糖尿病預防試驗評估了對胞漿胰島自身抗體陽性的1型糖尿病親屬從腸道外途徑給予胰島素及口服胰島素(目的是誘導“口服耐受”)的方法。依照其胰島素抗體表達情況、代謝異常情況及是否具有保護性HLA等位基因DQB1*0602,對研究對象進行分期。此外,對GAD65和ICA512自身抗體進行了測量,盡管未將此二者納入預測患病風險的指標中。大規模的研究,如ENDIT預防性研究對煙堿進行研究,證明在相對大規模的情況下可對1型糖尿病進行預測,對患病的不同風險進行分級。總的來說,上述研究不能影響糖尿病病程的進展,但也有例外。在一個口服胰島素試驗中,一小群具有高水平胰島素自身抗體的實驗對象口服胰島素后糖尿病進程顯著減慢(圖6)。為此,NIH TrialNet 小組正在進行相關研究,力圖明確口服胰島素治療在表達多種胰島自身抗體的胰島自身抗體陽性的患者親屬及具胰島素自身抗體者中是否能減緩糖尿病的進展。
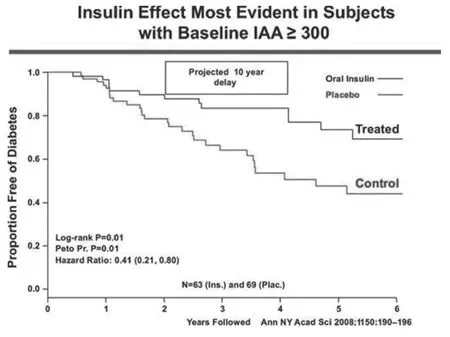
圖6 一個具最高胰島素自身抗體水平的胰島自身抗體陽性患者親屬亞群在接受口服胰島素治療誘導粘膜免疫耐受后,糖尿病進程延緩。
在1型糖尿病發病時實驗結果中的主要變量是殘存C肽水平。GAD65是人類自身免疫的一個主要目標,因此GAD65是預測糖尿病進展的最優預測指標之一。一項小規模的隨機對照實驗結果表明,以明礬為免疫佐劑的GAD65可延遲C肽水平的降低,但尚不能改善患者A1C水平或減少胰島素需求量。關于明確GAD65疫苗作用的相關驗證性試驗正在進行中,其中包括一項新近啟動的TrialNet研究。
在兩個單獨利用兩種不同的抗CD3抗體的實驗中,C肽分泌能力喪失均得以明顯延遲。實驗對抗CD3抗體進行了改進,以減少細胞因子釋放、限制急性毒性作用。C肽分泌能力喪失被延緩至6~12個月后,之后C肽水平繼續降低(盡管已被延緩),與對照組相似。胰島素利用率降低與C肽降低減少相關。有證據表明,除了引起急性及一過性T細胞耗竭,上述療法還能誘導調節性T細胞特別是CD8調節性T細胞生成。Ⅲ期實驗需要進行更長時間的隨訪及對更多的個體進行評估,以判斷此療法的有效性及潛在毒性。
一項近期的TrialNet研究指出,單獨應用抗B細胞抗體—抗CD20,能顯著延緩C肽喪失,改善A1C水平,減少胰島素需求量。數月到一年內,抗CD20減少循環中的B淋巴細胞,但并不以漿細胞為目標。許多抗體水平在此療法中無變化,而特定的自身抗體被明顯抑制。抗CD20抗體曾被用于B細胞淋巴瘤的治療,且對于多發性硬化及風濕性關節炎均有效。故較抗CD3抗體,抗CD20抗體的應用有更多的相關經驗。盡管如此,必須進行進一步試驗以評價將其作為一種藥物單獨用于治療糖尿病患者及新發糖尿病患者的有效性和安全性。更新的抗CD20抗體及一系列治療性靶向B細胞正在研制中。從動物實驗中已經獲得證據,表明調節性B細胞被誘導生成,且B細胞可能對于胰島自身抗體的表達有重要作用。
到目前為止,上述療法均無法取得長期、徹底阻止糖尿病進展的效果。引人注目的是,盡管糖尿病進展為十分緩慢的破壞性進程,1A型糖尿病的自身免疫反應對于免疫治療療效反應極弱。這可能是因為上述療法并未消除潛在的驅動β細胞破壞的T細胞相關記憶。或許,多途徑療法或聯合治療能夠達到長期緩解疾病的目的。而長期、持續性免疫抑制療法必然不是治療1型糖尿病的選擇。
大約每300個隨機選擇的遺體捐獻者中就有1人表達多種胰島自身抗體,因此可能約有一百萬美國人正處在1型糖尿病的發展過程中。隨著免疫調節/免疫抑制療法的改進,或抗原特異性治療的發展,我們相信慢性活動性胰島炎可能會像慢性活動性肝炎一樣成為可治療的病變。

