非小細胞肺癌長春瑞濱加順鉑方案化療敏感性與XPC基因多態性及單體型的關系
中國醫科大學附屬第一醫院腫瘤研究所(110001) 翟雅娜 徐 倩 洪成雨 張 曄 袁 媛
作者:翟雅娜,中國醫科大學研究生在讀,現工作單位遼寧省腫瘤醫院。
基因多態作為腫瘤遺傳易感性的分子標志,及腫瘤化療敏感性的預測指標有很大的發展前景。基因多態分為單核苷酸多態(SNP)、插入/缺失多態、可變數目重復序列多態等,SNP是單個堿基在DNA序列上存在的不同于原來堿基的差別。隨著單體型是指位于染色體上某一區域的一組相關聯的SNP等位位點,且相鄰人類基因組計劃以及HapmapⅢ期數據的完成,標簽SNP在眾多SNP中倍受關注,它是基于連鎖不平衡原理在某一基因區域分型得出的能捕捉其他大多數SNP的某個SNP。SNPs的等位位點傾向于以一個整體遺傳給后代。基因多態以及單體型作為分子標志已成為近年來的研究熱點。
非小細胞肺癌(NSCLC)患者占肺癌患者的80%以上,長春瑞濱加順鉑(NP)是治療晚期NSCLC的首選方案。有臨床研究顯示,NSCLC患者對NP方案的反應不同,這種不同與DNA的修復能力有關[1]。DNA修復途徑有很多種,如堿基切除修復、DNA雙鏈斷裂修復、錯配修復、核酸切除修復。XPC基因是參與核酸切除修復過程中的一種重要基因,位于3p25,有16個外顯子。DesprasE等人通過敲除眾多DNA修復基因,發現只有XPC的敲除影響了機體對DNA的修復功能[2]。SaviozziS等人發現,DNA修復基因XPC參與了化療藥與肺癌細胞的相互作用,NSCLC患者化療后組織中僅有含XPC、XPA、UBE2N3個基因的mRNA低表達,證實XPC蛋白在肺癌患者化療反應中的重要作用[3]。目前多位學者關注的XPC多態位點有第8外顯子Val499Ala(C/T,rs2228000)多態,第9內含子PAT(28795-28799缺失GTAAC且插入83bp的多AT序列者為 L等位基因者,未缺失28795-28799 GTAAC5bp者為S等位基因)多態,第15外顯子Lys939Gln(A/C,rs2228001)多態,他們均是重要的標簽 SNP。有研究發現,XPCVal499Ala、PAT、Lys939Gln單體型與膀胱癌、鼻咽癌的發病風險有關[4-5]。但 大 多 數 研 究 僅 局 限 于 XPC 基 因Val499Ala、PAT、Lys939Gln單體型與腫瘤遺傳易感性的關系,其與腫瘤化療敏感性關系的研究還很少,特別是NSCLC的化療敏感性。
本研究嚴格控制了研究對象的入組標準,NSCLC患者均以統一的化療藥物(NP方案)做治療,統計分析時調整了年齡、性別、吸煙、病理類型、臨床分期等因素對研究的影響。通過檢測NSCLCNP方案不同療效組患者的XPC基因第8外顯子、第9內含子、第15外顯子多態的信息,探討XPC基因多態以及單體型對NSCLC患者NP方案化療敏感性的影響,期望能為基因多態及單體型作為腫瘤個體化治療的預測指標提供實驗依據。
1 對象和方法
1.1 研究對象 研究對象分別來自中國醫科大學附屬第一醫院腫瘤內科、遼寧省腫瘤醫院腫瘤內科2006年10月至2008年5月收治的晚期NSCLC患者163例。男98例,女65例。年齡27~84歲,中位年齡61歲。所有患者均經病理學或細胞學診斷,有可測量評價的病變,并且均采用NP方案化療。化療前與患者簽署知情同意書,采集患者空腹靜脈血5mL裝入抗凝試管內,分離血清和凝血塊后-20℃保存。
1.2 XPC基因多態性檢測 以限制性內切酶片斷長度多肽(PCR-RFLP)方法進行XPC基因Val499Ala、PAT、Lys939Gln3個位點的基因型分析。從-20℃冰箱中取出凝血塊500μL大小,置于2mL離心管中用于DNA提取。加入800μL的TE液,混勻;于室溫下,10000rpm離心10分鐘,重復5~6次,直至血凝塊全部溶解在 TE中。加 400μLTE,25μL10%SDS,5μL20mg/mLPK,37℃消化過夜;吸上清,加等體積酚,震蕩15分鐘,10000rpm離心10分鐘,吸上清,加等體積酚∶氯仿(1∶1),震蕩 15分鐘,10000rpm離心10分鐘,吸上清,加等體積的氯仿,震蕩15分鐘,10000rpm離心10分鐘,吸上清,加2倍體積無水乙醇和1/10體積3M乙酸鈉,-20℃沉淀1小時,10000rpm離心10分鐘,棄上清,沉淀加75%乙醇,10000rpm離心5分鐘,棄上清,干燥,100μLTE溶解,置于-20℃冰箱待用。XPC基因Val499Ala、PAT、Lys939Gln3個位點多態的檢測:PCR反應體系(50μL):10×PCR緩沖液(含MgCl225nmol/L)5μL;4種2.5mmol/LdNTP混合物4μL(50μmol/L);引物各 lμL(0.2μmol/L);Taq DNA聚合酶 0.5μL(2.5U);模板 DNA1μL(50~100ng);加雙蒸水至 50μL。除 PAT多態直接于2.0%瓊脂糖凝膠電泳外,取12μLPCR產物分別與限制性核酸內切酶5U(MBI公司)于37℃溫育過夜。XPCVal499Ala多態取5μL酶切產物于10%聚丙烯酰胺凝膠電泳120V1小時;XPCLys939Gln多態全部酶切產物于2.0%瓊脂糖凝膠電泳150V45分鐘。電泳凝膠于0.5μg/mLEB溶液中染色,用HVE50凝膠成像系統觀察分析。將3個位點的PCR產物進一步純化、測序。全部試劑購自大連寶生物公司,PCR引物及反應條件、酶切片段及對應的等位基因,見表1。

表1 PCR及RFLP的反應條件
1.3 NSCLC之NP及療效評定
1.3.1 NP 長春瑞濱25mm/m2+0.9%鹽水100mL靜滴,第 1天、第 8天;順鉑 40mg+0.9%鹽水500mL,第2天、第3天、第4天靜滴。21天為1個周期,2個周期后對可測量病變進行療效判定。
1.3.2 療效判定 采用WHO標準(1981年):完全緩解(CR):可測量的病變完全消失;部分緩解(PR):可測量的病變縮小≥50%;無變化(NC):腫塊縮小不及50%或增大未超過25%;進展(PD):1個或多個病變增大25%以上或出現新病變。CR+PR為有效,NC+PD為無效。
1.4 統計學方法 采用SPSS16.0軟件進行統計學處理。計算等位基因頻率。以多因素Logistic回歸比較基因型在各分組間分布的差異,以比值比(OR)及其95%可信區間(CI)表示相對危險度。利用SHEsis分析軟件[6]計算等位基因頻率及單體型頻率。P<0.05為差異有顯著性。
2 結果
2.1 XPC基因型的鑒定 XPC第8外顯子Val499Ala和第15外顯子Lys939Gln多態的PCR擴增后產物經酶切電泳,分別產生C/C、C/T、T/T基因型和A/A、A/C、C/C 基因型(圖 1A、圖 1C);第 9內含子PAT多態經PCR后電泳產生266bpS/S基因型,以及含有缺失GTAAC5bp插入83bp多AT序列的L等位基因者(即L/S基因型,見圖1B)。XPC3位點多態進一步經PCR產物測序證實,見圖1D~F。


圖1 PCR產物經限制性酶切后瓊脂糖凝膠電泳圖譜及PCR產物測序結果。
圖1-A為XPC基因第8外顯子Val499Ala多態經SacⅡ酶切后出現3個分子量不同的片段,分別是152bp、131bp、21bp;1道:150bp DNA marker,2、6、8:C/C 野生基因型;4、5、7:C/T 雜合子;3:T/T 突變基因型。9:100bp DNA marker。圖 1-B 為 XPC基因第9內含子PAT多態,1道:150bp DNA marker,2:短片段為266bp(S/S基因型),3、4:短片段與長片段雜合子(L/S基因型)。圖1-C為XPC基因第15外顯子Lys939Gln多態經PvuⅡ酶切后出現3個分子量不同的片段,分別是765bp、585bp、180bp;1、3、4:A/A野生基因型;2、7:A/C雜合子;5、6:C/C突變基因型。8:100bp DNA marker。圖 1-D為第 8外顯子Val499Ala多態的測序圖,圖中箭頭所指為多態位點的堿基。左至右分別為C/C基因型、C/T基因型、T/T基因型。圖1-E為第9內含子PAT多態的測序圖,上圖和下圖分別為缺失基因型(S/S,含插入GTAAC 5bp)和插入基因型(L/L,含S/S缺失的83bp)。圖1-F為第15外顯子Lys939Gln多態的測序圖,圖中箭頭所指為多態位點的堿基。左至右分別A/A基因型、A/C基因型、C/C基因型。
2.2 XPC基因多態的分布頻率及與其他數據庫的比較 163例NSCLC患者XPC基因3位點多態的分布頻率及與已知數據庫的比較,見表2。

表2 XPC基因多態NSCLC分布頻率及與已知數據庫的比較(%)
2.3 研究對象的臨床病理參數與化療敏感性的關系
本組研究對象的年齡、性別、吸煙、病理類型、臨床分期等資料的頻率分布,見表3。采用多因素Logistic回歸經其他臨床病理參數調整,發現本組病例的臨床病理參數對化療敏感性均無影響(P>0.05)。
2.4 XPC Val499Ala、PAT、Lys939Gln3 個位點基因型與NSCLC化療敏感性的關系 本研究發現,NSCLC患者XPCVal499Ala多態C/C、C/T、T/T基因型的分布頻率分別為 32.5%、65.0%、2.5%;XPC Lys939Gln多態A/A、A/C、C/C基因型的分布頻率分別為42.9%、47.2%、9.8%;XPC PAT多態L/L、L/S、S/S基因型的分布頻率分別為9.2%、6.1%、84.7%。XPC3個位點在化療有效組與無效組的頻率分布,見表3。由于XPC Val499Arg位點T/T基因型例數較少(僅4例),我們將T/T基因型與C/T基因型合并分析。采用多因素Logistic回歸,經年齡、性別、吸煙、病理類型、臨床分期等因素的調整,發現XPC Val499Arg位點C/T+T/T基因型者的化療有效率(40.0%)明顯高于 C/C基因型者(24.5%),即與C/C基因型者相比,C/T+T/T基因型的NSCLC患者化療敏感性增大到2.166倍(P=0.048,OR=1.008~4.655),見表4。

表3 NSCLC患者臨床病理類型與化療敏感性的關系
2.5 XPCVal499Ala、PAT、Lys939Gln3 個位點等位基因與NSCLC化療敏感性的關系 本研究發現,NSCLC患者XPC8外顯子Val499Ala多態C等位基因和T等位基因的分布頻率分別為 65.0%、35.0%;XPC15外顯子Lys939Gln多態C等位基因和A等位基因的分布頻率分別為33.5%和66.5%;XPCPAT多態L等位基因和S等位基因的分布頻率分別為12.2%、87.8%。采用SHEsis軟件分析XPCVal499Ala、PAT、Lys939Gln3 個位點等位基因頻率與NSCLC化療敏感性的關系,發現XPCPAT多態S等位基因的化療有效率(37.1%)明顯高于L等位基因的化療有效率(20.0%),即與攜帶L等位基因者相比,攜帶S等位基因的個體化療敏感性增大到2.353倍(P=0.034,OR=1.047~5.291),見表5。
2.6 XPCVal499Ala、PAT、Lys939Gln 單 體 型 與NSCLC化療敏感性的關系 采用SHEsis軟件分析XPCVal499Ala、PAT、Lys939Gln單體型與NSCLC 化療敏感性的關系。XPC3種多態的單體型組合為8種,將最小頻率閾值(LFT)設為0.03,因T-L-A和TL-C2種單體型的分布頻率<3%,因此不計入統計分析。結果發現,以其他單體型者為參照,攜帶CL-A(Val499Ala-PAT-Lys939Gln)單體型的個體在化療無效組的比率(6.7%)顯著高于有效組(0.0%),差異具有顯著性(P=0.007),即攜帶XPCC-L-A(Val499Ala-PAT-Lys939Gln)單體型患者對NSCLCNP方案化療應答差,見表6。
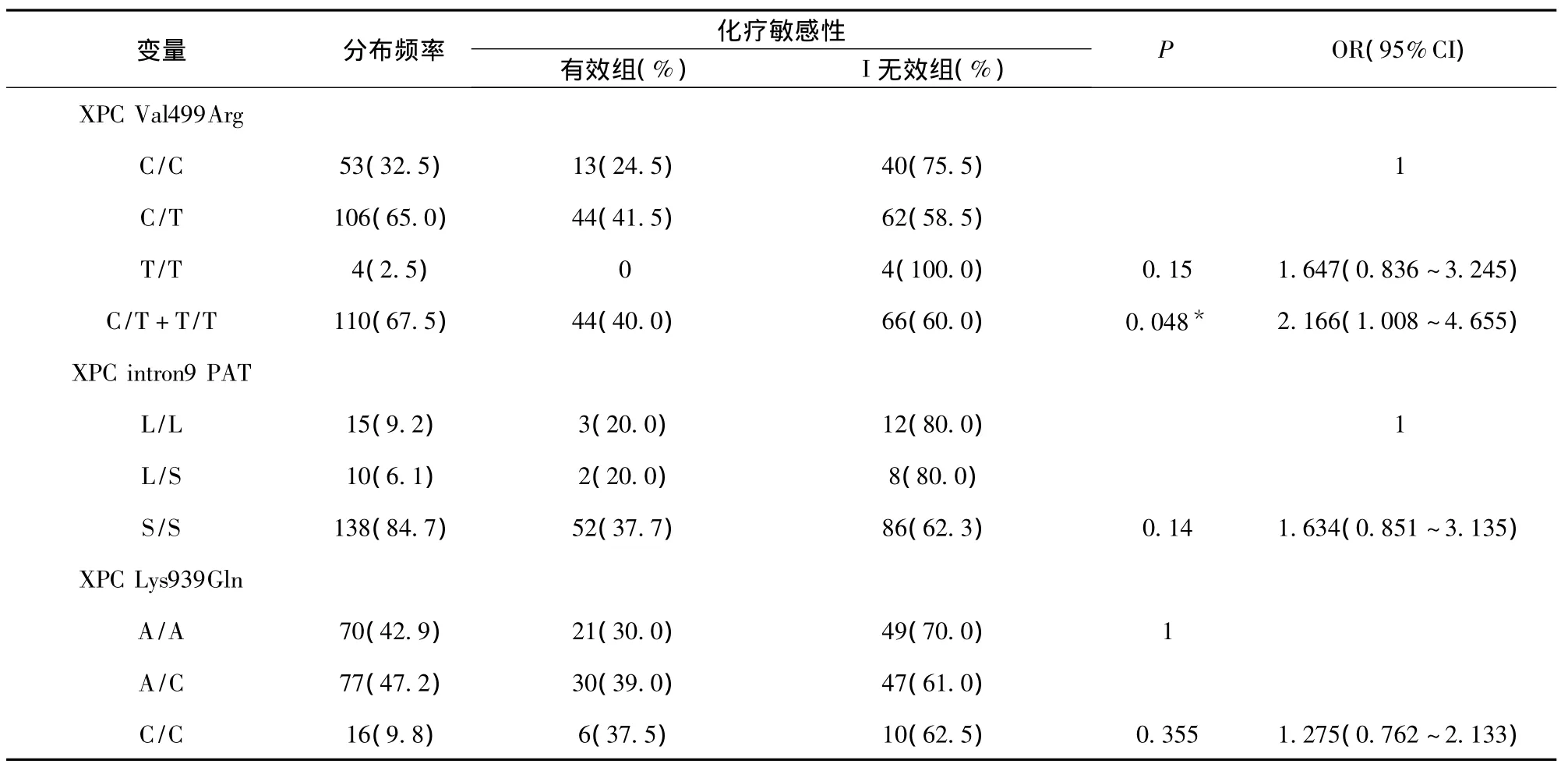
表4 XPC基因型與NSCLC患者化療敏感性的關系

表5 XPC等位基因頻率與NSCLC化療敏感性的關系
3 討論
近年來,基因多態性與腫瘤患者化療敏感性的研究引起研究者高度重視。化療方案前進行基因型的預測分析,對優化治療方案,實現個體化治療具有重要作用。但是,由于干擾因素眾多,研究結果的真實性受到質疑。我們采用NP統一化療方案,以排除其他化療方案對結果的影響。病例分析前,我們考慮了年齡、性別、吸煙、病理類型和臨床分期等因素,使之達到平衡,消除了上述因素對本研究結果的影響。本研究報道了NSCLC患者XPC3種多態的基因型分布頻率(見表2),將本組數據與人類基因組Hapmap計劃公布的中國北京的45名漢族人的分布頻率數據進行比較,發現 NSCLC患者的 XPC Val499Ala和Lys939Gln多態的基因型和等位基因分布頻率與北京人群基本相似,未見明顯差異(分別為65.0%和70.0%,33.5%和37.8%)。而XPC第9內含子PAT多態在Hapmap數據庫中未見數據報道,本研究中關于第9內含子PAT多態在中國NSCLC患者的分布頻率報道尚屬首次。LeeGY等人研究了韓國432名健康人群XPCPAT多態的頻率分布,發現L/L、L/S、S/S基因型分別為13.2%、48.1%、38.7%,L等位基因和S等位基因的分布頻率分別為34.8%和65.2%[7]。而本研究發現,L/L、L/S、S/S基因型的分布頻率分別為9.2%、6.1%、84.7%,L等位基因和S等位基因的分布頻率分別為12.2%、87.8%。雖然 Hapmap數據庫并沒有PAT多態分布頻率的數據,但是韓國人群可以代表亞洲人。我們發現,本組病例中NSCLC患者中第9內含子的分布頻率與亞洲正常人群有很大差別。因此,我們推測S等位基因參與了NSCLC的致癌過程,這一推論今后需要大樣本實驗證實。
本研究中發現,XPC第8外顯子Val499Ala多態C/T+T/T基因型的NSCLC患者化療敏感性增大到2.166倍;攜帶XPC第9內含子PAT多態S等位基因的個體化療敏感性增大到2.353倍,而XPC 15外顯子多態與化療敏感性未見明顯相關。我們猜測,由于第8外顯子與第9內含子在基因的物理位置上相隔較近,在與化療藥物作用上可能有一定的相互作用。另有學者發現,XPC的第9外顯子有一14bp缺失/25bp插入的多態,其使XPCmRNA表達下降,XPC蛋白表達減少,與皮膚癌的發生有關[8]。基因在進行轉錄時,第9內含子對第8、9外顯子轉錄剪接的調控影響可能較大,而第15外顯子相距甚遠,是否存在相互作用還尚待進一步研究。
腫瘤的遺傳易感性的風險基因型與化療敏感性的有效基因型是否一致,目前還存在爭議。NP方案中,長春瑞濱是一種阻斷細胞周期的特異性藥物,抑制微管的形成同時能促進微管解聚。順鉑通過形成順鉑-DNA混合物,與DNA結合發揮其細胞毒作用。這些DNA鏈內或鏈間的交聯導致的DNA損傷,可以介導腫瘤細胞死亡。NP方案化療與DNA修復基因多態的作用機制可能主要以順鉑的作用為主。有學者認為,多態的突變基因型由于一種保護機制而比野生基因型更容易發動凋亡[9-10],而攜帶XPC容易發生凋亡的等位基因個體,DNA修復能力下降,對化療藥的反應下降而化療敏感性提高。XPC基因第8外顯子突變基因型(T/T)降低了原發性肝癌的發病風險,是保護因素。我們也發現,C/T+T/T基因型個體化療敏感性提高,這2項結果均與以上觀點一致。而有學者發現,XPC第9內含子雜合子L/S基因型降低了白人食道癌的發病風險[11]。同時我們發現,S等位基因者比L等位基因者的化療敏感性提高了2.353倍。因此,我們假設變異等位基因S可能依以上觀點,由于一種保護機制更易凋亡,而導致機體DNA修復能力下降,致化療敏感性提高。雖然目前有研究報道,XPC15外顯子Lys939Gln多態與XPC蛋白表達有關,中國人群肝癌及日本人群前列腺癌有關[12-13],但我們尚未觀察到XPC第15外顯子與NSCLC化療敏感性的相關性。
單體型作為藥物療效及基因診斷及預測的研究是近年來研究的熱點。由于單體型包含多個SNP的遺傳信息,其以比單個SNP具有更好的統計分析效果和應用價值而在統計分析中倍受學者青睞。有學者發現,XPC Val499Ala-PAT-Lys939Gln的幾種單體型組合與膀胱癌和鼻咽癌的發病風險有關[4-5]。Rondelli CM等認為,XPC的某些單體型可以改變吸煙者的DNA修復能力,導致染色體畸變從而改變了腫瘤的發病風險[14]。本研究發現,攜帶 C-L-A(Val499Ala、PAT、Lys939Gln)單體型的個體在化療無效組(6.7%)的比率顯著高于有效組(0.0%),即攜帶C-L-A單體型患者對NP化療應答差。此單體型均由3個多態位點的野生等位基因組成,其化療無效,可能因其更不容易發生凋亡,而DNA修復能力過強,導致對化療藥的反應過強而化療敏感性下降。這一結果與上述觀點亦一致。
本研究探討了攜帶XPC3個基因多態位點基因型及單體型的患者采用NP方案化療后敏感性的差別,首次報道了XPC PAT多態在中國NSCLC患者的分布頻率,初步認為XPC基因多態可能是預測NP化療敏感性的有效分子標志物。今后還需要大樣本的病例研究以驗證此結果,并需要多基因多位點的研究以全面探討鉑類化療藥物敏感性的機制。

表6 XPCVal499Ala、PAT、Lys939Gln 單體型與NSCLC化療敏感性的關系#
[1] Reed E.Platinum-DNA adduct,nucleotide excision repair and platinum based anti-cancer chemotherapy[J].Cancer Treat Rev,1998,24(5):331
[2] Despras E,Pfeiffer P,Salles B,et al.Long-term XPC silencing reduces DNA double-strand break repair[J].Cancer Res,2007,67(6):2526
[3] Saviozzi S,Ceppi P,Novello S,et al.Non-small cell lung cancer exhibits transcript overexpression of genes associated with homologous recombination and DNA replication pathways[J].Cancer Res,2009,69(8):3390
[4] Zhu Y,Lai M,Yang H,et al.Genotypes,haplotypes and diplotypes of XPC and risk of bladder cancer[J].Carcinogenesis,2007,28(3):698
[5] Yang ZH,Liang WB,Jia J,et al.The xeroderma pigmentosum group Cgene polymorphisms and genetic susceptibility of nasopharyngeal carcinoma[J].Acta Oncol,2008,47(3):379
[6] Shi YY,He L.SHEsis a powerful software platform for analyses of linkage disequilibrium,haplotype construction,and genetic association at polymorphism loci[J].Cell Res,2005,15(2):97
[7] Lee GY,Jang JS,Lee SY,et al.XPC polymorphisms and lung cancer risk[J].Int JCancer,2005,115(5):807
[8] Emmert S,Wetzig T,Imoto K,et al.A novel complex insertion/deletion mutation in the XPCDNA repair gene leads to skin cancer in an Iraqi family[J].J Invest Dermatol,2006,126(11):2542
[9] Bowen AR,Hanks AN,Allen SM,et al.Apoptosis regulators and responses in human melanocytic and keratinocytic cells[J].J Invest Dermatol,2003,120(1):48
[10] Miller KL,Karagas MR,Kraft P,et al.XPA,haplotypes,and risk of basal and squamous cell carcinoma[J].Carcinogenesis,2006,27(8):1670
[11] Pan J,Lin J,Izzo JG,et al.Genetic susceptibility to esophageal cancer:the role of the nucleotide excision repair pathway[J].Carcinogenesis,2009,30(5):785
[12] Long XD,Ma Y,Zhou YF,et al.Polymorphism in xeroderma pigmentosum complementation group C codon 939 and aflatoxin B1-related hepatocellular carcinoma in the Guangxi population[J].Hepatology
[13] Hirata H,Hinoda Y,Tanaka Y,et al.Polymorphisms of DNA repair genes are risk factors for prostate cancer[J].Eur JCancer,2007,43(2):231
[14] Rondelli CM,El-Zein RA,Wickliffe JK,et al.A comprehensive haplotype analysis of the XPC genomic sequence reveals a cluster of genetic variants associated with sensitivity to tobacco-smoke mutagens[J].Toxicol Sci,115(1):41

