瘤胃內容物發酵對豆粕蛋白質品質及菌群組成的影響
浙江萬里學院生物與環境學院 胡程珩 呂 葉 李彩燕* 郭 宇 楊義右 黃麗萍
豆粕是一種優質的植物蛋白質源,價格低且來源廣,是畜牧水產飼料中理想的魚粉替代物。但豆粕中存在多種抗營養因子,如胰蛋白酶抑制劑、植酸等(Francis等,2001),極大地影響了豆粕的飼用價值,需要經過加工處理才能廣泛應用。近年來,與加熱處理、化學浸提等常規方法相比,微生物發酵處理由于去除效果良好、營養價值提高、工藝環保等多種優點,備受關注。以微生物發酵的方法來降低植物蛋白質抗營養因子的研究已有不少報道 (Hong 等,2004;Egounlety 和 Aworh,2003;El-Batal和 Karem,2001)。
反芻動物的瘤胃是一種特殊的發酵罐,其中棲息著各種微生物(細菌、真菌、原蟲等),表現出很強的降解纖維素和消除飼料毒物的作用,包括生氰糖甙、皂甙和植酸等 (趙智力和王思珍,2008)。國內外對瘤胃微生物的研究主要來自反芻動物營養學領域,對其在蛋白質飼料開發方面的報道很少。筆者所在的課題組前期已通過單因素和正交試驗,優化了實驗室瘤胃液發酵豆粕的條件,確定了最佳發酵模式,使發酵豆粕中主要抗營養因子得到有效去除(李彩燕等,2011)。
本試驗在最適條件下用瘤胃液對豆粕進行了發酵,測定了發酵前后豆粕的蛋白質品質(氨基酸含量和蛋白質降解情況)、微生物組成(細菌總數、乳酸菌、大腸桿菌、霉菌)及pH值,以證實瘤胃液發酵豆粕的益處,可進一步為工業化生產發酵植物蛋白質提供參考。
1 材料與方法
1.1 試驗材料
1.1.1 豆粕原料與瘤胃液 豆粕原料購自寧波市鄞州區鐘公廟集貿市場。稱取同批豆粕粉碎,過40目篩,充分混勻,干燥保存備用。瘤胃液取自健康瘺管湖羊瘤胃,使用前用四層紗布過濾。
1.1.2 主要培養基 營養瓊脂培養基 (PCA)、馬鈴薯葡萄糖瓊脂培養基(PDA)、乳酸細菌培養基(MRS)、月桂基硫酸鹽胰蛋白質胨(LST)、煌綠乳糖膽鹽肉湯(BGLB),均購自杭州微生物試劑有限公司。
1.1.3 主要儀器設備 生化培養箱(GZX,寧波東南儀器有限公司)、酸度計 (梅特勒-托利多FE20)、微型發酵瓶(三角瓶)、凱氏定氮儀、培養皿、鹵素水分測定儀(MB35)、日立L-8900氨基酸自動分析儀。
1.2 試驗方法
1.2.1 體外發酵技術 參考Menke體外產氣法(Menke等,1998),利用瘤胃液中的微生物對豆粕進行厭氧發酵處理。瘤胃液接種量為5%,料水比為 1∶1,39 ℃厭氧發酵 72 h(李彩燕等,2010)。
1.2.2 氨基酸含量的測定 發酵前后豆粕樣品經鹽酸水解后,氨基酸含量用氨基酸自動分析儀進行測定。
1.2.3 豆粕蛋白質的電泳分析 參考馬文強等(2008)和 Hoffmann 等(2003)方法。稱取粉碎后過60目的豆粕1.00 g,加入20.00 mL 0.03 mol/L Tris-HCl(pH 8.0),在室溫下于搖床上 100 r/min浸泡 1 h;然后 10000 r/min,20 ℃離心 20 min,取上清。提取的蛋白質進行SDS-PAGE電泳。
1.2.4 樣品pH值的測定 參考那淑敏等(1999)方法。豆粕發酵前后的樣品烘干處理后各稱取10 g,用 100 mL蒸餾水混合浸提2 min,經四層紗布過濾,使用酸度計測定水溶液的pH值。
1.2.5 樣品菌群的測定 分別取發酵前后的風干豆粕樣品1 g,加入有9 mL無菌水的試管中,渦旋器混勻,再稀釋至 10-2、10-3、10-4、10-5、10-6濃度梯度,每個梯度分別重復3次,按照以下方法進行操作。細菌菌落總數的測定按GB/T4789.2-2008執行;大腸菌群的測定按GB/T4789.3-2008執行(分別采用MPN計數和平板計數法);乳酸菌測定按GB/T4789.35-2008執行;霉菌測定按 GB/T4789.15-2008執行。
1.3 數據統計 數據經Excel初步處理后,采用SAS(1999)廣義線性模型(GLM)的單因素方差分析進行統計分析法和顯著性檢驗,平均數之間用Duncan’s法進行多重比較。
2 結果
2.1 發酵前后氨基酸含量的變化 瘤胃微生物發酵前后豆粕中氨基酸含量變化見表1。由表1可知,氨基酸總量由發酵前得47.25%提高到發酵后的48.67%,比發酵前提高了3%,絕大多數氨基酸的含量都有所提高。

表1 發酵前后豆粕中氨基酸含量的變化%
2.2 發酵豆粕蛋白質的電泳分析結果 對發酵前后的豆粕蛋白質進行SDS-PAGE電泳可得到圖1的結果,可見,大分子質量的蛋白質得到降解,分子質量大于31 kDa的蛋白質明顯減少,小分子多肽明顯增加。
2.3 發酵前后豆粕中pH值和菌群結構的變化瘤胃內容物發酵對豆粕pH值和菌群結構的影響結果見表2。由表2可知,豆粕經瘤胃內容物發酵后pH值顯著下降,降低了1.32個單位。
細菌總數顯著增加,增加了2個數量級,霉菌和大腸桿菌均顯著降低,分別降低了3個和1個數量級。而有益的乳酸菌顯著上升,上升了4個數量級。
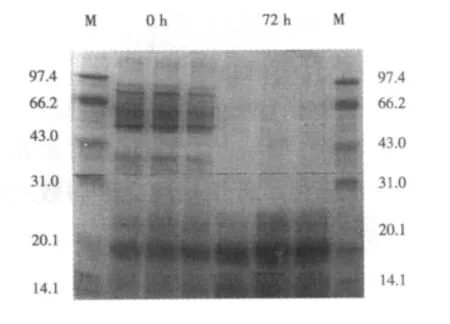
圖1 發酵前后豆粕中的蛋白質電泳圖

表2 發酵前后豆粕pH值和微生物指標測定結果
3 討論
3.1 發酵對豆粕氨基酸組成和蛋白質肽的影響豆粕經瘤胃內容物發酵后,胰蛋白質酶抑制因子和植酸等主要抗營養因子含量大大降低,營養特性得到明顯改善(李彩燕等,2011)。本試驗期望通過瘤胃微生物對豆粕的發酵,微生物大量繁殖,把部分原料轉化為菌體蛋白質,改善蛋白質氨基酸組成,還能積累一些有益代謝產物。試驗結果發現,豆粕發酵后,氨基酸含量也升高,與筆者前期對營養特性的研究結論一致。馬文強等(2008)通過枯草芽孢桿菌、釀酒酵母菌和乳酸菌對豆粕進行發酵后,其氨基酸的含量比發酵前提高了11.49%。同時本試驗對發酵豆粕進行電泳得出,發酵前大分子蛋白質已被降解為小分子質量的肽類,這與馬文強等(2008)的結果相一致。發酵后豆粕小肽含量的增加可能是由于發酵過程中微生物分泌的蛋白質酶分解部分大分子蛋白質得到的。蛋白質被微生物分解后,生成動物易吸收的小分子蛋白質或小肽,以提高豆粕利用率與蛋白質的吸收率(馬文強等,2008)。
3.2 發酵對豆粕菌群組成的影響 乳酸菌屬于有益的腸道微生態調節劑,可對動物腸道微生態平衡進行調整,達到幫助飼料消化吸收,提高飼料利用率,抑制腸道病原菌等多方面的作用 (江萍等,1998)。豆粕經瘤胃液作用發酵后,菌落總數和乳酸菌數量明顯增加。這與賈朋輝等(2009)微生態發酵飼料中細菌總數和乳酸菌的變化趨勢相一致,雖然采用不同的發酵菌種,本試驗中使用瘤胃液,賈朋輝等(2009)使用乳酸菌進行發酵,但是均說明了發酵能促進微生物的大量增殖。此外,由于微生物發酵糖類產酸和厭氧程度的逐漸加強,使物料環境更有利于乳酸菌的增殖。
僅用菌落總數不能作為評價發酵豆粕質量好壞的指標(劉金萍和王士長,2006),需要結合乳酸菌、大腸桿菌、霉菌等微生物指標的變化。大腸桿菌主要來源于人畜糞便,有些是致病菌或條件致病菌,常被用來作為評價食品及飼料的衛生質量指標(賈朋輝等,2009)。本試驗中,豆粕發酵后,菌落總數和乳酸菌明顯增加的同時,大腸菌群和霉菌數量下降,表示其有害菌的數量下降。
3.3 發酵對豆粕pH值的影響 從表1可以看出,豆粕經過瘤胃液發酵后,pH值顯著降低。可能由于發酵后,豆粕中乳酸菌大量增殖,在生長過程中同時產生乳酸,使飼料的pH值降低。劉金萍和王士長(2006)應用植物乳桿菌發酵斷奶仔豬料也發現,飼料經過發酵后,pH值都有所降低,最終pH值與乳酸菌含量有一定的關系。
4 小結
豆粕經瘤胃內容物發酵后,氨基酸含量提高,大分子質量的蛋白質得到降解,小分子多肽明顯增加,并且顯著增加了有益的乳酸菌含量,降低了有害的霉菌和大腸菌群的數量。本試驗利用瘤胃微生物較強的消化去毒作用,證實了瘤胃液可作為豆粕發酵處理的有效菌源,為開辟新的植物蛋白質飼料資源進行了有益的探索。
[1]江萍,夏先林,秦禮康,等.魔芋飛粉基質生料發酵[J].飼料研究,1998,9:3~6.
[2]賈朋輝,郭烘新,李國軍,等.微生態發酵飼料菌群變化及其應用[J].飼料博覽,2009,3:24 ~ 27.
[3]劉金萍,王士長.植物乳桿菌N3發酵斷奶仔豬料對飼料pH值及菌群的影響[J].2006,27(16):34 ~ 36.
[4]李彩燕,錢國英,汪財生,等.瘤胃微生物降解豆粕抗營養因子的發酵條件的優化研究[J].中國糧油學報,2011,26(6):73 ~ 77.
[5]馬文強,馮杰,劉欣.微生物發酵豆粕營養特性研究[J].中國糧油學報,2008,23(1):121 ~ 124.
[6]那淑敏,賈士芳,陳秀珠,等.嗜酸乳桿菌發酵代謝產物分析[J].中國微生態學雜志,1999,11(5):266 ~ 268.
[7]趙智力,王思珍.反芻動物瘤胃微生物對飼料毒物的作用[J].中國動物保健,2008,112:64 ~ 65.
[8]Egounlety M,Aworh O C.Effect of soaking,dehulling,cooking and fermentation with Rhizopus oligosporus on the oligosaccharides,trypsin inhibitor,phytic acid and tannins of soybean (Glycine max Merr.),cowpea (Vigna unguiculata L.Walp) and groundbean (Macrotyloma geocarpa Harms)[J].Journal of Food Engineering,2003,56(2 ~ 3):249 ~ 254.
[9]El-Batal A I,Karem H A.Phytase production and phytic acid reduction in rapeseed meal by Aspergillus niger during solid state fermentation[J].Food Research International,2001,34(8):715 ~ 720.
[10]Francis G,Makkar H P S,Becker A.Antinutritional factors present in plant-derieved alternate fish feed ingredients and their effects in fish[J].Aquaculture,2001,199: 197 ~ 227.
[11]Hong K J,Lee C H,Kim S W.Aspergillus oryzae GB-107 Fermentation improves nutritional quality of food soybeans and feed soybean meals[J].Journal of Medicinal Food,2004,7(4): 430 ~ 435.
[12]Hoffmann E M,Muetzel S,Becker K.The fermentation of soybean meal by rumen microbes in vitro reveals different kinetic features for the inactivation and the degradation of trypsin inhibitor protein[J].Animal Feed Science and Technology,2003,106:189 ~ 197.
[13]SAS.Procedures guide for personal computers,Version 8.0[M].SAS Institute Inc,Cary,NC,USA.1999.

