電解錳陽極泥的除雜活化及應用
陶長元,李東海,劉作華,鄒開云
(1.重慶大學化學化工學院,重慶 400044;2.重慶電池總廠,重慶 401120)
電解錳陽極泥是在電解金屬錳生產時,產生于陽極區的黑褐色副產物,成分復雜,含有 Mn、Fe、Pb、Ni、Cu、Ag、Ca和Mg等元素,烘干后MnO2含量一般為42%~59%;由于活性低,除少量用于電解錳廠的錳礦浸取液除鐵外,絕大部分作為工業固體廢物被堆存處置或廉價銷售,造成資源浪費和環境污染,而且每生產 1 t電解金屬錳,就產生 50~150 kg電解錳陽極泥[1]。近年來,人們已對電解錳陽極泥的利用開展了一系列探索性研究,但仍存在轉化率和回收率低、能耗高、工藝路線長、成本高、難以形成規模效益等問題。鋅錳電池正極材料一般采用天然MnO2,但隨著高品位軟錳礦資源的日益枯竭,尋找適宜的替代材料已成為必然需求[2]。
考慮工藝成本和環保等因素,在系統分析電解錳陽極泥物理化學性質的基礎上,本文作者采用濕法工藝[3]對電解錳陽極泥中的MnO2進行除雜活化處理,并用作鋅錳干電池的正極材料。
1 實驗
1.1 實驗方法
電解錳陽極泥中的主要雜質為 Fe2O3、MnO、Mn2O3和CaSO4等,還有Ni、Cu等金屬的氧化物,除雜的主要反應為:
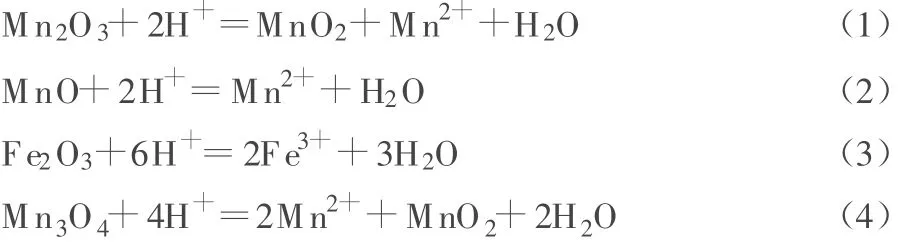
1.1.1 電解錳陽極泥的除雜活化處理
將電解錳陽極泥(重慶某電解錳廠提供)在XQM-2L型變頻行星式球磨機(南京產)上以230 r/min的轉速球磨(球料比 1∶1)40 min,制成直徑為74 μ m的顆粒;再在H2SO4(重慶產,98%)或HCl(重慶產,36.5%)的稀溶液中加入少量NaCl(重慶產,AR),按液固比 3∶1~7∶1用上述稀酸在水浴加熱的條件下浸取,進行除雜活化;酸浸取后,用NaOH(重慶產,AR)溶液中和多余的H+,按100 g電解錳陽極泥使用0.01 g的比例,添加十二烷基苯磺酸鈉(重慶產,AR);堿洗后抽濾,并用稀HCl調整溶液的pH值為 5~7,再在 105℃下烘干10 h,過200目篩,備用。
1.1.2 含量測定
電解錳陽極泥中Fe、Cu、Ni、Pb、Co和Ag的含量用 180-80型原子吸收光譜儀(日本產)根據原子吸收光譜法[4]測定;Ca、Mg含量用 EDTA滴定法[5]測定;Mn含量由硫酸亞鐵銨滴定法[6]測定;MnO2含量用草酸鈉滴定法測定[7]。
1.1.3 電池的制作及放電性能測試
將制得的MnO2按照重慶電池總廠的工藝制成R20電池,再用R20型IDS恒阻電池智能放電檢測系統(蘇州產)按GB/T 8897.2-2008《原電池第2部分:外形尺寸和電性能要求》[8]測試放電性能。
1.2 SEM分析和XRD分析
用VEGAⅡLMU型掃描電子顯微鏡(捷克產)觀察電解錳陽極泥的形貌;用6000型X射線衍射儀(日本產)分析電解錳陽極泥的物相,CuKα,波長0.154 06 nm,管壓 40 kV、管流 30 mA,掃描速度為 6(°)/min,步寬為0.02°。
2 結果與討論
2.1 處理前電解錳陽極泥的主要成分
電解錳陽極泥烘干后失水率為16.1%,主要成分見表1。
從表1可知,處理前電解錳陽極泥的雜質較多,MnO2含量較低。嚴格地說,制得的MnO2應記為MnOx,是非化學計量的化合物,屬于隧道、層狀或網狀的晶體結構[9]。從主要成分計算可知,x=1.757,說明M nO2的晶體缺陷較大,有大量雜質在MnO2結構中,因此活性不高。

表1 處理前電解錳陽極泥的主要成分Table 1 Main content of electrolytic manganese anode slime before treatment
2.2 酸浸取條件對電解錳陽極泥中MnO2含量的影響
酸浸取條件對電解錳陽極泥中MnO2含量的影響見圖1。
在液固比為5∶1、反應溫度為50℃、H2SO4和 HCl濃度分別為1 mol/L和2 mol/L的條件下,進行不同時間的除雜活化實驗。從圖1a可知:適宜的反應時間為2 h。從動力學分析,浸取時間延長,雜質的浸出率會增加,但是一定程度后,這種趨勢會變得很小。HCl除雜效果不如H2SO4的原因,可能是發生了式(5)所示的反應,導致式(1)所示反應生成的MnO2減少,因此處理后的電解錳陽極泥中MnO2含量降低。HCl易揮發,也是浸取效果不理想的一個原因。

在液固比為 5∶1、反應溫度為50℃、酸浸取時間為 2 h的條件下,進行不同酸濃度的除雜活化實驗。從圖1b可知:浸取時選擇1 mol/L H2SO4較好。當酸濃度較低時,H+的擴散速率較小;當酸濃度較高時,擴散阻力降低,H+容易進入MnO2的孔狀結構,促進雜質離子浸出。HNO3具有強腐蝕性,對設備的要求很高,還會產生NOx污染,不宜使用。
在H2SO4濃度為1 mol/L、反應溫度為50℃、酸浸取時間為2 h的條件下,進行不同液固比的除雜活化實驗。從圖1c可知:適宜的液固比為 5∶1。液固比低,溶液黏度大,浸出液易飽和,對傳質過程不利;液固比高,浸出效率降低,不僅增加資源消耗,而且廢水處理困難。

圖1 酸浸取條件對MnO2含量的影響 Fig.1 Influence of acid leaching conditions on manganese dioxide content
在H2SO4濃度為 1 mol/L、液固比為5∶1、酸浸取時間為2 h的條件下,進行不同溫度下有無NaCl[w(NaCl)=5%]的除雜活化實驗。從圖1d可知:反應溫度為50℃較好,NaCl可增加CaSO4的溶解度,促進硫酸銀等難溶物形成可溶性絡合物,更好地浸出,增加電解錳陽極泥中MnO2的含量。
在液固比為5∶1、反應溫度為50℃、酸浸取時間為2 h、w(NaCl)=5%的條件下,進行不同H2SO4濃度的除雜活化實驗。從圖1e可知:有NaCl存在時,H2SO4濃度仍以1 mol/L較合適。H2SO4濃度過高,會導致電解錳陽極泥中MnO2大幅減少,原因是H2SO4濃度較高時,發生了式(6)所示的反應,導致SO42-濃度升高,大量吸附在MnO2表面并進入孔狀結構中,降低電解錳陽極泥中MnO2的含量。

2.3 堿洗中和
表面羥基對MnO2電化學性能的影響較大[10]。電解錳陽極泥經酸洗后,溶液的pH值約為2.82,小于酸性鋅錳干電池電解液的pH值(約5.0),破壞了MnO2表面酸性羥基與堿性羥基的平衡,導致放電時電壓迅速下降,放電容量降低,因此必須加堿,中和吸附在MnO2表面的大量H+。堿濃度太高,會破壞MnO2表面兩性羥基的平衡;只進行堿洗無法很好地除去漂浮的油狀物,因此在堿洗時加入少量十二烷基苯磺酸鈉。實驗結果表明:除油效果良好,并改善了MnO2的孔狀結構。堿洗后抽濾,控制濾液的pH值為5~7。
綜上所述,最適宜的反應條件為:①酸浸取除雜時,H2SO4濃度1 mol/L,液固比5∶1,反應溫度50℃,反應時間2 h,w(NaCl)=5%;②堿洗中和時,NaOH濃度0.25 mol/L,液固比4∶1,反應溫度50℃,反應時間 1 h,添加少量十二烷基苯磺酸鈉。以下處理條件均為最適宜反應條件。
2.4 XRD分析
電解錳陽極泥的XRD圖見圖2。

圖2 處理前后電解錳陽極泥的XRD圖Fig.2 XRD patterns of electrolytic manganese anode slime before and after treatment
對比標準圖譜(JCPDS 44-0141)可知,圖 2中12.5°、17.9°、28.7°、37.4°、41.8°、49.6°及 59.9°附近的特征峰是α-MnO2的特征峰。處理后,雖然雜質峰減少,晶形不變,但MnO2的晶體結構得到改善。α-MnO2主要是 T[2×2]隧道結構,截面面積在α、β和γ型MnO2中最大[11],具有較大的離子擴散通道,若隧道結構中不含大的雜陽離子,則放電性能良好[12]。處理后,M nO2的晶胞參數為a=0.978 5 nm、b=0.978 5 nm、c=0.286 3 nm,與文獻[13]中α-MnO2類的堿硬錳礦的晶胞參數(a=0.980 nm、b=0.980 nm、c=0.286 nm)幾乎一致,近似化學式為(Ba,K,Pb)2-x(Mn,Fe,Al)8O16。夏熙等[14]發現:摻入 1.25%~5.00%的鉛會影響MnO2的放電機理,抑制電化學惰性物質Mn3O4的積累,改善MnO2的電化學性能。這可能是本工藝所得含鉛MnO2具有較好放電性能的原因之一。
2.5 處理后電解錳陽極泥的主要成分
將最適宜條件下處理后得到的電解錳陽極泥烘干,分析主要成分,結果見表2。
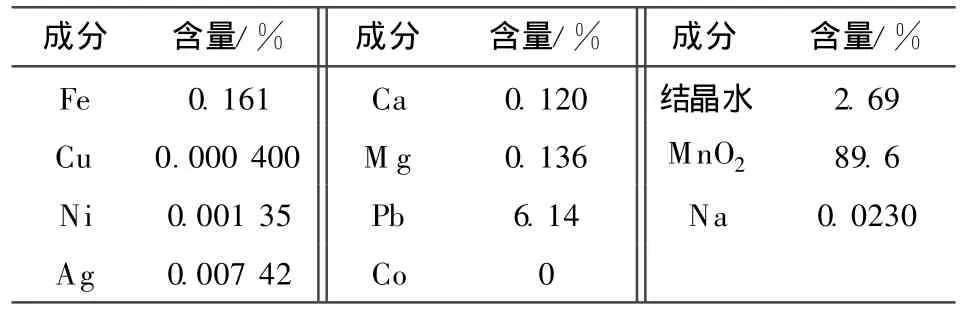
表2 處理后電解錳陽極泥的主要成分Table 2 Main content of electrolytic manganese anode slime after treatment
對比表1、表2可知:處理后MnO2含量提高,金屬雜質減少,MnOx的x增至1.999,說明晶體缺陷減少。由Nernst方程可知,x越大,半電池中MnO2的電勢越高,有利于放電。
處理后電解錳陽極泥在銨型電解液中的金屬浸出率見表3。

表3 處理后電解錳陽極泥在電解液中的金屬浸出率Table 3 Metal leaching rate of electrolytic manganese anode slime after treatment in electrolyte
從表3可知:處理后的電解錳陽極泥中,可溶性雜質金屬能夠滿足鋅錳干電池的應用要求。
2.6 電化學性能測試
將處理前后的電解錳陽極泥制成R20電池,并進行放電性能測試,結果見表4。

表4 處理前后電解錳陽極泥制成的R20電池的放電性能Table 4 Discharge performance of R20 battery produced by electrolytic manganese anode slime before and after treatment
從表4可知:處理后的5個平行樣品,電解錳陽極泥中的MnO2得到活化,加上視密度增加,吸液能力提高,最終降低了電池的極化,因此制成的電池具有良好的放電性能。平行樣品中,某些樣品的放電性能差異較大,表明電解錳陽極泥是一種復雜的物質。
2.7 SEM分析
處理前后電解錳陽極泥的SEM圖見圖3。

圖3 處理前后電解錳陽極泥的SEM圖Fig.3 SEM photographs of electrolytic manganese anode slime before and after treatment
從圖3可知,處理前,電解錳陽極泥存在嚴重的板結現象;處理后,板結現象減少,顆粒變得細小、均勻,孔隙率也有所增加,可以減小放電時的界面阻力和濃差極化,改善放電性能。
2.8 濾液的分析及回收處理
在液固比5∶1、w(NaCl)=5%、反應溫度 50℃、反應時間2 h的條件下,考察H2SO4濃度對濾液的影響,結果見圖4。

圖4 H2SO4濃度對濾液中總錳濃度的影響Fig.4 Influence of sulfuric acid concentration on total manganese concentration in filtrate
從圖4可知,H2SO4濃度取1 mol/L為宜。達到1 mol/L后,如果繼續增大H2SO4濃度,不僅對錳的浸出率影響不大,還會造成MnO2表面吸附大量H+和SO42-,對提高MnO2的性能不利。
所有濾液混合的廢液,pH值為1.38,ρMn2+=5.56 g/L,調節廢液的pH值至10.32,使Mg2+、Fe3+等金屬離子沉淀,添加MnCO3(溶液中的初始濃度為0.021 g/L)使Ca2+徹底沉淀。反應后,溶液的 pH值為 10.38,ρMn2+=0.29 mg/L,Ca2+、Mg2+、Fe3+、Pb2+和 Ag+未檢出。處理后的液體可用于工藝的堿洗環節。
3 結論
電解錳陽極泥經本工藝處理后,得到質量分數為87%~93%的活化MnO2,雖然晶型仍為α-MnO2,但晶體結構和表面特性得到改善,適合用作鋅錳干電池的正極材料。
用處理后所得 MnO2制成的 R20電池,3.9 Ω、0.9 V連放時間超過290 min。
處理后,仍有一些金屬雜質存在于所得MnO2的晶格中,可通過加壓氧化浸取來調控MnO2的晶型結構,以制備更高活性的MnO2。
致謝:本文得到重慶電池總廠楊林總工程師的大力支持,特此致謝。
[1]LIU Jian-ben(劉建本),CHEN Shang(陳上).用電解錳陽極泥和含SO2工業尾氣制備硫酸錳[J].Environmental Protection of Chemistry Industry(化工環保),2009,29(6):538-540.
[2]YANG Lin(楊林),LAI Yong(賴勇),ZHENG Wen-xiang(鄭文祥),et al.鋅錳電池產業的現狀與未來[J].Dianchi Gongye(電池工業),2009,14(6):413-415.
[3]TAO Chang-yuan(陶長元),DU Jun(杜軍),LIU Zuo-hua(劉作華),et al.一種用電解錳陽極泥制備電池原料的方法及其制品[P].CN:200910251043.6,2010-06-02.
[4]QB 2106-1995,電池用電解二氧化錳[S].
[5]GB/T 1511-2006,錳礦石鈣和鎂含量的測定EDTA滴定法[S].
[6]GB/T 1506-2002,錳礦石錳含量的測定電位滴定法和硫酸亞鐵銨滴定法[S].
[7]LIN Xiang-wei(林鄉偉).某含錳廢料在電池原料方面應用的研究[D].Nanning(南寧):Guangxi University(廣西大學),2008.
[8]GB/T 8897.2-2008,原電池第2部分:外形尺寸和電性能要求[S].
[9]Zhang J,Duan Y P,Jing H.The morphology and electromagnetic properties of M nO2obtained in 8T high magnetic field[J].J Cryst Growth,2010,312(19):2 788-2 794.
[10]Malloy A P,Browning G J,Donne S W.Surface characterization of heat-treated electrolytic manganese dioxide[J].J Colloid Interface Sci,2005,285(2):653-664.
[11]Ma R,Bando Y,Zhang L,et al.Layered M nO2nanobelts:hydrothermal synthesis and electrochemical measurements[J].Adv Mater,2004,16(11):918-922.
[12]Devaraj S,Munichandraiah N.Effect of crystallographic structure of MnO2on its electrochemical capacitance properties[J].J Phys Chem C,2008,112(11):4 409-4 416.
[13]XIA Xi(夏熙).二氧化錳及相關錳氧化物的晶體結構、制備及放電性能(Ⅰ)[J].Battery Bimonthly(電池),2004,34(6):412-414.
[14]XIA Xi(夏熙),GONG Liang-yu(龔良玉).PbO2納米粉體的固相合成及其對M nO2電極材料的改性作用[J].Acta Chimica Sinica(化學學報),2002,60(1):87-92.

