T-2毒素對體外培養兔軟骨細胞增殖活性的影響
劉 斌,陳德才
大骨節病的國際通用名稱為卡斯欽-貝克病(Kashin-Beck disease),是一種地方性、畸形性骨關節病,基本病理改變為透明軟骨變性、壞死,軟骨基質降解丟失,最后出現繼發性退行性骨關節病。T-2(trichothecene mycotoxin-2)毒素是鐮刀菌在生長過程中產生的一種有毒代謝產物,為食物中常見的污染性霉菌毒素。在大骨節病區主食(主要是面粉和玉米)中檢測到T-2毒素明顯超標,而通過換用不含超標T-2毒素的糧食對大骨節病的防治有一定效果。因此,T-2毒素可能是大骨節病的病因之一[1]。筆者通過體外試驗觀察T-2毒素對軟骨細胞增殖的影響,以探討T-2毒素致關節損傷的具體機制,為T-2毒素致大骨節病學說進一步提供理論依據。
1 材料與方法
1.1 實驗材料
奧林巴斯IX70倒置式相差/熒光顯微鏡(日本Olympus公司);HTS7000 Plus BioAssay Reader(美國PE公司);T-2毒素(Sigma公司);0.5%四甲基偶氮唑鹽(成都鴻云科技公司);二甲基亞砜(上海啟迪化工有限公司);由 L-谷氨酰胺、碳酸氫鈉組成的DMEM/F-12液體培養基(Gibco11330)。
1.2 原代細胞培養
將2周齡新西蘭白兔行頸椎脫臼處死,無菌切取四肢關節軟骨,放入4℃的雙抗液中漂洗2次,再放入4℃磷酸鹽緩沖液中漂洗2次。用眼科小剪剪成糊狀,轉入小培養瓶中。加入0.25%的胰蛋白酶5 mL,在36.7℃恒溫水浴箱中振蕩消化30 min。加入10%小牛血清10 mL終止消化,轉入10 mL離心管中,以1 000 r/min離心8 min。吸取上清液,加入含0.2%Ⅱ型膠原酶的DMEM/F-12培養基5 mL,如此反復數次,制成細胞懸液,轉入25 cm2正方斜口細胞培養瓶中。5%CO2恒溫孵箱37℃條件下培養,細胞呈貼壁生長。
1.3 軟骨細胞鑒定
Ⅱ型膠原免疫組化染色法:待爬片的軟骨細胞在蓋玻片上長滿后,倒去培養液,用磷酸鹽緩沖液沖洗,再用4%的中性甲醛固定30 min,以ABC法進行Ⅱ型膠原免疫組化染色,Ⅱ型膠原單克隆抗體作為一抗,濃度為25%。倒置顯微鏡下觀察攝影。結果Ⅱ型膠原免疫組化染色為陽性,細胞胞漿可見棕黃色顆粒,細胞核著色不明顯。
甲苯胺藍染色法:待爬片的軟骨細胞在蓋玻片上長滿后,倒去培養液,用磷酸鹽緩沖液沖洗,置于10%的中性甲醛溶液中固定過夜,再用70%的酒精固定20 min,0.04%的甲苯胺藍染色20 min,迅速用無水乙醇漂洗1次,空氣中干燥,倒置顯微鏡下觀察攝影。結果甲苯胺藍染色為陽性,細胞胞漿可見淺藍色顆粒,細胞核著色不明顯。
1.4 干預試驗
調整細胞濃度為5×104/L,按每孔200μL接于96孔板,放入5%的CO2孵箱中37℃下培養,觀察接種的軟骨細胞貼壁生長情況。48 h后,軟骨細胞完全貼壁,吸出96孔板中的原細胞培養液,分別加入質量濃度為1,10,20,100μg/L的 T-2培養液,試驗組和對照組各200μL,其中試驗組每組4個復孔,對照組每組3個復孔。培養1 d后,取出96孔板,取16孔,每孔加入20μL四甲基偶氮唑鹽溶液,接著放入5%的CO2孵箱中37℃下培養3.5 h。取出96孔板,吸出每孔中液體,再每孔加入200μL二甲基亞砜,放入5%的CO2孵箱中37℃下培養30 min。取出96孔板,反復吹打上述16孔,使結晶完全溶解,吸出每孔中的液體,轉入到另一96孔板,采用四甲基偶氮唑鹽法檢測,計算存活細胞相對數。分別于培養2,3,4,5 d時重復上述自“培養1 d后,取出96孔板……”開始的步驟。
1.5 統計學處理
所有數據均以均數±標準差(X±SD)的形式表示。應用SPSS 13.0軟件對數據進行方差分析,P<0.05表示有顯著差異。
2 結果
隨著T-2毒素質量濃度的增加,各組細胞生長抑制越來越明顯,呈濃度依賴關系;隨著作用時間的延長,T-2毒素對軟骨細胞的抑制作用也逐漸增強,呈時間依賴關系。不同質量濃度T-2毒素對軟骨細胞的抑制作用在試驗第5天時接近飽和(表1)。
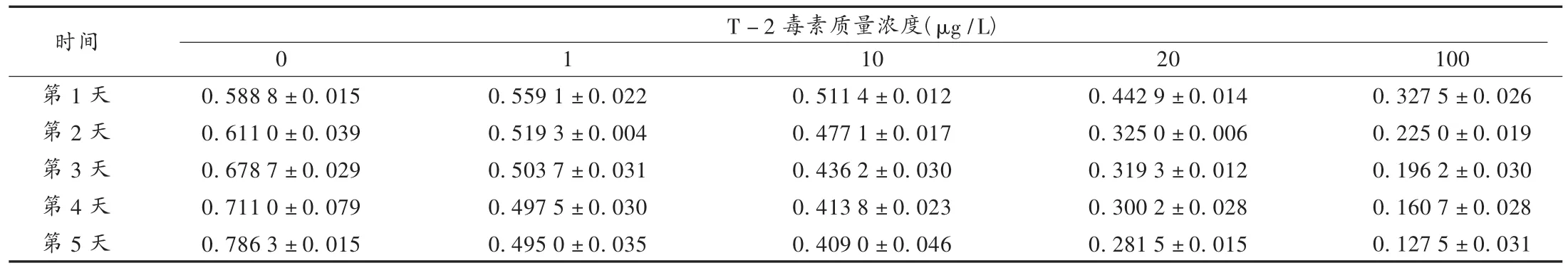
表1 不同質量濃度T-2毒素對軟骨細胞增殖的影響(X±SD)
3 討論
T-2毒素是一類單端孢霉烯族真菌毒素中有代表性的毒素,是食物中常見的污染性霉菌毒。自1967年Manning和Bonner利用胰蛋白酶和膠原酶將軟骨細胞從軟骨基質中分離出來后,研究者應用體外培養的軟骨細胞在關節軟骨疾病的發病機理方面進行了很多探索[2]。筆者用2周齡新西蘭幼兔關節軟骨成功培養了軟骨細胞,并觀察了T-2毒素對軟骨細胞增殖的影響。結果T-2毒素質量濃度越高,軟骨細胞增殖受抑制程度越重,主要原因是T-2毒素質量濃度越高,對軟骨細胞DNA與蛋白質合成影響越大。另外,試驗表明T-2毒素對軟骨細胞的抑制作用在第5天時達到飽和,具體原因尚不清楚。但該試驗至少說明,T-2毒素對軟骨細胞體外最佳干預時間為5 d。根據試驗結果推測,T-2毒素在大骨節病關節病變的形成中起著一定作用。
[1]楊建伯.大骨節病病因研究報告[J].中國地方病學雜志,1995,14(4):201-204.
[2]Gibson GJ,Verner JJ,Nelson FR,et al.Degradation of the cartilage collagen matrix associated with changes in chondrocytes in osteoarthrosis.Assessment by loss of background fluorescence and immunodetection of matrix components[J].Journal of Orthopaedic Research,2001,19(1):33-42.

