釀酒酵母SC408轉化3-甲硫基丙醇條件的研究
侯 晟, 趙 磊, 楊雪蓮, 王成濤
關于酵母菌轉化3-甲硫基丙醇已有一些報道.Castillo-lozano等[8]對5株酵母菌進行搖瓶培養,48 h后發現有少量3-甲硫基丙醇生成;Buzzini等[9]從37株擔子菌酵母(basidiomycetous yeasts)中發現有10株能夠轉化氨基酸生成3-甲硫基丙醇,恒溫25℃,40 r/min搖床培養72 h,產量為0.04~0.40 g/L;Etschmann等[10]研究了釀酒酵母CEN.PK113-7D補料分批發酵條件,在5 L發酵罐中26~36 h向罐中流加葡萄糖,最終在64 h獲得3.5 g/L的3-甲硫基丙醇.本研究利用篩選獲得的一株產3-甲硫基丙醇的酵母菌,通過均勻試驗設計優化其培養基和轉化條件,希望為微生物轉化生產天然香料3-甲硫基丙醇提供技術支持.
1 材料與方法
1.1 材料
甲醇、乙腈為色譜純,美國Fisher公司;氨基酸,天津市光復精細化工研究所;產香釀酒酵母Saccharomyces cerevisiae SC408由中國農業大學惠贈;酵母膏,北京奧博星生物技術有限責任公司;其他試劑均為分析純.
1.2 儀器設備
Waters 2695型四元高效液相色譜儀,2996型光電二極管陣列檢測器,SunFireTMC18(5μm,4.6×150 mm)色譜柱,美國Waters公司.
1.3 HPLC分析方法
流動相為乙腈:水.梯度洗脫條件:2%乙腈,2 min;2% ~12%乙腈,2 min;12% ~40%乙腈,5 min;40%~50%乙腈,3 min;50% ~2%乙腈,2 min;2%乙腈,2 min;流速1 mL/min;柱溫30℃;檢測波長210 nm;進樣量10μL.
1.4 培養基的制備
種子培養基:葡萄糖2%,蛋白胨2%,酵母膏1%(斜面固體培養基另加2%瓊脂).
培養基Ⅰ:根據前期試驗摸索,設計培養基成分均勻設計方案,如表1中各試驗號.
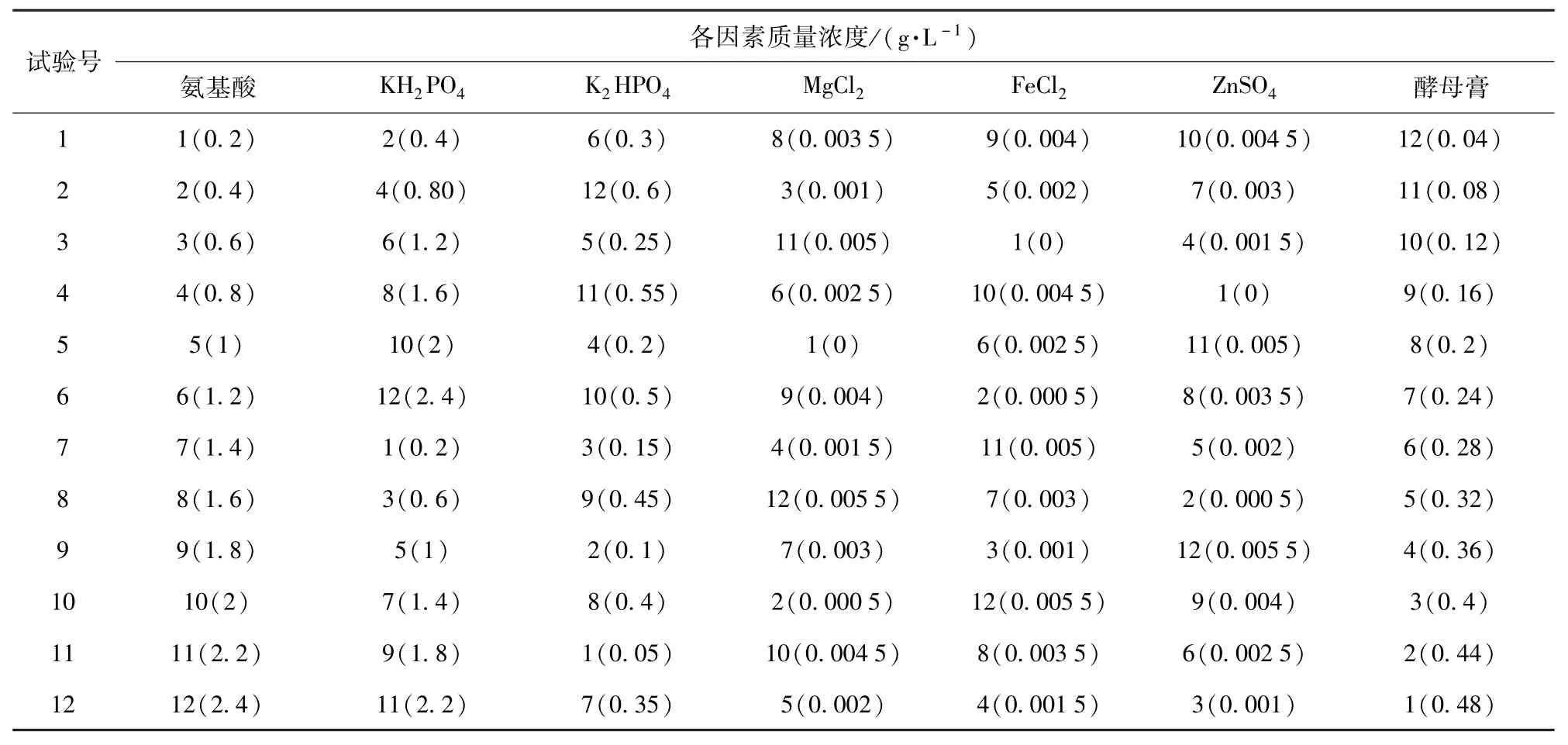
表1 培養基組分均勻設計方案Tab.1 Design proposal of fermentation on media
將一定量的氨基酸、KH2PO4、K2HPO4、MgCl2、FeCl2、ZnSO4和酵母膏溶于100 mL去離子水中,置于121℃滅菌20 min,冷卻后,倒入已滅菌的含有1 g葡萄糖和0.8 g NaCl的250 mL三角瓶中,混勻即為各試驗號發酵用培養基.每個試驗號2組平行.
培養基Ⅱ:按表1中試驗號為2的成分配制,操作同上.
培養基Ⅲ(100 mL):氨基酸0.4%、KH2PO40.8%、K2HPO40.6%、MgCl20.001%、FeCl20.002%、ZnSO40.003%和酵母膏0.08%溶于裝有100 mL去離子水的250 mL三角瓶中,置于121℃滅菌20 min,冷卻后倒入裝有按表2設計的已滅菌葡萄糖和NaCl的250 mL三角瓶中,混勻,即為各試驗號發酵用培養基.每個試驗號2組平行.
1.5 培養優化方法
1.5.1培養基組分的均勻試驗設計方案
根據前期發酵試驗結果,從斜面種子培養基挑取1環接種于上述“培養基Ⅰ”中,30℃,200 r/min搖床培養,分別于60,72和84 h取樣,HPLC檢測.
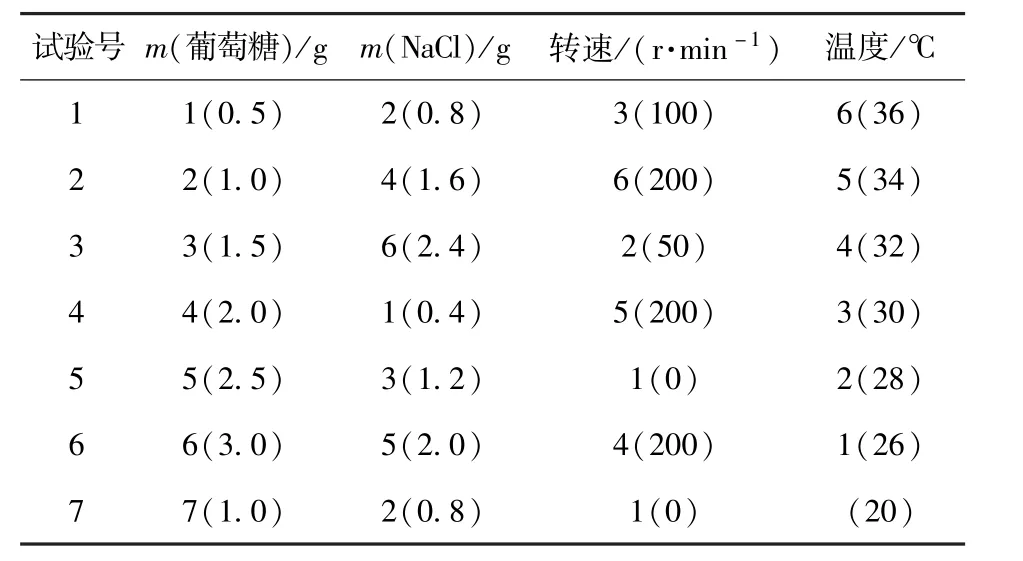
表2 培養條件均勻設計方案Tab.2 Design proposal of fermentation condition
1.5.2接種量對3-甲硫基丙醇發酵和氨基酸轉化率的影響實驗
按照2.4培養基的制備方法制備培養基,將30℃,200 r/min搖床培養24 h的種子培養液按5%和10%分別接種于“培養基Ⅱ”中,同時分別挑取1環、2環和5環的固體斜面種子接種于“培養基Ⅱ”中,30℃,200 r/min搖床培養,在12,24,48,60,72和84 h分別取樣,HPLC檢測.
1.5.3培養條件對3-甲硫基丙醇發酵的影響實驗
按照1.4培養基的制備方法制備培養基,將30℃,200 r/min搖床培養24 h的種子培養液按5%接種于各“培養基Ⅲ”中,按表2培養條件進行培養發酵,在48,60和72 h分別取樣,然后從搖床取出在室溫靜置培養,分別于140和384 h取樣,HPLC檢測.
1.5.4優化條件的驗證實驗
按照1.4培養基的制備方法制備培養基,將30℃,200 r/min搖床培養24 h的種子培養液按5%接種于“培養基Ⅲ”中較優一組,30℃,200 r/min搖床培養,在12~132 h間每12 h取樣(分兩批,一批前72 h取樣,一批后60 h取樣),HPLC檢測,并測定生物量.
1.6 發酵液的處理及生物量的測定
將發酵液8 000 r/min離心10 min,上清液用0.45μm微孔濾膜過濾得液相色譜待測樣液,沉淀物置于105℃干燥箱,干燥至恒重,稱量即得生物量.
2 結果與分析
2.1 培養基組分優化結果
培養基組分的均勻設計試驗結果如圖1,除7號試樣外,其余各試驗號發酵液3-甲硫基丙醇濃度在0.70~0.89 g/L,但達到峰值的時間不同,2,3,4,5,8,9,10和11號試樣在60 h達到峰值,1和6號試樣在84 h達到峰值,7號試樣隨著發酵時間的延長產物濃度在升高,但其峰值僅為0.54 g/L.為縮短發酵時間,提高氨基酸轉化率,選擇2號培養基作為后續試驗的基礎培養基.
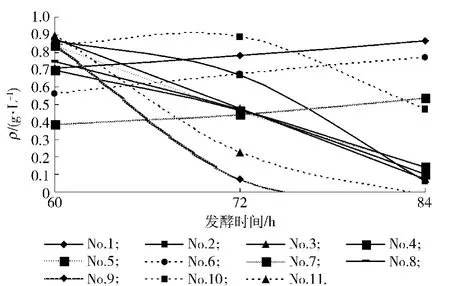
圖1 培養基組分優化試驗3-甲硫基丙醇生成的動態曲線Fig.1 Dynamic curve of accumulation of methionol on media optimization
培養基組分優化均勻設計試驗各因素多元線性回歸參數分析結果如表3.表3表明,在初始葡萄糖質量濃度為10.0 g/L時,3-甲硫基丙醇濃度與KH2PO4、ZnSO4和酵母膏的濃度呈正相關,與K2HPO4,MgCl2和FeCl2的質量濃度負相關,但與氨基酸濃度無關,提示其氨基酸是過量添加.
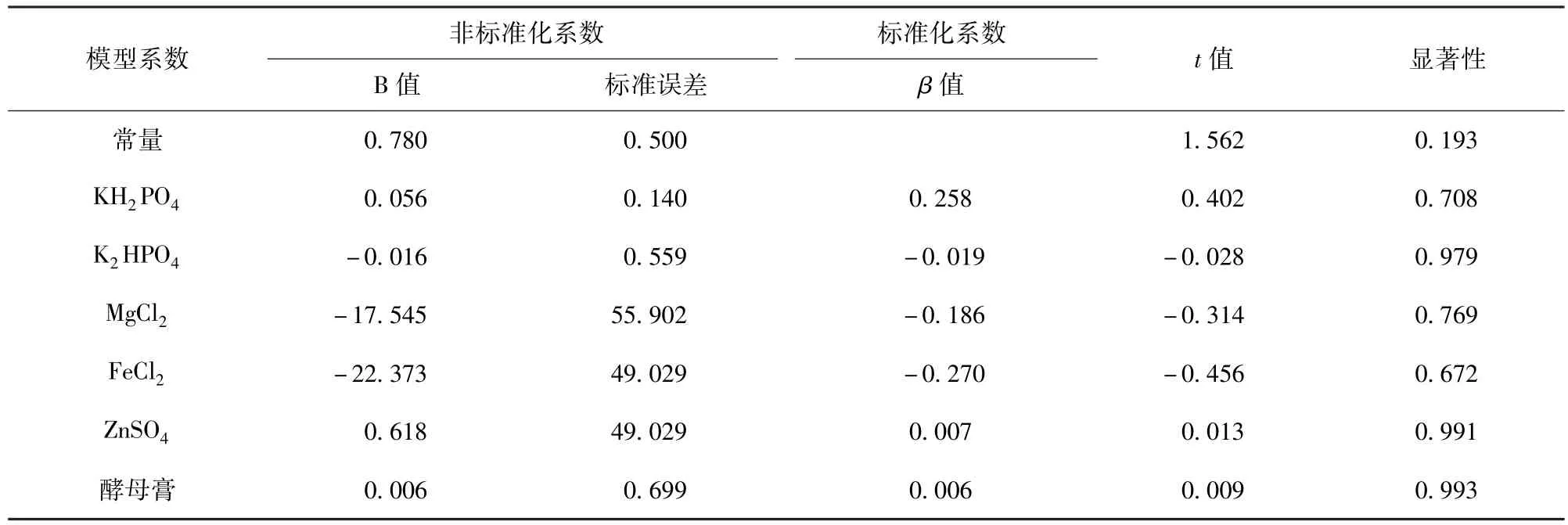
表3 培養基組分均勻設計試驗各因素多元線性回歸參數分析Tab.3 Parameters of linear aggression on media proportion optimization
2.2 接種量對3-甲硫基丙醇發酵的影響
接種量對3-甲硫基丙醇發酵的影響見圖2.圖2可以看出,接種量對3-甲硫基丙醇的峰值影響不大(維持在0.9~1.1 g/L),但峰值出現的時間不同.接種5環的試樣在48 h達到峰值,接種1環、2環、5%和10%的試樣在60 h達到峰值,5%接種量試驗組生成的目標產物濃度最高(P<0.05),因此后續試驗中選擇5%接種量.
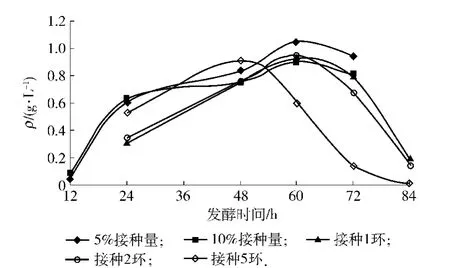
圖2 接種量對3-甲硫基丙醇發酵的影響Fig.2 Effect of inoculation amounts on 3-(methylthio)-1-propanol accumulation
2.3 培養條件對3-甲硫基丙醇發酵的影響
培養條件對3-甲硫基丙醇發酵的影響結果見圖3.圖3顯示,4號和6號試驗組的3-甲硫基丙醇濃度明顯高于其他試驗組,這兩組產量的發酵條件發現,其初始葡萄糖質量濃度都大于等于20.0 g/L,轉速也較高(200 r/min),因此,高含量的葡萄糖有利于菌體生長和3-甲硫基丙醇累積,高溶氧量有利于3-甲硫基丙醇的累積,溫度適中有利于3-甲硫基丙醇的生成.
2.4 優化條件的驗證結果
優化條件下發酵底物、目的產物和生物量的同步生長關系見圖4.由圖4可見,隨著發酵時間延長,3-甲硫基丙醇濃度與生物量同步增長(圖4;r=0.94,P<0.05),表明3-甲硫基丙醇隨著菌體細胞生長而不斷累積,在132 h達到1.6 g/L;氨基酸的摩爾轉化率約為72%;從氨基酸的消耗量來看,補料流加氨基酸后,3-甲硫基丙醇仍會繼續生成.
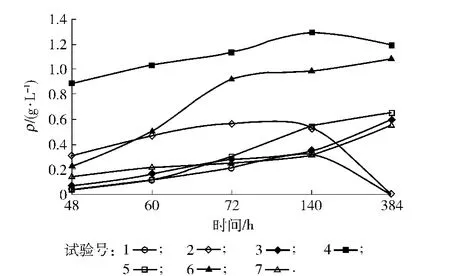
圖3 培養條件對3-甲硫基丙醇發酵的影響Fig.3 Effect of concentration of methionol on different cultivation condition
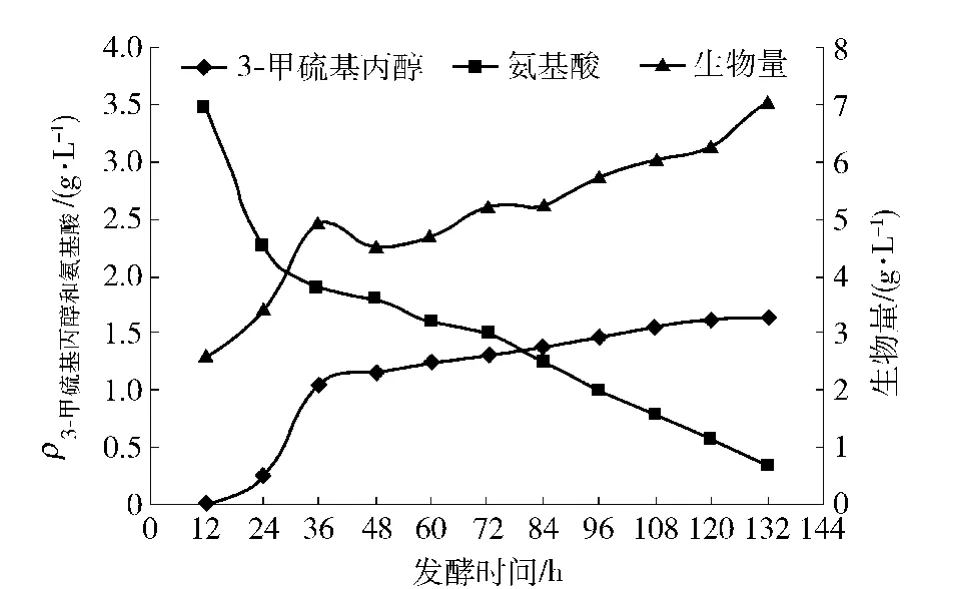
圖4 優化條件下發酵底物、目的產物和生物量的同步生長關系Fig.4 Optimized results of concentration of amino acid,methionol and biomass with fermentation time
3 結 論
通過均勻試驗設計優化Saccharomyces cerevisiae SC408的培養基組分為:氨基酸4.0 g/L、KH2PO48.0 g/L、K2HPO46.0 g/L、MgCl20.01 g/L、FeCl20.02 g/L、ZnSO40.03 g/L、酵母膏 0.8 g/L、葡萄糖30.0 g/L和NaCl 2.0 g/L;研究了接種量和培養條件對3-甲硫基丙醇產生的影響,在搖床培養30℃,轉速200 r/min,132 h時3-甲硫基丙醇的產量達到1.6 g/L,氨基酸的摩爾轉化率約為72%.同時,研究發現若控制好底物中葡萄糖濃度和氨基酸濃度,3-甲硫基丙醇的終產物濃度還會繼續升高,為今后分批-補料發酵的擴大試驗提供有力的支持.
參考文獻:

