腎透明細(xì)胞癌miRNA-34a、Notch1和Hes1的表達(dá)及意義
楊 陽,崔蘇萍,婁遠(yuǎn)蕾,謝 安,郭 菲,張明飛,汪 泱*
(1南昌大學(xué)研究生院醫(yī)學(xué)部,南昌330006;2南昌大學(xué)第一附屬醫(yī)院;3南昌大學(xué)第一附屬醫(yī)院泌尿外科研究所;4南昌大學(xué)第一附屬醫(yī)院燒傷研究所)
研究表明,許多miRNA與腫瘤的發(fā)生、發(fā)展、轉(zhuǎn)歸等有密切關(guān)系,在其中發(fā)揮癌基因或抑癌基因的作用[1,2]。Notch信號通路是進(jìn)化上十分保守的信號通路,在細(xì)胞分化、增殖、凋亡、黏附、遷移及血管形成等方面都起到了十分重要作用,而異常的Notch信號途徑與許多腫瘤的發(fā)生有關(guān)。已有研究表明,miRNA-34a的靶基因?yàn)镹otch1。目前Notch信號通路與腎癌的關(guān)系不明確,與Notch信號通路相關(guān)的miRNA在腎癌中的研究也未見報(bào)道。本實(shí)驗(yàn)通過觀察比較miRNA-34a、Notch1和Hes1在腎透明細(xì)胞癌組織與癌旁正常組織的表達(dá)差異,探討其與腎癌發(fā)生發(fā)展的關(guān)系及可能的臨床意義。
1 資料與方法
1.1 臨床資料 選擇2009年9月~2011年1月在南昌大學(xué)第一附屬醫(yī)院泌尿外科行腎臟切除術(shù)患者的腎癌組織及其癌旁組織(規(guī)定距癌組織5cm以上)并保存于液氮中。取術(shù)后病理切片證明病理分型為腎透明細(xì)胞癌的病理組織共計(jì)48份。其中患者男31例、女17例,年齡21~75歲、平均52.5歲。手術(shù)方式:腎根治術(shù)41例(85.42%),腎部分切除術(shù)7例(14.58%)。腫瘤按TNM(2002 AJCC)分期:Ⅰ期38例,Ⅱ期8例,Ⅲ期1例,Ⅳ期1例。按Fuhrman分級:1級24例,2級24例。腫瘤長徑1.5~9.5cm,平均 4.43cm。
1.2 方法
1.2.1 RNA的提取 采用液氮研磨法將組織磨成粉末,加入Trizol按試劑說明書提取總RNA。
1.2.2 總RNA純度和濃度的檢測 使用超微量紫外分光光度計(jì)測定RNA濃度和純度,記錄OD260值。RNA純度檢測:RNA溶液的OD260/OD280的比值(比值范圍1.8~2.1為純度合格)。樣品RNA濃度計(jì)算公式為:OD260×40×稀釋倍數(shù)(ng/μl)。所提RNA -80℃保存?zhèn)溆谩?/p>
1.2.3 逆轉(zhuǎn)錄 按Fermentas逆轉(zhuǎn)錄說明書操作。miRNA-34a用miRNA-34a莖環(huán)引物逆轉(zhuǎn)錄,其余用隨機(jī)引物逆轉(zhuǎn)錄。miRNA-34a莖環(huán)引物見表1。

表1 RT、PCR引物序列
1.2.4 實(shí)時熒光定量PCR 按試劑盒說明書操作,分別以U6和GAPDH為miRNA和mRNA的內(nèi)參。引物由上海生工生物工程公司合成。引物序列及PCR產(chǎn)物片斷大小見表1。數(shù)據(jù)采用2-△△CT法進(jìn)行分析。變化倍數(shù)大于2為高表達(dá),小于0.5為低表達(dá),兩者之間為無差別。
1.3 統(tǒng)計(jì)學(xué)方法 采用SPSS17.0統(tǒng)計(jì)軟件,數(shù)據(jù)用±s表示,比較采用配對樣本t檢驗(yàn)和兩樣本t檢驗(yàn),各指標(biāo)間關(guān)系采用Spearman等級相關(guān)分析。P≤0.05為有統(tǒng)計(jì)學(xué)意義。
2 結(jié)果
2.1 腎癌組織及癌旁正常組織中 miRNA-34a、Notch1、Hes1的表達(dá) 48份標(biāo)本中有33份腎癌標(biāo)本miRNA-34a高表達(dá),8例低表達(dá),7例無差別;36份腎癌標(biāo)本Notch1低表達(dá),3例高表達(dá),9例無差別;31份腎癌標(biāo)本Hes1低表達(dá),9例高表達(dá),8例無差別。與癌旁正常腎組織相比,腎癌組織miRNA-34a、Notch1、Hes1 總的表達(dá)變化倍數(shù)分別為 4.093±3.661、0.497±0.724、0.498±0.872,均有統(tǒng)計(jì)學(xué)差異(P <0.05)。
2.2 miRNA-34a、Notch1、Hes1 的表達(dá)與腎癌臨床病理參數(shù)間的關(guān)系 見表2。
2.3 腎癌組織中miRNA-34a與Notch1、Hes1的相關(guān)性 Spearman相關(guān)分析顯示,腎癌組織中miRNA-34a與 Notch1、Hes1之間呈負(fù)相關(guān)(rs分別為-0.427、-0.549,P 均 <0.05),Notch1 和 Hes1 之間呈正相關(guān)(rs=0.540,P <0.05)。
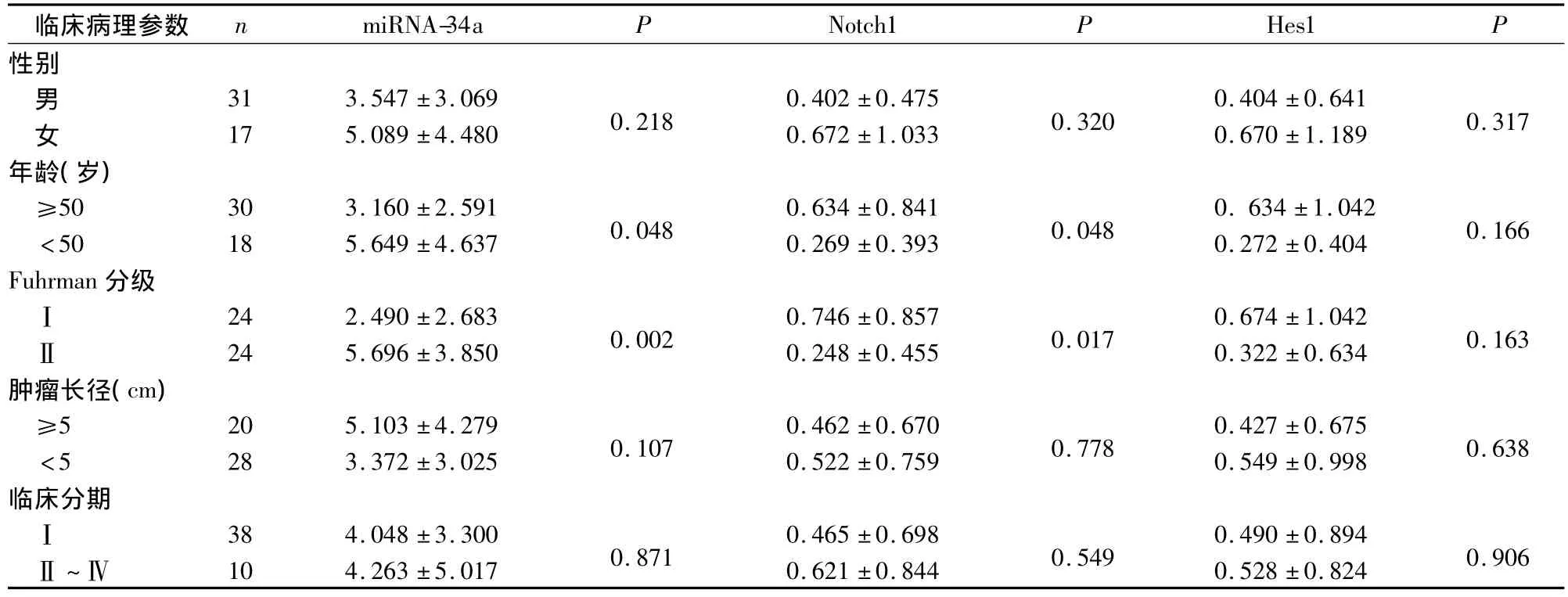
表2 miRNA-34a、Notch1、Hes1的表達(dá)與臨床病理參數(shù)間的關(guān)系
3 討論
miRNA-34a是抑癌基因p53的一個靶基因,作為抑癌基因的miRNA-34a除了協(xié)同p53促進(jìn)細(xì)胞凋亡外,還通過調(diào)控 cyclinE、CDK4、E2F1和 E2F3蛋白表達(dá)水平參與調(diào)控細(xì)胞周期的G1阻滯[3]。已有研究表明,miRNA-34a在不同的腫瘤中有不同的表達(dá)情況。在惡性膠質(zhì)瘤中,miRNA-34a是低表達(dá)的,通過靶基因C-met、Notch1和Notch2抑制大腦腫瘤生長,作為抑癌基因的miRNA-34a在神經(jīng)母細(xì)胞瘤中也是低表達(dá)的。Dutta等[4]證實(shí),miRNA-34a在氧化應(yīng)激誘導(dǎo)的大鼠腎癌、宮頸癌的細(xì)胞系hela細(xì)胞和乳腺癌的mcf-7細(xì)胞中表達(dá)均明顯升高,并證實(shí)miRNA-34a能促進(jìn)腫瘤細(xì)胞的增殖。對miRNA-34a進(jìn)行基因敲除后,腎癌細(xì)胞的增殖被抑制,從而表明miRNA-34a的過度表達(dá)在腎癌的發(fā)生過程中起到了重要作用。本研究48份標(biāo)本中有33份腎癌標(biāo)本miRNA-34a高表達(dá)。與已報(bào)道[5]的腎癌組織芯片結(jié)果相一致,提示miRNA-34a在腎透明細(xì)胞癌中作為癌基因起作用。
Notch信號通路由 Notch受體、Notch配體和DNA結(jié)合蛋白組成。當(dāng)Notch受體和相鄰細(xì)胞的配體結(jié)合后,Notch被蛋白酶兩次切割,釋放出具有核定位信號的胞內(nèi)區(qū),后者進(jìn)入細(xì)胞核與DNA結(jié)合蛋白結(jié)合,調(diào)節(jié)靶基因表達(dá),進(jìn)而調(diào)控細(xì)胞的生長和分化等。越來越多的證據(jù)表明,異常的Notch信號與一些人類腫瘤的發(fā)生發(fā)展相關(guān),但在不同腫瘤細(xì)胞中的具體表現(xiàn)又有明顯不同。Notch信號途徑在腫瘤細(xì)胞中具有雙重特性,起癌基因或抑癌基因作用,如結(jié)腸癌、腦腫瘤、乳腺癌等人類實(shí)體瘤中均發(fā)現(xiàn)Notch1蛋白高表達(dá)起癌基因作用。而Hanlon等[6]則提出在胰腺導(dǎo)管腺癌模型中,Notch1作為抑癌作用促進(jìn)腫瘤的發(fā)生發(fā)展。目前Notch信號與腎癌的關(guān)系尚不十分明確,Sjulund等在腎癌細(xì)胞株中測得Notch通路各組成蛋白存在并且高表達(dá);Notch1和Hes1在腎透明細(xì)胞癌組織中的表達(dá)高于在正常腎組織中的表達(dá)。Sun等研究結(jié)果表明,與其相應(yīng)的癌旁組織相比,Notch1在腎癌組織中低表達(dá),且與臨床分期有關(guān)。Hes1是堿式螺旋—環(huán)—螺旋轉(zhuǎn)錄因子家族的成員。作為Notch信號通路的下游基因之一,受Notch信號的正調(diào)控,其表達(dá)與Notch1表達(dá)相一致。本研究結(jié)果表明,Notch1、Hes1表達(dá)都是下調(diào)的,并且兩者呈正相關(guān)。
Pang等研究證實(shí) miRNA-34a的靶基因是Notch1和jag-1。通過轉(zhuǎn)染證實(shí),miRNA-34a對細(xì)胞的增殖無影響,但可通過下調(diào)靶基因Notch1和jag-1抑制細(xì)胞的侵襲。而Li等研究表明miRNA-34a通過靶基因C-met、Notch1和 Notch2可促進(jìn)惡性膠質(zhì)瘤的細(xì)胞增殖。本研究發(fā)現(xiàn),miRNA-34a隨著腎癌病理分級的增高而增高,Notch1的表達(dá)則隨著腎癌病理分級的增高而降低;而且Hes1在腎癌組織中也是低表達(dá);提示Notch信號通路可能經(jīng)由高表達(dá)的miRNA-34a下調(diào)其靶基因Notch1參與腎透明細(xì)胞癌的發(fā)生發(fā)展。高表達(dá)的miRNA-34a有望成為腎癌診斷的分子標(biāo)志物及潛在的治療靶點(diǎn)。本研究還發(fā)現(xiàn),miRNA-34a和Notch1的表達(dá)水平與年齡有關(guān),因干擾因素太多,其具體的作用機(jī)制及可能的意義有待進(jìn)一步研究。
[1]Liu J,Valencia-Sanchez MA,Hannon GJ,et al.MicroRNA dependent localization of targeted mRNAs to mammaliam P-bodies[J].Nat Cell Biol,2005,7(7):719-723.
[2]Zhang B,Pan X,Cobb GP,et al.MicroRNAs as oncogenes and tumor suppressors[J].Dev Biol,2007,302(1):1-12.
[3]He L,He XY,Lim LP,et al.A microRNA component of the p53 tumour suppressor network[J].Nature,2007,447(7148):1130-1134.
[4]Dutta KK,zhong Y,Liu YT,et al.Association of microRNA-34a overexpression with proliferation is cell typer-dependent[J].Cancer Sci,2007,98(12):1845-1852.
[5]Juan D,Alexe G,Antes T,et al.Identification of a MicroRNA panel for clear-cell kidney cancer[J].Urology,2010,75(4):835-841.
[6]Hanlon L,Avila JL,Demarest RM,et al.Notchl functions as a tumor suppressor in a model of K-ras-induced pancreatic ductal adenocarcinoma[J].Cancer Res,2010,70(11):4280-4286.

