補體C3、C4在復發性自然流產發病機制中作用的探討
張新宇,李晶晶
(1.大連醫科大學 附屬第一醫院 婦產科,遼寧 大連 116011; 2.河南科技大學 第一附屬醫院 婦產科,河南 洛陽 471003)
隨著臨床免疫學的發展,免疫因素在自然流產中的作用日益受到關注。本研究通過檢測復發性自然流產 (recurrent spontaneous abortion,RSA) 患者血清和絨毛組織中補體C3、C4水平,以探討補體C3、C4在RSA致病機制中的作用。
1 資料與方法
1.1 研究對象
選擇2009年6月~2010年2月在大連醫科大學附屬第一醫院就診,有RSA史的患者30例為研究組。其中,15例未孕者為研究組Ⅰ,平均年齡(31.6±4.5)歲,孕次(2.9±0.8)次,就診時間距末次流產時間均>6個月;15例就診時診斷為難免流產者,列為研究組Ⅱ,平均年齡(30.5±4.2)歲,孕次(2.7±1.3)次,平均孕齡(61.0±11.1)d。選取同期就診無自然流產史的女性30例為對照組。其中,15例為健康體檢的已婚女性,列為對照組Ⅰ;15例為正常早期妊娠要求行人工流產者,為對照組Ⅱ。兩組平均年齡、孕次及孕齡差異均無顯著性意義。所有入選對象均已排除夫妻雙方染色體異常、內分泌疾病、血型不合、感染、男方精液異常等因素。
1.2 實驗方法
兩組患者空腹時經肘靜脈采血3 mL,分離出血清后置于-80℃冰箱中凍存,采用電化學發光免疫法測定血清標本補體C3、C4值;于清宮術和人工流產術中獲得研究組Ⅱ和對照組Ⅱ絨毛組織,制備成石蠟切片,采用快捷型免疫組織化學法測定蛻膜和絨毛組織補體C3、C4蛋白表達,并按照陽性范圍和陽性強度進行半定量評分[1]:無陽性著色的細胞為0分,陽性范圍<25%為1分,26~50%為2分,51~75%為3分,>75%為4分;陽性強度弱(低倍鏡下可疑陽性,高倍鏡下明確陽性)為1分,陽性強度中等(低倍鏡下陽性)為2分,強陽性(低倍鏡下明確陽性)為3分,極強陽性(低倍鏡下強陽性)為4分。將著色范圍的計分與著色強度的計分相乘作為總計分,總計分0分為陰性;1~3分為弱陽性;4~9分為陽性;≥10分為強陽性。陽性范圍和強度的評分相乘,即為該例的陽性積分;每組陽性積分總和除以例數,為該組陽性強度平均積分。
1.3 統計學方法
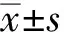
2 結 果
2.1 血清補體C3、C4測定結果
研究組血清C3、C4值明顯高于對照組(P<0.05),見表1。研究組Ⅱ血清C3、C4值明顯高于對照組Ⅱ(P<0.05),見表2。

表1 研究組和對照組血清C3、C4測定結果

表2 各組間血清C3、C4測定結果
2.2 絨毛中補體C3、C4的表達部位
研究組Ⅱ絨毛組織可見補體C3在合體滋養細胞、細胞滋養細胞及間質細胞的細胞膜和細胞漿都有大量表達(圖1);對照組Ⅱ絨毛組織可見補體C3少量表達于合體滋養細胞、細胞滋養細胞的細胞膜和細胞漿,間質細胞無表達(圖2)。
研究組Ⅱ絨毛組織補體C4在合體滋養細胞、細胞滋養細胞及間質細胞的細胞漿中都有大量表達(圖3);對照組Ⅱ絨毛組織補體C4少量表達于合體滋養細胞的細胞漿,細胞滋養細胞及間質細胞均無表達(圖4)。
2.3 補體C3、C4在絨毛組織表達的半定量分析
研究組Ⅱ補體C3和 C4表達均高于對照組Ⅱ(P<0.05),見表3、表4。

圖1 研究組Ⅱ絨毛C3沉積(IHC ×400)

圖2 對照組Ⅱ絨毛C3沉積(IHC ×400)

圖3 研究組Ⅱ絨毛C4沉積(IHC ×400)

圖4 對照組Ⅱ絨毛C4沉積(IHC ×400)
表3 補體C3在絨毛組織表達的半定量分析
Tab 3 The semiquantitative analysis result of complement C3 express in villus

表3 補體C3在絨毛組織表達的半定量分析
組別總例數強陽性陽性弱陽性陽性強度平均積分研究組II158(53.3)6(40.0) 1(6.7)10.1±4.9對照組II1505(33.3)10(66.7) 2.2±1.4
表4 補體C4在絨毛組織表達的半定量分析
Tab 4 The semiquantitative analysis result of complement C4 express in villus

表4 補體C4在絨毛組織表達的半定量分析
組別總例數強陽性陽性弱陽性陽性強度平均積分研究組Ⅱ156(40.0)4(26.7) 5(33.3)6.6±5.3對照組Ⅱ1502(13.3)13(86.7)1.7±1.0
3 討 論
補體是存在于人體和動物血清、組織液,經活化后具有酶活性的蛋白質,在病原體微生物入侵或異體抗原存在時,補體的各成分便照一定的順序發生酶促反應,形成放大的級聯效應,稱為補體激活。補體激活能直接損傷滋養細胞,補體激活后產生的裂解成分,能夠使中性粒細胞和單核巨噬細胞聚集并活化,進一步對胚胎組織造成損傷[2]。補體的這種生理特性,使其在細胞免疫和體液免疫介導的胎兒損傷中發揮重要作用。在人體中C3含量最高,C4僅次于C3,C3在補體系統激活過程起著樞紐作用[3]。
3.1 補體與正常妊娠
在生理條件下,補體激活能夠產生一系列補體裂解片段,這些裂解片段能夠促進炎癥細胞趨化,增強中性粒細胞和單核細胞的吞噬作用,使機體抵御病原體能力增強,保護正常妊娠,但是母體胎兒界面上過度的、不受調控的補體激活能夠導致胎兒死亡[4]。正常妊娠婦女體內也有潛在的補體激活,但是卻沒有發生自然流產,這是因為體內存在一系列調節蛋白,稱為補體調節蛋白(Regulator of complement activation,RCA),RCA主要有三種:膜輔助蛋白、衰變加速因子和保護素,它們是機體為逃避補體介導的自身同源殺傷而分泌的一系列結合蛋白,能夠協同調控補體轉化酶的組裝和穩定性,調節生理狀態下的補體激活[5]。在正常妊娠狀態下,胎盤不易受到補體介導的免疫損傷,其補體激活也不容易被直觀的監測,因為RCA能夠調節正常狀態下的補體激活,使補體激活狀態在短時間恢復平衡[6]。本實驗發現:正常早期妊娠者血清補體C3、C4值和正常未妊娠者血清補體C3、C4值相比差異無顯著性意義 (P>0.05),說明正常妊娠狀態下,補體激活處于機體可調控范圍內,這可能與RCA的作用密切相關,使妊娠得以維持。
3.2 補體與復發性自然流產
有研究表明有復發性自然流產(recurrent spontaneous abortion,RSA)史的婦女,妊娠即將流產時,血清補體C3、C4水平較正常妊娠婦女顯著升高,有學者提出補體顯著升高是RSA婦女即將流產的預警器[7],因此有學者提出在免疫因素所致的胎兒損傷中,補體機制處于中心地位[8]。Holers VM等[9]研究發現:利用C3轉化酶抑制劑或應用基因技術去
除孕鼠補體C3的表達基因,能夠避免孕鼠發生抗磷脂抗體介導的妊娠丟失和胎兒宮內生長受限。抗磷脂抗體通過補體經典途徑激活補體系統,產生C3a、C5a等補體裂解片段,這些裂解片段能吸引炎癥細胞聚集至胚胎組織,例如單核巨噬細胞、中性粒細胞。炎癥細胞的聚集從而引起補體旁路途徑的激活,引起補體激活級聯反應,發生補體過度激活反應,同時進一步引起炎癥細胞聚集,形成促炎癥反應環。一些研究發現胚胎死亡的孕婦體內補體水平明顯高于正常孕婦,認為這一結果導致母體血液中產生了大量的補體C3,大量的炎癥細胞聚集至胚胎組織,從而導致胚胎死亡[10,11]。本研究發現:難免流產者血清補體C3、C4值顯著高于正常妊娠者(P<0.05),說明難免流產者體內出現了補體水平異常情況,補體存在過度激活的可能性,與上述作者研究結果一致,由此推測補體過度激活可能是RSA的免疫學發病機制之一。
3.3 補體在絨毛組織中的表達意義
免疫學觀點認為補體在組織中的表達,意味著出現了補體激活。Jaime M等[12]用免疫組織化學的方法對47例抗磷脂抗體綜合征產婦和29例正常妊娠產婦的胎盤補體C3、C4沉積量進行研究:研究發現兩組胎盤均有補體表達,但是前者胎盤中補體C3、C4表達量顯著大于后者,補體C3表達于胎盤絨毛細胞的細胞漿中,補體C4表達于胎盤滋養細胞和基底膜的細胞漿中。Asherson RA等[11]認為RSA患者機體產生了大量的補體C3,同樣也伴隨著補體C3大量沉積于靶組織,胚胎組織是補體沉積的靶目標之一。本實驗結果發現:難免流產絨毛組織補體C3大量表達于細胞滋養細胞、合體滋養細胞及間質細胞的細胞膜和細胞漿;補體C4大量表達于以上三種細胞的細胞漿。正常妊娠絨毛組織補體C3主要表達于細胞滋養細胞、合體滋養細胞的細胞膜和細胞漿,補體C4主要表達于合體滋養細胞的細胞漿。根據染色強度和染色范圍進行半定量評分,難免流產絨毛組織中補體C3、C4表達顯著高于正常妊娠絨毛組織(P<0.05),這一結果與Jaime M等[12]研究結果基本一致。本實驗亦發現正常妊娠絨毛組織也存在補體C3、C4沉積,說明正常妊娠狀態下也存在一定程度的補體激活,補體激活程度在機體可調控的范圍內,并沒有發生大范圍組織損傷,因此妊娠可
以繼續。難免流產者絨毛組織補體C3、C4表達顯著增高,進一步驗證了此類患者體內存在補體過度激活,但是補體成分為何會沉積于這些部位,目前尚無報道,仍待后續研究。
通過以上實驗推測:補體過度激活可能是RSA的免疫學發病機制之一。根據這種推測,在不遠的將來,抑制補體激活的治療方法有望為不明原因的RSA患者提供新的、更合理、更有效的治療。
參考文獻:
[1] 卜憲敏,鄭智勇,余英豪,等.肝移植排斥反應中C4d的沉積意義[J].世界華人消化雜志,2005,13(11):1314-1316.
[2] Jaume Alijotas-Reig,Miquel Vilardell-Tarres.Is Obstetric Antiphospholipid Syndrome a prima-ry nonthrombotic,proinflammatory,complement-mediated disorder related to antiphospholipd antibodies?[J].obstetrical and gynecological Survey,2009,65(1):39-45.
[3] Hart ML,Walsh MC,Stahl GL.Initiation of complement activation following oxidative stress in vitro and in vivo observations[J].Mol Immunol,2004,41:165-171.
[4] Patricia Redecha,Claus-Werner Franzke,Wolfram Ruf.Neutrophil activation by the tissue factor/Factor VIIa/PAR2 axis mediates fetal death in a mouse model of antiphospholipid syndrome [J].Clin Invest,2008,118:3453-3461.
[5] Hartmut Weiler.Tracing the molecular pathogenesis of antiphospholipid syndrome[J].Clin Invest,2008,118(10) :3276-3278.
[6] Girardi G,Bulla R,Salmon JE,et al.The complement system in the pathophysiology of pregnancy[J].Mol Immunol,2006,43:68-77.
[7] Sugiura-Ogasawara M,Nozawa K,Nakanishi T,et al.Complement as a predictor of further miscarriage in couples with recurrent miscarriages[J].Human Reproduction,2006,21(10): 2711-2714.
[8] Jane E,Salmon,Guillermina Girardi.Antiphospholipid antibodies and pregnancy loss: a disorder of inflammation[J].Reprod Immunol,2008,77(1): 51-56.
[9] Holers VM,Girardi G,Guthridge JM,et al.Complement C3 activation is required for antiphospholipid antibody induced fetal loss[J].Exp Med,2002,95:211-220.
[10] Richani K,Romero R,Soto E,et al.Unexplained intrauterine fetal death is accompanied by activation of complement[J].Perinat Med,2005,33:296-305.
[11] Asherson RA,Cervera R,Shepshelovich D,et al.Nonthrombotic manifestations of the antiphospholipid syndrome:away from thrombosis?[J].Rheumatol,2006,33:1038-1044.
[12] Jaime M,Jane E,Salmon,et al.Excessive complement activation is associated with placental injury in patients with antiphospholipid antibodies[J].Am J Obstet Gynecol,2007,196(2):167.

