多殺菌素生產菌種保藏方法的研究
漏佳偉,傅盼翰,裘娟萍
(1.浙江工業(yè)大學 生物與環(huán)境工程學院,浙江 杭州 310014;2.浙江工業(yè)大學 健行學院,浙江 杭州 310014)
多殺菌素 (spinosad)是刺糖多孢菌(Saccharopolyspora spinosa)有氧發(fā)酵產生的次級代謝產物,是一種安全、高效、廣譜的大環(huán)內酯類殺蟲劑,其主要有效成分是多殺菌素A和D[1-3]。實驗證明多殺菌素能有效防治害蟲,尤其對鱗翅目、纓翅目害蟲有極強的選擇性毒殺作用[4-7]。多殺菌素的殺蟲作用具較強的靶標性,對煙芽夜蛾等重要農業(yè)害蟲的殺蟲活性遠遠超過常用的多種有機磷類、環(huán)戊二烯類、氨基甲酸酯類殺蟲劑,對非靶標生物的毒性很低,對包括人在內的哺乳動物非常安全[8-9],迄今為止沒有發(fā)現(xiàn)與其他殺蟲劑有交叉抗性[10-11]。國內外對于多殺菌素的物理化學性質、作用機理和毒性、殺蟲譜、分析檢測方法和發(fā)酵工藝都做了大量的研究,但由于菌種在保藏過程中易退化,產量極不穩(wěn)定,導致國內多殺菌素依然沒有實現(xiàn)工業(yè)化生產。為此,研究刺糖多孢菌的穩(wěn)定性,找到維持產量穩(wěn)定的保藏方法,對實現(xiàn)多殺菌素工業(yè)化生產具有重大意義。
1 材料與方法
1.1 菌種
刺糖多孢菌5個菌株 (本實驗室保存菌種),其特性列于表1。

表1 待保藏菌株的典型特性
1.2 培養(yǎng)基
固體培養(yǎng)基。葡萄糖0.9%,MgSO4·7 H2O 0.2%,酵母膏0.3%,玉米漿1.0%,瓊脂2.0%,pH值7.0
種子培養(yǎng)基。葡萄糖1.0%,酵母膏0.4%,蛋白胨 0.4%,MgSO4·7 H2O 0.05%,KH2PO40.002%,K2HPO40.004%,p H值7.0
發(fā)酵培養(yǎng)基。葡萄糖7.0%,蛋白胨2.5%,CaCO30.5%,玉米漿1.5%,大豆油4.0%,棉籽粉2.5%,p H值7.0。
1.3 主要儀器與試劑
主要儀器有:gilent 1100 series液相色譜儀(美國安捷倫公司),Thermo Scientific Heraeus Multifuge X1 R離心機 (美國熱電公司),SPX-250B-Z生化培養(yǎng)箱 (上海博訊實業(yè)有限公司),PYX-DHS-40×50隔水式電熱恒溫培養(yǎng)箱 (上海市躍進醫(yī)療器械一廠),ZHWY-2112B雙層特大容量恒溫培養(yǎng)振蕩器 (上海智誠分析儀器制造有限公司),SW-CJ-1F超凈工作臺 (蘇凈集團安泰公司)。
試劑,多殺菌素標樣 (菜喜)(美國陶氏益農公司)。
1.4 方法
1.4.1 菌種斜面低溫保藏
將菌種接種在斜面培養(yǎng)基上,30℃培養(yǎng)7 d,置于密封盒中4℃低溫保藏。
1.4.2 菌種凍干管保藏
帶棉塞的安瓿管滅菌備用。脫脂牛奶間歇滅菌備用。在培養(yǎng)好的斜面中加入無菌脫脂牛奶制成孢子懸液,分裝于安瓿管中,每管4~5滴。將安瓿管預凍至-30℃左右,置于冷凍機內進行冷凍真空干燥直至水分被抽干,繼續(xù)抽真空凍干30 min。在真空條件下熔封,用高頻電火花真空測驗器檢查真空度,真空管放入密閉容器,4℃低溫保藏[12]。
1.4.3 菌種沙土管保藏
河沙過80目 (0.177 mm)篩,用20%鹽酸浸泡24 h后棄鹽酸,水洗至中性,將沙子烘干備用。取非耕作層瘦黃土 (不含有機質),研碎后過100目 (0.149 mm)篩并用水洗至中性,烘干備用。將處理后的沙、土按質量比3∶1混合。混勻的沙土分裝入安瓿管中,每管0.35 g,塞好棉塞,121℃濕熱滅菌30 min,無菌檢驗合格后烘干備用。需保藏菌株斜面培養(yǎng),以無菌水制成孢子懸液滴入沙土管中,每支沙土管4至5滴 (剛剛使沙土潤濕),塞好棉塞,低溫真空抽去水分。在真空條件下熔封,用高頻電火花真空測驗器檢查真空度,真空管放入密閉容器,4℃低溫保藏[12]。
1.4.4 菌株產孢能力測定
菌種保藏30,90,180,270 d,將各保藏菌株用斜面活化,在30℃恒溫培養(yǎng)箱中培養(yǎng)7 d,觀察菌薹上的孢子形成情況。
菌種保藏180,270 d后,用無菌生理鹽水將沙土管和凍干管中的菌株制成單孢子懸液,適當稀釋后涂布平板,30℃恒溫培養(yǎng)7 d,各菌株挑取10個大小相似、呈火山口型的典型單菌落至斜面,凍干管菌株分別標記為1、2、…、10,沙土管菌株分別標記為a、b、…、j。在30℃恒溫培養(yǎng)箱中培養(yǎng)7 d,觀察菌薹上的孢子形成情況。
1.4.5 菌株死亡率檢驗
將安瓿管中的孢子移至裝有無菌生理鹽水的試管中,振蕩打散,制成單孢子懸液,用血球板計數(shù)法測定孢子總數(shù)。將孢子懸液適當稀釋后涂布于平板上,每組3個平板。30℃恒溫培養(yǎng)7 d,記錄菌落形成單位數(shù)。菌株死亡率的計算公式:死亡率(%)=(孢子總數(shù)-菌落形成單位數(shù))/孢子總數(shù)×100。
1.4.6 菌株耐藥性檢驗
將一定濃度的紅霉素、乙酸鈉分別加入固體培養(yǎng)基中,制成平板,再將菌株劃線接種至加藥平板與不加藥物的對照平板上,于30℃下培養(yǎng)10 d,觀察菌株生長情況,計算其典型遺傳特性保持率。計算公式:典型遺傳特性保持率 (%)=抗性平板菌株數(shù)/對照平板菌株數(shù)×100。
1.4.7 菌株搖瓶發(fā)酵條件
菌株用種子培養(yǎng)基30℃、220 r·min-1培養(yǎng)48 h,取3 mL種子液接種至含30 mL發(fā)酵培養(yǎng)基的250 mL錐形瓶中,于30℃、220 r·min-1條件下培養(yǎng)7 d。
1.4.8 高效液相色譜法測定
參照張苑的方法[13],色譜柱:Agilent XDB C18;流動相:甲醇∶乙腈∶0.05%的乙酸鈉水溶液為 45∶45∶10(V∶V);流速:1.0 mL·min-1;進樣量:20 μL;柱溫:室溫。
菌株相對效價 (%)=菌株產量/原始菌株產量×100,默認原始菌株產量為100%;產量下降率 (%)=(原始菌株產量-菌株產量)/原始菌株產量×100。
2 結果與討論
2.1 保藏方法對刺糖多孢菌不同菌株產孢能力的影響
2.1.1 保藏30 d
保藏30 d,菌薹上的孢子形成情況見表2。
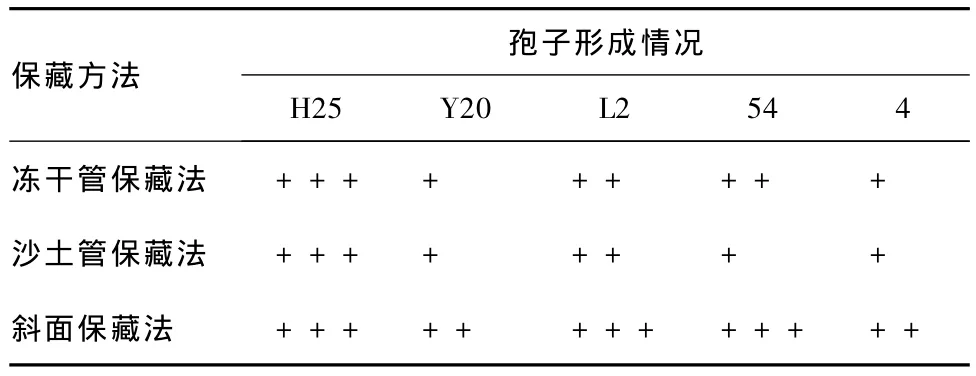
表2 保藏30 d各菌株的孢子形成情況
分析表2可知,保藏30 d,斜面保藏法對菌株產孢子的能力影響最小,凍干管保藏法和沙土管保藏法對其影響基本相同,均有減弱趨勢。
2.1.2 保藏90 d
保藏90 d,菌薹上的孢子形成情況見表3。
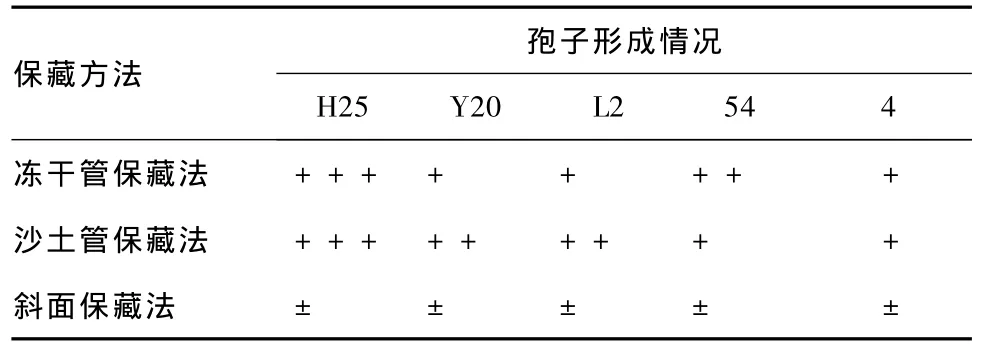
表3 保藏90 d各菌株的孢子形成情況
分析表2和3可知,保藏90 d,斜面保藏的菌株產孢能力退化嚴重,凍干管和沙土管保藏的菌株產孢能力與保藏30 d的情況基本一致。由此說明,斜面保藏法不適用于長期保藏。
2.1.3 保藏180 d
保藏180 d,菌薹上的孢子形成情況見表4。

表4 保藏180 d各菌株的孢子形成情況
分析表4可知,保藏180 d,斜面保藏的菌株存活率為零,凍干管和沙土管保藏菌株生長狀況明顯減弱,產孢能力退化嚴重。
對比表2、3和4中菌株的生長及孢子形成情況可知,隨著菌株保藏時間延長,菌株的生長及孢子形成能力均嚴重退化。
沙土管和凍干管中的菌株分離純化后菌薹上的孢子形成情況見表5和表6。
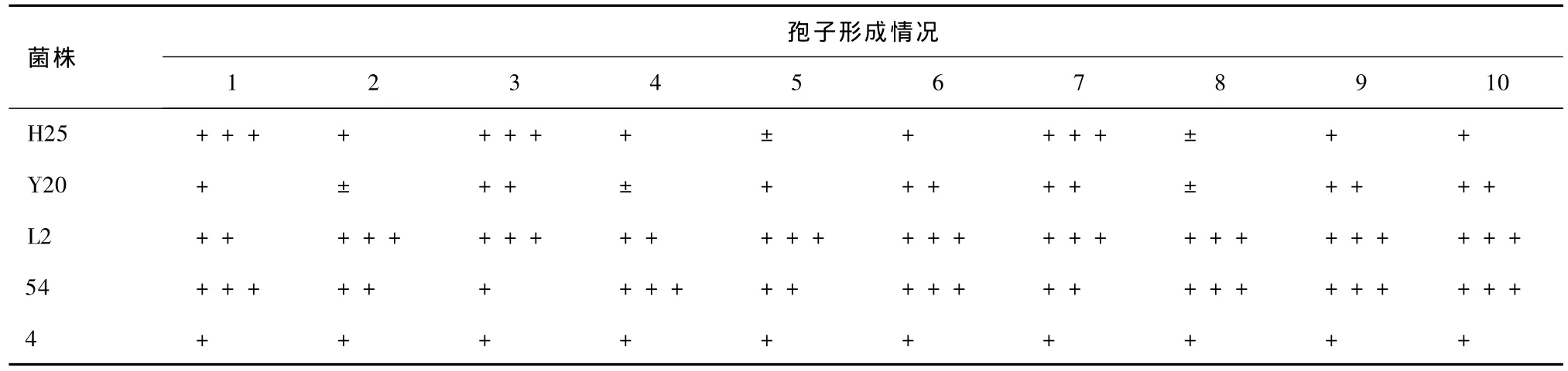
表5 凍干管保藏180 d各菌株分離純化株的孢子形成情況

表6 沙土管保藏180 d各菌株分離純化株的孢子形成情況
對比表5和表6可知,同種保藏方法對不同菌株的保藏效果差異明顯,說明不同菌株的抗逆性不同。凍干管保藏法對菌株的生長及產孢能力影響較小,大部分菌株生長較旺盛。菌株54的分離純化株產孢能力最強,與其原始典型特性 (表1)相符。
對比表4、5和6中菌株的生長及孢子形成情況可知,若先經(jīng)平板分離純化,挑取健壯單菌落至斜面,則菌株的生長狀況相對旺盛,產孢能力強。這說明孢子的初步分離純化可達到一定程度的復壯效果。菌株54的產孢能力提高幅度最大,L2其次,其余3個菌株較小。
由此可知,菌株的產孢能力不僅受保藏方法的影響,而且與保藏時間的長短、菌株本身的特性等因素有關。
2.1.4 保藏270 d
保藏270 d沙土管和凍干管中的菌株分離純化后菌薹上的孢子形成情況見表7和表8。
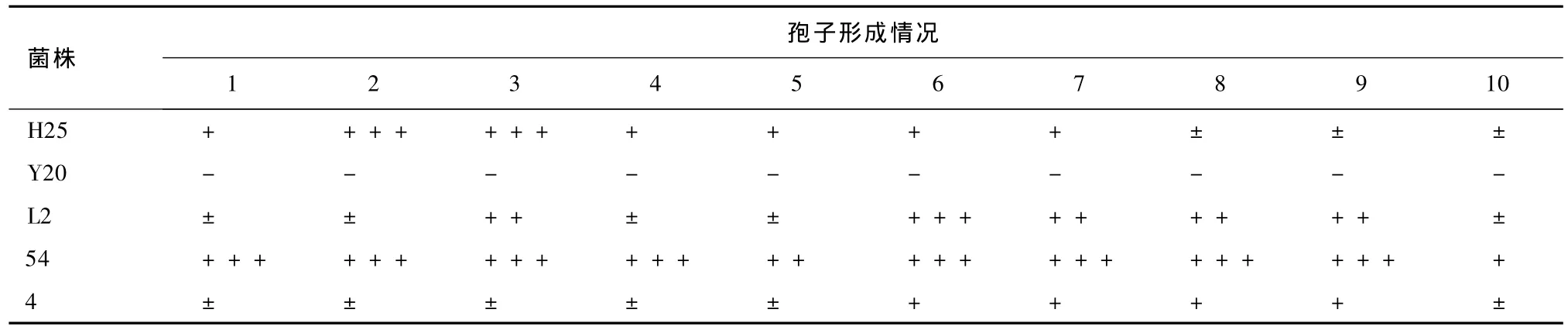
表7 凍干管保藏270 d各菌株的孢子形成情況
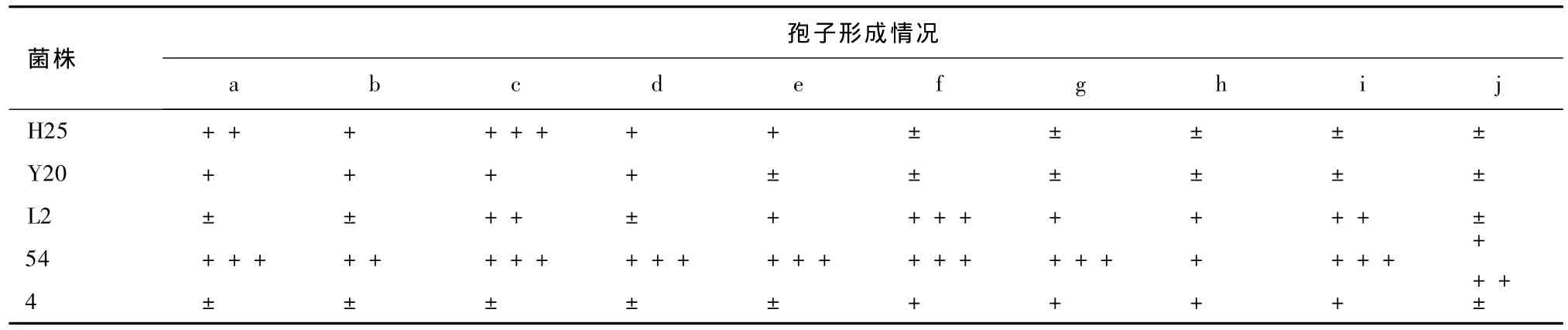
表8 沙土管保藏270 d各菌株的孢子形成情況
對比表7和表8可知,凍干管和沙土管保藏法對菌株產孢能力的影響基本相同。其中,菌株54的產孢能力強。
分析比較表5和表7、表6和表8可知,隨著保藏時間的延長,菌株的產孢能力下降。
2.2 保藏方法對菌株死亡率的影響
保藏180 d、270 d計算菌株死亡率,結果見圖1、圖2。

圖1 凍干管保藏法對菌株死亡率的影響

圖2 沙土管保藏法對菌株死亡率的影響
從圖1和2可以看出,保藏180 d、270 d,各菌株的死亡率都大于90%,特別是沙土管保藏的菌株,死亡率都接近100%。對比圖1和圖2,凍干管保藏菌株死亡率相對較低,保藏效果相對較好。這說明脫脂牛奶作保護劑的效果比無保護作用的沙土好。
對比同一菌株保藏180 d和270 d的死亡率,可見隨著保藏時間的延長,菌株的死亡率增加,但增加的幅度較小,說明菌株對干燥和低溫敏感,在保藏過程中大部分孢子在180 d前死亡。
2.3 保藏方法對菌株典型遺傳特性的影響
分別配制含紅霉素濃度25 U·mL-1、35 U·mL-1,含乙酸鈉濃度10 mg·mL-1、25 mg·mL-1的抗性平板,將保藏270 d的分離純化株劃線接種至相應抗性平板和不含藥物的對照平板上,30℃條件下培養(yǎng)10 d,觀察菌株的生長情況,結果見表9。
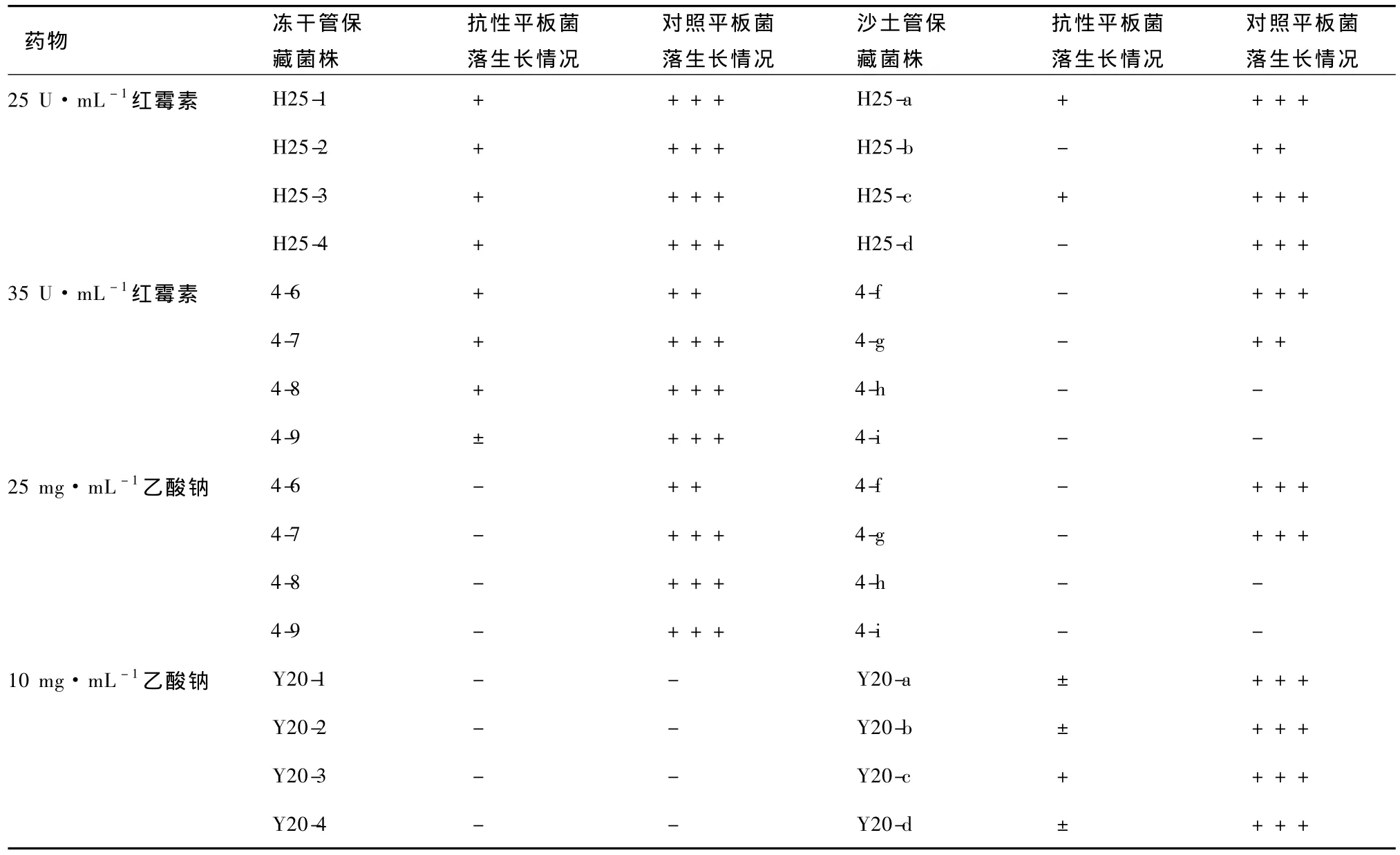
表9 各菌株在藥物及對照平板上的生長情況
根據(jù)表9中各菌株的生長情況,計算菌株典型遺傳特性保持率,結果見表10。
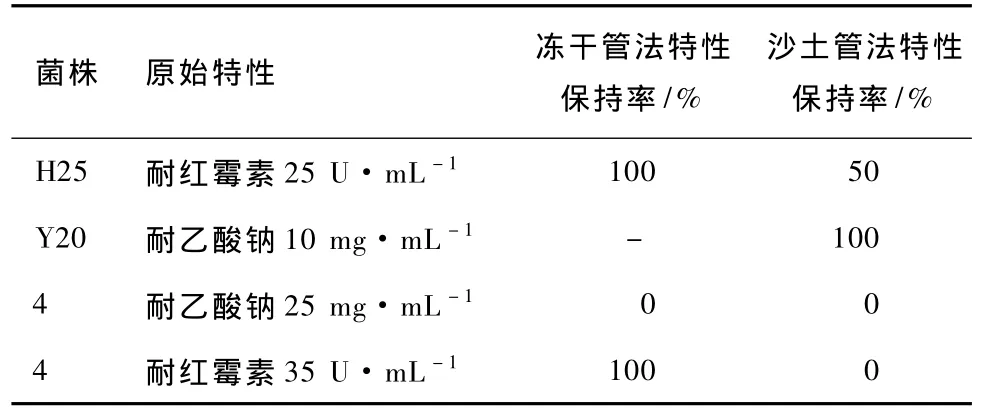
表10 保藏方法對菌株典型遺傳特性的影響
分析表10可知,不同保藏方法對同一菌株同一遺傳特性的保持率不同。菌株4用凍干法保藏時,紅霉素抗性穩(wěn)定,但用沙土管保藏時,紅霉素抗性丟失。菌株H25用凍干法保藏時,紅霉素抗性穩(wěn)定,但用沙土管保藏時,50%的菌株已丟失抗性。由此說明凍干管保藏法能更好地保持菌株的遺傳特性。同一菌株同一保藏方法對不同遺傳特性的保持能力也不同,2種保藏方法都導致菌株4失去乙酸鈉抗性的性狀,但紅霉素抗性卻未完全失去。由此說明乙酸鈉抗性比紅霉素抗性更不穩(wěn)定。
2.4 保藏方法對菌株產多殺菌素能力的影響
2.4.1 保藏180 d
保藏180 d,各凍干管、沙土管分離純化株中斜面生長狀況良好的菌株進行搖甁發(fā)酵,發(fā)酵結束測定p H值,用HPLC法測定發(fā)酵液中多殺菌素的含量,結果見表11。比較各菌株與原始菌株的生產多殺菌素的能力,結果見表12。由表11和12可知,凍干管保藏法分離純化株的產量比較穩(wěn)定,不同菌株間相對效價差異不明顯,平均產量下降率均在85%左右。而沙土管保藏分離純化株的產量不穩(wěn)定,不同菌株間相對效價差異明顯,產量下降率最高的菌株Y20-180-i及最低的菌株54-180-h均出現(xiàn)在沙土管中。此外,沙土管保藏菌株4-180-c的產量最高,達到131.06 mg·L-1。
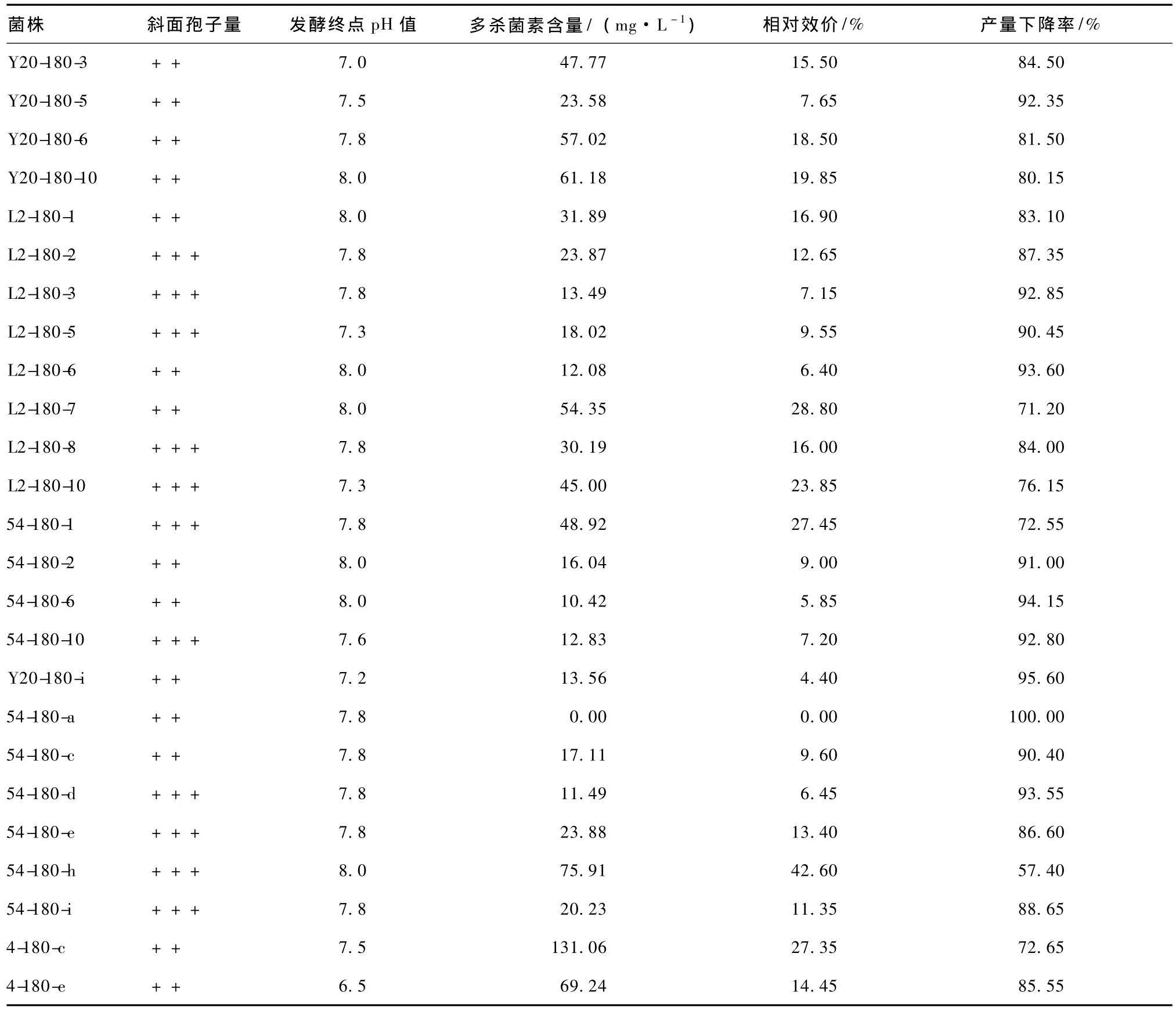
表11 保藏180 d各分離純化株的發(fā)酵結果
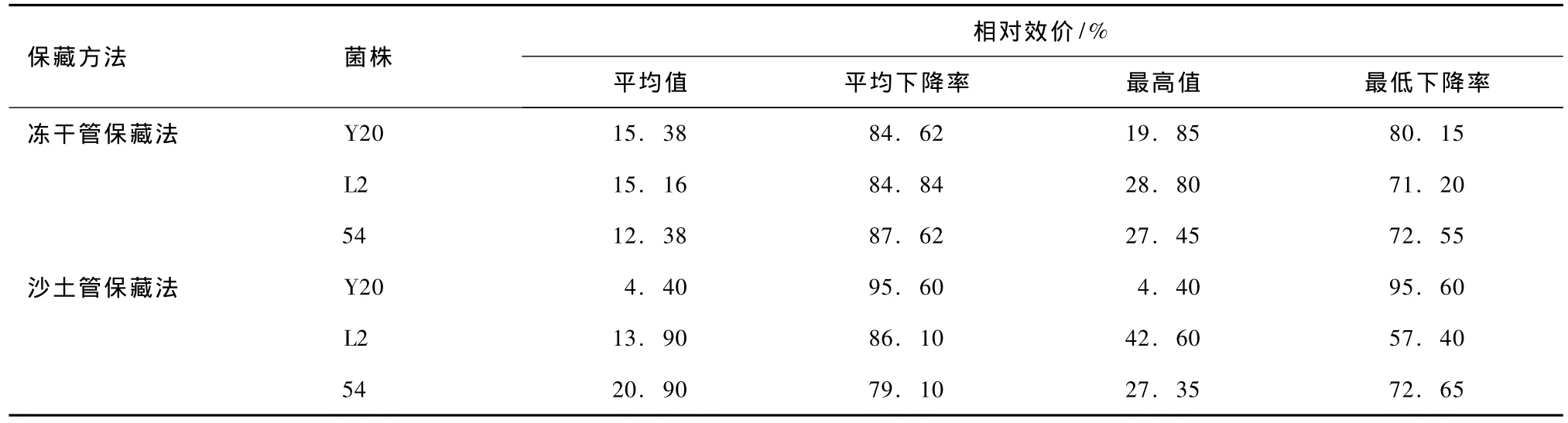
表12 保藏180 d各分離純化株產多殺菌素能力與原始菌株的比較
2.4.2 保藏270 d
保藏270 d,各凍干管、沙土管分離純化株發(fā)酵液中多殺菌素的含量見表13。比較各菌株與原始菌株的生產多殺菌素的能力,結果見表14。對比表12和14可知,隨著保藏時間的延長,同一保藏方法同一菌株產多殺菌素的能力不斷退化,部分菌株甚至失去產多殺菌素的能力。由表13和14可知,保藏270 d,2種保藏方法對菌株產多殺菌素能力的影響均較嚴重,但菌株差異明顯。菌株H25用凍干管保藏時,產多殺菌素能力已全部喪失,用沙土管保藏時卻未喪失。說明不同保藏方法對同一菌株產多殺菌素能力的影響不同。
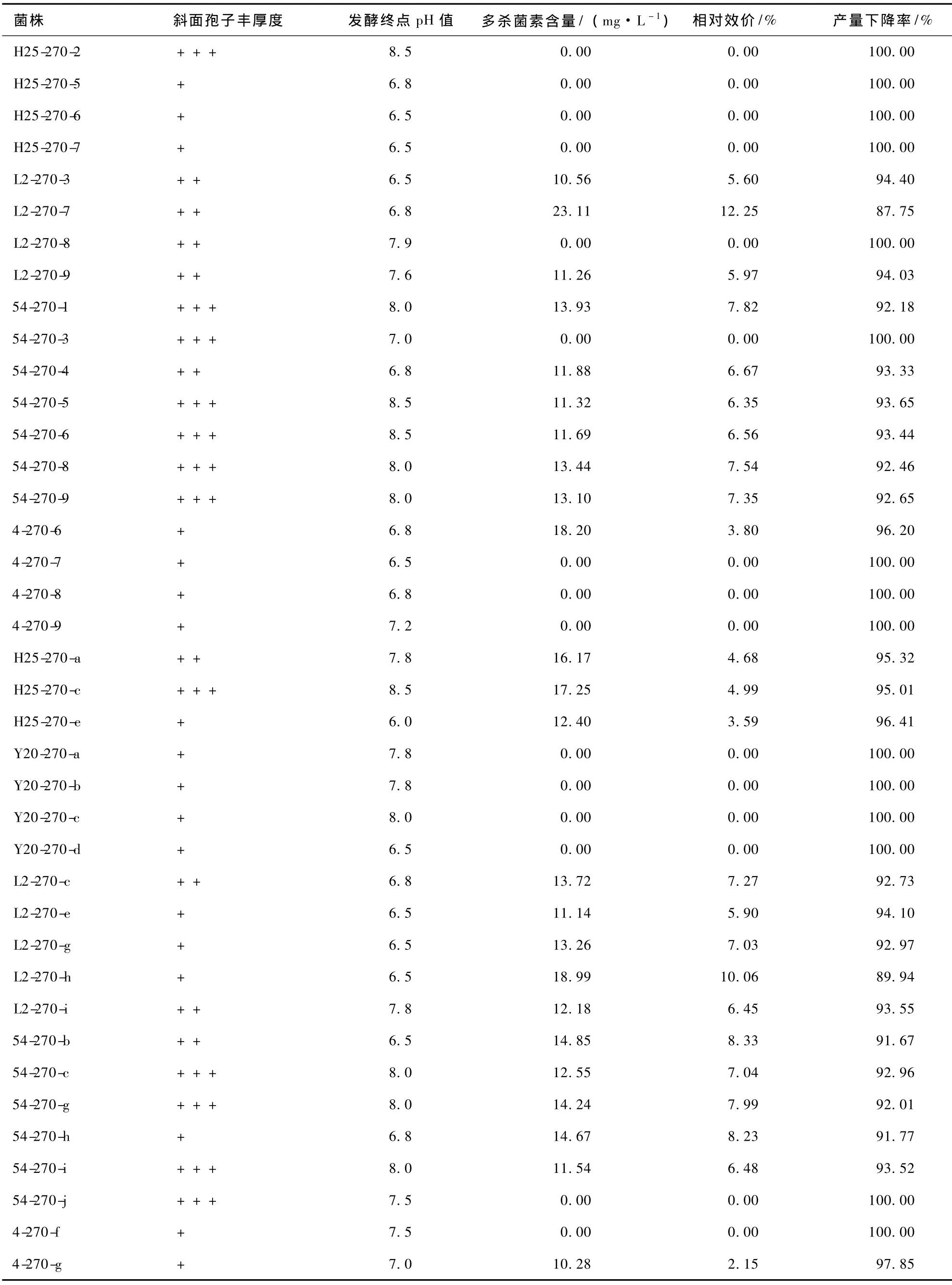
表13 保藏270 d各分離純化株發(fā)酵結果
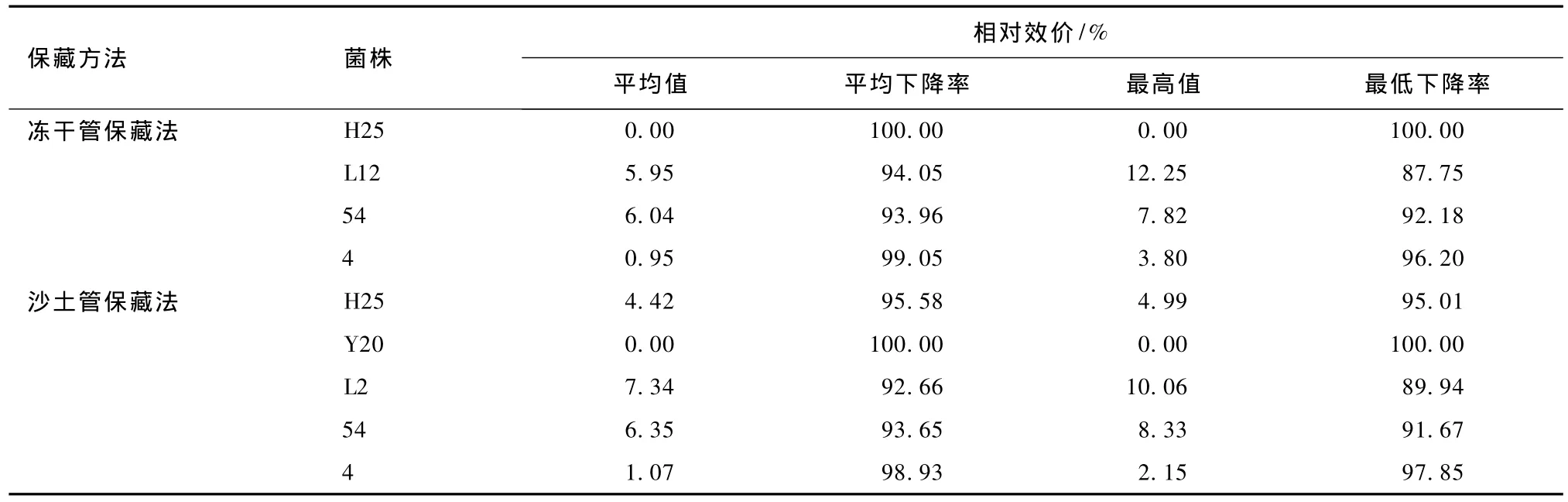
表14 保藏270 d各分離純化株產多殺菌素能力與原始菌株的比較
3 小結
斜面保藏法操作最簡單,保藏30 d,活化菌株生長最旺盛,產孢能力最強;保藏90 d,菌株完全喪失產孢能力。用凍干管和沙土管保藏法保藏270 d,菌株產孢能力、產多殺菌素能力和部分遺傳特性仍能保持;但隨著保藏時間的延長,部分遺傳特性失去,菌株產孢子和產多殺菌素的能力嚴重下降。與沙土管保藏法相比,凍干管保藏法對菌株產孢子、產多殺菌素的能力以及對其遺傳特性的影響較小,死亡率較低,菌種產量較穩(wěn)定。但產量最高的菌株以及相對效價最高的菌株均出現(xiàn)在沙土管中,2種保藏方法的保藏效果因菌株不同而差異明顯。
[1] 高菊芳,亦冰.生物農藥的作用、應用與功效:微生物產物農藥 [J].世界農藥,2001,23(1):1-6.
[2] 黃劍,吳文君.新型殺蟲劑的作用機制和選擇毒性 [J].貴州大學學報,2004,21(2):163-171.
[3] Salgado V L,Sheets J J,Gerald B,et al.Studies on the mode of action of spinosad:the internal effective concentration and the concentration dependence of neural excitation [J]. Pestic Biochem Physiol,1998,60:103-110.
[4] Musser F R,Shelton M A.The influence of post-exposure temperature on the toxicity of insecticides to Ostrinia nubilalis(Lepidoptera:Crambidae) [J].Pest Manag Sci,2005,61:508-510.
[5] Semiz G,Cetin H,Isik K,et al.Effectiveness of a naturally derived insecticide,spinosad,against the pine processionary moth Thaumetopoea wilkinsoni Tams (Lepidoptera:Thaumetopoeidae)under laboratory conditions [J]. Pest Manag Sci,2006,62:452-455.
[6] Jones T,Scott D C,Harris R,et al.The efficacy of spinosad against the western flower thrips,F(xiàn)rankliniella occidentalis,and its impact on associated biological control agents on greenhouse cucumbers in southern Ontario [J].Pest Manag Sci,2005,61:179-185.
[7] Premachandra D W,Borgemeister C,Poehling H M.Effects of neem and spinosad on Ceratothripoides claratris(Thysanoptera:Thripidae),an important vegetable pest in Thailand,under laboratory and greenhouse conditions [J].J Econ Entomol,2005,98(2):438-448.
[8] Holt K M,Opit G P,Nechols J R,et al.Testing for non-target effects of spinosad on two spotted spider mites and their predator Phytoseiulus persimilis under gre enhouse conditions[J].Exp Appl Acarol,2006,38:141-149.
[9] Cleveland C B,Mayes M A,Cryer S A.An ecological risk assessment for spinosad use on cotton [J].Pest Manag Sci,2001,58:70-84.
[10] Wei Y P,Appel A G,Moar W J.Pyrethroid resistance and cross-resistance in the German cockroach,Blatella germanica(L)[J].Pest Manag Sci,2001,57:1055-1059.
[11] Mota S D,Hollingworth R M,Grafius E J,et al.Resistance and cross-resistance to neonicotinoid insecticides and spinosad in the Colorado potato beetle,Leptinotarsa decemlineata(Say)(Coleoptera:Chrysomelidae)[J].Pest Manag Sci,2006,62:30-37.
[12] 沈萍,陳向東.微生物學實驗 [M].北京:高等教育出版社,2008:267-270.
[13] 張苑,金志華,林建平,等.多殺菌素的高效液相色譜[J] .農藥,2003,42(10):27-28.

