EPHB6受體型酪氨酸蛋白激酶抑制非小細胞肺癌轉移的實驗研究△
第四軍醫(yī)大學基礎部教學實驗中心(西安 710032)
鐵 茹 胡 浩 谷仲平* 曲 萍 于 軍 陳寶瑩*▲
肺癌是發(fā)病率和死亡率增長最快、對人類健康和生命威脅最大的惡性腫瘤之一,而非小細胞肺癌(Non-small cell lung cancer,NSCLC)是其中最常見的組織學類型[1,2]。早期轉移是 NSCLC引起死亡的最常見原因,在此過程中受體型酪氨酸激酶(Receptor tyrosine kinase,RTK)發(fā)揮重要的作用[3,4]。促紅細胞生成素產(chǎn)生肝細胞激酶(Erythropoietin-producing hepatocyte kinase,EPH)受體組成 RTK家族最大的亞家族,到目前為止,已在動物中發(fā)現(xiàn)有 16個成員[5,6]。 EPH受體是和 ephrin的配體相互作用,EPH受體分為兩類:EPHA(包括 EPHA1~ 10)和 EPHB(包括 EPHB1~ 6),這兩類受體分別與各自的配體結合發(fā)揮作用。EPH受體與其配體結合之后產(chǎn)生一系列生物學效應,包括細胞間相互作用和細胞遷移[7,8]。EPHB6作為 EPHB受體之一,它的表達失活與人類多種腫瘤的發(fā)生和轉移有關[9,10]。 Matsuoka等[11]發(fā)現(xiàn)EPHB6在調節(jié)細胞黏附和遷移過程中具有正反兩方面的作用。因此,對 EPHB6在細胞轉移過程中的作用還存在爭議。我們在體外和體內實驗中研究了 EPHB6對 NSCLC轉移的作用。與正常肺組織相比,A549 NSCLC細胞系低水平表達 EPHB6[12],為此,我們選擇A549細胞作為主要模型研究 EPHB6的作用。
材料和方法
1 材 料 Dulbecco's Modified Eagle's培養(yǎng)基(DMEM,Invitrogen,USA);10%的胎牛血清(FCS);2mmol/L-谷氨酸 ;100ml青霉素、 100 μ g/ml鏈霉素;濾膜 (8 μ m孔徑,Corning Inc.,Corning,NY,USA);ERK(1∶ 1000稀 釋,Cell Signaling Technology,USA);兔抗人 EPHB6(1 μ g/ml,Santa Cruz,USA);小 鼠抗 人 β-actin(40ng/ml,sigma,USA);非肥胖糖尿病 /嚴重聯(lián)合免疫缺陷(NOD/SCID)小鼠(中科院實驗動物研究所)。
2 方 法 為了闡明 EPHB6在肺癌細胞中的作用,我們建立了能夠穩(wěn)定表達 EPHB6的 A549細胞系(A549-EPHB6)和不表達 EPHB6的對照組細胞系(A549-PCDNA4)。 ①細胞培養(yǎng):A549 HTB58肺腺癌細胞培養(yǎng)采用改良 Dulbecco's Modified Eagle's培養(yǎng)基,輔以 10%的胎牛血清(FCS),2mmol/L-谷氨酸,100ml青霉素、100 μ g/ml鏈霉素 ,于 37℃、 5%二氧化碳的孵箱中培養(yǎng)。② Western blotting:用冰凍的 PBS沖洗細胞,加入含 150mmol NaCl的冰冷 RIPA緩沖液,冰上裂解 30min。20000g、4℃ 離心 10min內清除細胞裂解物。調整蛋白質濃度后,在 SDS上樣緩沖液中95℃加熱細胞裂解物 10min,進行聚丙烯酰胺凝膠電泳(PAGE,4%,Invitrogen)以分離蛋白,之后轉到PVDF膜。蛋白檢測:一抗,兔抗人 EPHB6,兔抗人磷酸化或總 ERK,小鼠抗人β-actin。采用辣根過氧化物酶(HRP)耦聯(lián)二抗,化學發(fā)光法 (ECL Plus,Amersham Pharmacia,Sweden)顯色。③黏附實驗:24孔板表面預先包埋部分所示濃度的 EPHB6配體Ephrin-B2-Fc,Ephrin-B2-Fc溶解于含有 5mg/ml牛血清蛋白的 PBS中,4℃過夜。室溫下,用含 20mg/ml BSA的 PBS封閉 60min,隨后棄去封閉液,用不含F(xiàn)CS的 M EN培養(yǎng)基清洗,以每孔 2×105的密度接種細胞于含有 10% FCS的 MEN培養(yǎng)基中,37℃黏附30min后進行分析,洗掉沒有黏附的細胞,拍照并采用流式細胞儀對黏附在粘附 24孔板表面的細胞計數(shù)。④細胞遷移實驗:用 50 μ g/ml纖維連接蛋白、5mg/ml BSA的 PBS包被細胞轉移小室的濾膜,室溫下放置60min,棄封閉液后用不含 FCS-的 MEM培養(yǎng)基清洗濾膜。在 100 μ l帶有 1% FCS的 MEM中,總數(shù)為 5×105的細胞被接種于上層小室,下層小室加入含有10% FCS的 400 μ l M EM,37℃放置 24h,遷移至下小室的細胞用流式細胞儀計數(shù)。⑤在體腫瘤細胞轉移實驗:非肥胖糖尿病 /嚴重聯(lián)合免疫缺陷(NOD/SCID)雌鼠飼養(yǎng) 8~9周后,在注射前 24h用 3.5Gy輻射處理,20只小鼠隨機分成兩組,1組為對照組、1組為 EPHB6實驗組,每組 10只。一組尾靜脈注射 A549-EPHB6細胞,另一組注射 A549對照組細胞。平均每只小鼠注射劑量是 1.5×106細胞,小鼠在注射 4周后處死。取肺組織之后冷凍于液氮中,或用 4%甲醛固定,石蠟包埋后進行組織病理學分析。
3 統(tǒng)計學處理 計量資料以個體資料樣本和均數(shù)±標準差表示,利用 SPSS(15.0)軟件進行數(shù)據(jù)處理。多組間兩均數(shù)比較采用方差分析,兩獨立樣本均數(shù)比較采用t-檢驗,配對樣本均數(shù)比較采用配對t-檢驗,腫瘤轉移率的比較采用χ2檢驗,相關系數(shù)采用雙尾Spearman檢驗計算。 P<0.05差異有統(tǒng)計學意義。
結 果
1 體外實驗 將 A549-EPHB6細胞和對照組細胞置于用不同濃度 Ephrin-B2-Fc包被的細胞培養(yǎng)上,如圖 1A、圖 1B所示,A549-EPHB6細胞顯示出對Ephrin-B2-Fc包被平板較高的黏附性,并呈劑量依賴性,在 Ephrin-B2-Fc達到 4μ g/ml時其黏附能力達到峰值。黏附能力的升高有可能導致遷移能力的降低,而遷移實驗恰恰證實 EPHB6的重表達使細胞遷移率降低 80%(如圖 2A;P<0.001)。由于所有肺癌細胞系都低水平表達 EPHB6,因此我們用 siRNA技術抑制A549-EPHB6細胞。實驗發(fā)現(xiàn)在 si RNA干擾 EPHB6表達后,細胞的遷移水平顯著升高(如圖 2B,P<0.05)。將 EPHB6基因轉染進 HTB58細胞中(另一種低表達 EPHB6的 NSCLC細胞系)發(fā)現(xiàn)細胞的遷移水平降低 30%(如圖 2D,P<0.05),表明 EPHB6對細胞遷移的作用不局限于 A549細胞。
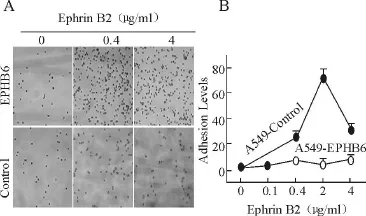
圖1 體外實驗-細胞培養(yǎng)實驗結果
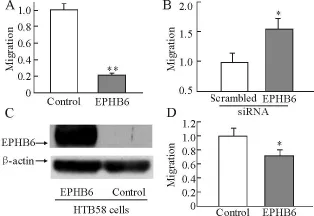
圖2 體外實驗-細胞黏附實驗結果
2 體內實驗 體外實驗表明 EPHB6能夠降低A549肺癌細胞的遷移能力,提示 EPHB6可能對腫瘤的體內轉移具有抑制作用。因此,我們將表達 EPHB6的 A549細胞和不表達 EPHB6的 A549細胞通過尾靜脈注射入兩組(每組 10只)小鼠體內,四周之后在對小鼠肺轉移灶進行觀察,發(fā)現(xiàn) 67%的實驗組小鼠發(fā)生了轉移,而對照組小鼠只有 10%發(fā)生轉移(如圖 3A;P<0.05),并且實驗組中發(fā)生轉移的小鼠只有一個轉移灶,而對照組小鼠則出現(xiàn)多發(fā)的轉移灶,而在其他器官如皮膚、腎、腦等處沒有發(fā)現(xiàn)轉移(如圖 3B~ D)。
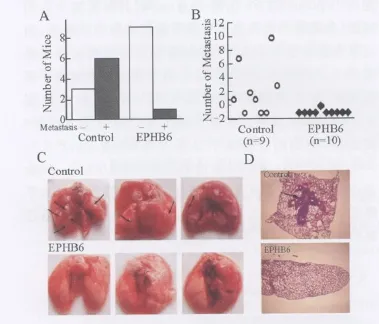
圖3 在體腫瘤細胞轉移實驗結果
討 論
本實驗首次發(fā)現(xiàn),EPHB6能夠直接抑制體外NSCLC細胞遷移和體內轉移。所得結果提示 EPHB6是一種新的腫瘤轉移抑制基因。最近的一項體外實驗研究報道了 EPHB6對人類浸潤性乳腺癌細胞的作用[13]。我們的在體實驗表明 EPHB6的表達水平直接影響到 NSCLC細胞的功能,如遷移能力。因此,EPHB6介導的信號通路很可能有直接抑制腫瘤轉移的作用,但是其具體的胞內信號轉導機制還有待于進一步研究。
EPHB6是一種“假激酶”,因為其激酶催化結構域有部分的保守氨基酸發(fā)生改變,導致其無催化活性[14]。EPHB6作為標記,與許多腫瘤的預后密切相關,這可能與其特異性的信號轉導特性有關,而與它固有的激酶活性無關。盡管 EPHB6有激酶結構域的缺陷,但是有文獻報道 EPHB6能夠被其上游的 Src家族激酶磷酸化[15]。我們近期研究了在肺腺癌中 EPHB6的表達對細胞外信號調節(jié)激酶 (ERK)活化的作用[16]。但是隨后實驗發(fā)現(xiàn)抑制 ERK并沒有改變表達 EPHB6的 NSCLC細胞的遷移能力。表明 EPHB6抑制NSCLC轉移的作用不是通過激活 ERK實現(xiàn)的。另外有報道顯示,與大腦、肺、腎等組織相比,EPHB6在胸腺中表達水平最高,且與 T-細胞的成熟成一定的正相關性[10]。 EPHB6缺失的小鼠會導致 T-細胞功能下降[17]。但是免疫因素對 EPHB6抑制腫瘤轉移的作用是否有影響還不清楚,值得進一步探討。
綜上所述,EPHB6作為腫瘤轉移抑制基因可以重新激活 EPHB6和其他抑癌基因,可為預防 NSCLC發(fā)生轉移提供新的方法。
[1] Jemal A,Siegel R,Ward E.Cancer Statistics[J].CA Cancer J Clin,2009,59:225-249.
[2] van Zandwijk N,Mooi WJ,Rodenhuis S.Prognostic factorsin NSCLC. Recentexperiences[J].Lung Cancer,1995,12(Suppl 1):S27-33.
[3] Ansari J,Palmer DH,Rea DW,et al.Role of tyrosine kinase inhibitors in lung cancer[J].Anticancer Agents Med Chem,2009,9:569-575.
[4] Santos ES,Blaya M,Raez LE.Gene expression profiling and non-small-cell lung cancer:where are we now[J].Clin Lung Cancer,2009,10:168-173.
[5] Menzel P,Valencia F,Godement P,et al.Ephrin-A6,a new ligand for EphA receptors in the developing visual system[J].Dev Biol,2001,230:74-88.
[6] Eph Nomenclature Committee.Unified nomenclature for Eph family receptors and their ligands,the ephrins[J].Cell,1997,90:403-407.
[7] CastanoJ,Davalos V,Schwartz S Jr,et al.EPH receptors in cancer[J].Histol Histopathol,2008,23:1011-1023.
[8] Campbell TN,Robbins SM.The Eph receptor/ephrin system: an emerging player in the invasion game[J].Curr Issues Mol Biol,2008,10:61-66.
[9] Tang XX,Evans AE,Zhao H,et al.Association among EPHB2,TrkA,and M YCN expression in low-stage neuroblastomas[J].Med Pediatr Oncol,2001,36:80-82.
[10] Hafner C,Schmitz G,M eyer S,et al.Differential gene expression ofEph receptors and ephrins in benign human tissues and cancers[J].Clin Chem,2004,50:490-499.
[11] Matsuoka H,Obama H,Kelly ML,et al.Biphasic functions of the kinase-defective Ephb6 receptor in cell adhesion and migration[J].J Biol Chem,2005,280:29355-29363.
[12] Yu J,Bulk E,Ji P,et al.The kinase defective EPHB6 receptor tyrosine kinase activates MAP kinase signaling in lung adenocarcinoma[J].Int J Oncol,2009,35:175-179.
[13] Fox BP,Kandpal RP.EphB6receptor significantly alters invasiveness and other phenotypic characteristics of human breast carcinoma cells[J].Oncogene,2009,28:1706-1713.
[14] Sjoblom T,Jones S,Wood LD,et al.The consensus coding sequences of human breast and colorectal cancers[J].Science,2006,314:268-274.
[15] Boudeau J,Miranda-Saavedra D,Barton GJ,et al.Emerging roles of pseudokinases[J].Trends Cell Biol,2006,16:443-452.
[16] 鐵 茹,陳寶瑩,劉利兵,等.EPHB6受體型酪氨酸蛋白激酶對 ERK信號通路的調控效應[J].第四軍醫(yī)大學學報,2009,30(19):1864-1867.
[17] Luo H,Yu G,Tremblay J,et al.EphB6-null mutation results in compromised T cell function[J].J Clin Invest,2004,114:1762-1773.

