苜蓿絲氨酸蛋白水解酶及青貯時對蛋白降解作用的研究
程 巍,郭旭生
(1.蘭州大學草地農業科技學院,甘肅 蘭州 730020; 2.蘭州大學生命科學學院 干旱與草地生態教育部重點實驗室,甘肅 蘭州730000; 3.蘭州大學青藏高原生態系統管理國際中心,甘肅 蘭州 730000)
苜蓿(Medicagosativa)是我國北方地區主要的豆科牧草,以蛋白含量高[1]、適口性好而被稱為“牧草之王”,其主要利用方式有干草調制和青貯兩種。在我國華北地區,苜蓿第2茬收割時恰逢雨季,不利于干草的調制,而青貯則不受天氣的限制,還可以保持苜蓿的青綠特性,是苜蓿利用較為理想的方法[2]。但苜蓿在青貯發酵過程中,因自身所含蛋白酶和微生物酶的作用,大部分真蛋白被分解成非蛋白氮(non-protein nitrogen,NPN),青貯后苜蓿中NPN含量為總氮的44%~87%[3]。與蛋白氮相比,大部分NPN在瘤胃中進一步快速降解形成大量的NH3,并經瘤胃壁吸收后在肝臟中合成尿素,大部分以尿氮的形式排出體外[4-5],這樣青貯苜蓿不能體現高蛋白牧草的特性。另外,蛋白大量分解為NPN也會導致家畜對干物質采食量及日糧總氮利用率降低[6-7]。因此,明確NPN產生的原因,了解苜蓿在青貯過程中蛋白的降解機制并加以調控,是提高苜蓿等豆科牧草青貯飼料品質的關鍵問題[8-9]。
研究表明[10],苜蓿在青貯過程中,對蛋白水解起主要作用的是植物蛋白酶。就其種類而言,根據蛋白酶降解蛋白作用于肽鏈的位置,將蛋白酶分肽鏈外切酶和肽鏈內切酶兩類。目前普遍認為[12]植物體蛋白質的降解是先由肽鏈內切酶起作用,內肽酶首先將蛋白質水解成小肽,小肽再由外肽酶將其水解成氨基酸,然后被運輸或貯存到其他部位。所以,內肽酶活性增強可能是植物蛋白質含量下降的主要原因[13-14]。而前人[15]發現,植物中主要的內切酶為半胱氨酸或天門冬氨酸型內肽酶,在黑麥草(Loliumspp.)青貯時加入天冬氨酸肽酶、半胱氨酸肽酶以及金屬肽酶抑制劑能夠抑制青貯料中蛋白的降解程度[16-17]。
目前關于絲氨酸的研究中,人們發現了絲氨酸內肽酶在植物衰老過程中起促進作用[18],并認為絲氨酸內肽酶參與了植物超敏反應、信號轉導等過程[19],但絲氨酸蛋白酶對蛋白降解的作用機理鮮有報道。本研究以綠汁發酵液的形式模擬青貯發酵的過程,旨在了解苜蓿中絲氨酸蛋白酶的特性,進而探討絲氨酸蛋白酶對苜蓿青貯過程中蛋白水解形成NPN及其各組分的相關機制。
1 材料與方法
1.1試驗材料 供試材料為紫花苜蓿品種阿爾岡金第2茬初花期材料(由加拿大引進),由蘭州大學榆中校區草地農業科技學院苜蓿試驗基地(35.946° N,104.037° E)提供。絲氨酸蛋白酶抑制劑——苯甲基磺酰氟[16](PMSF),由sigma公司生產。
1.2試驗方法
1.2.1材料處理 于2009年6月末在試驗地刈割取樣,分裝后將樣品置于液氮中,運至實驗室于-80℃保存。測定時分別取出分裝好的樣品,每個樣品只解凍一次,不重復使用。
1.2.2酶液的提取 將5 g 樣品放入研缽中,加入液氮研磨成粉狀,之后加入20 mL 25 mmol/L的Tris-HCl緩沖液,pH值7.5,含有體積分數為1%的聚乙烯吡咯烷酮(polyvinylpolypyrrolidone,PVP)和0.1%的β-巰基乙醇。充分研磨后用4層紗布過濾并在4℃條件下20 000 g離心10 min。上清液通過Sephadex G-25(凝膠)柱脫鹽[20]。收集濾液用于酶活性的測定。以上步驟均在4℃的條件下進行,酶液現做現用。
1.2.3絲氨酸蛋白酶活性的測定 酶反應體系由兩部分組成:體積分數為0.2%的N-Succinyl-Ala-Ala-Pro-Phe-pNA底物溶液(溶于25 mmol/L Tris-HCl,pH值7.4)1 mL;在4℃下反應1 h的粗酶液+各濃度梯度的PMSF(溶解于二甲基亞砜,DMSO)抑制劑的混合液0.2 mL。將二者混合在37℃條件下反應2 h后,加入質量分數5%的三氯乙酸(TCA)2 mL,室溫靜置30 min后,15 000 g離心5 min,取上清液,紫外分光光度計在405 nm比色[20],酶活性的變化以吸光值表示。
測定前,將底物溶液置于20~90℃溫度的水浴內先預熱10 min,以保證反應開始的溫度;之后加入酶液-抑制劑混合液,在所設溫度的水浴中保溫2 h。在pH值為3.0~8.4時,測定絲氨酸蛋白酶的活性(在pH值3~6使用的為磷酸氫二鈉-磷酸二氫鈉緩沖液;pH值6.6~8.4為Tris-HCl緩沖液)。
1.2.4綠汁發酵液的制作 將苜蓿剪碎放入榨汁機[21],加入苜蓿質量4倍的水榨汁,用4層紗布過濾后將濾液離心(1 000 g,1 min)。取上清液,加入同體積體積分數為1%的葡萄糖溶液后,將其分裝于20 mL的螺口試管中分別加入抑制劑。處理組加入最終濃度為5 mmol/L的PMSF;對照組加入等量的抑制劑溶劑DMSO(使每份綠汁發酵液中含有相同比例的發酵液和DMSO),密封后在30℃恒溫培養14 d。在發酵第0、0.5、1、2、3、5、7天和14天分別取樣進行測定,每個處理重復3次。
1.2.5氮組分的測定 取未發酵的綠汁發酵液5 mL,用凱氏定氮法測定總氮含量的[22];用體積分數為5%三氯乙酸對綠汁發酵液進行沉淀,取1.5 mL上清液,用微量凱氏定氮法測定NPN的氮含量[23];采用茚三酮-硫酸肼比色法測定樣品中游離氨基酸氮含量;苯酚-次氯酸鈉比色法測定樣品中氨態氮含量[24];按照公式計算樣品中肽氮的含量。
肽氮含量=非蛋白氮含量-(游離氨基酸氮含量+氨態氮含量)。
可溶性蛋白含量的測定:以牛血清蛋白(BSA)為標準,用Lowry法[25]測定(北京索萊寶科技有限公司試劑盒)。
1.3數據處理 用SPSS (17.0版)的配對T檢驗進行數據統計。
2 結果與分析
2.1苜蓿絲氨酸蛋白酶的特性
2.1.1抑制劑濃度對酶活性的影響 隨著PMSF濃度的增加,絲氨酸蛋白酶的活性逐漸下降,當PMSF在酶液中的濃度達到5 mmol/L時,苜蓿中絲氨酸蛋白酶的活性被完全抑制(圖1)。
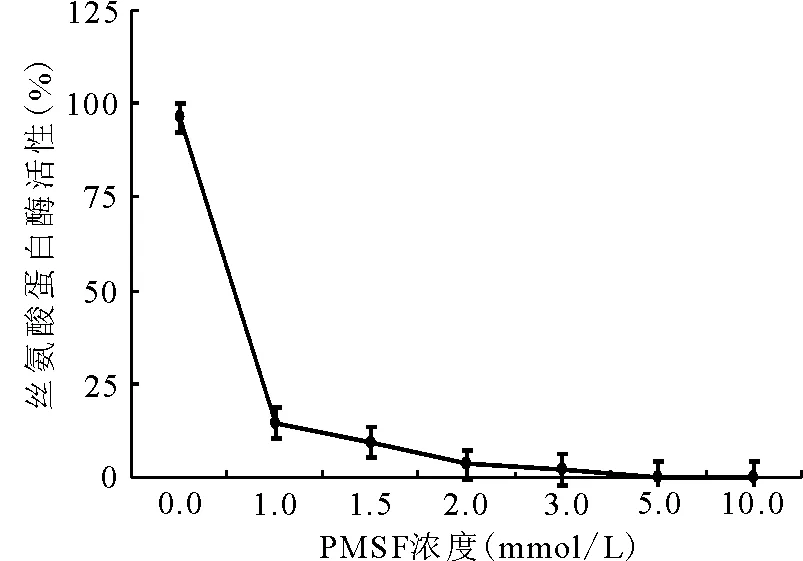
圖1 不同PMSF濃度對絲氨酸蛋白酶活性的影響
2.1.2溫度對酶活性的影響 絲氨酸水解酶的最適溫度為45℃,之后隨著溫度的增高其活性逐漸降低(圖2)。
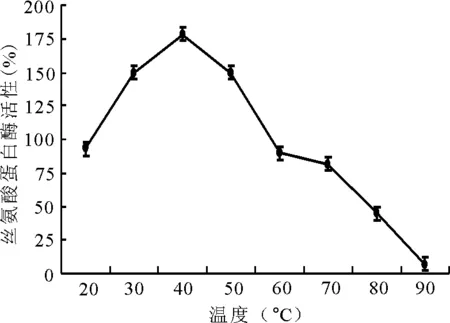
圖2 不同溫度對絲氨酸蛋白酶活性的影響
2.1.3pH值對酶活性的影響 隨pH值的增加,酶活性呈“雙峰”型變化,在pH值為6.6時,絲氨酸蛋白酶活性最高(圖3)。
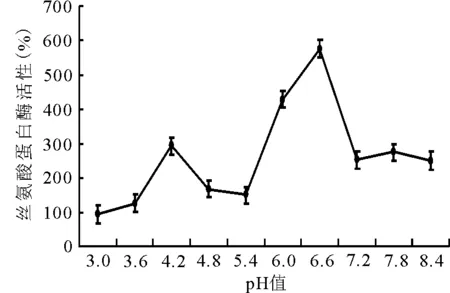
圖3 不同pH值對絲氨酸蛋白酶活性的影響
2.2絲氨酸蛋白酶對苜蓿綠汁發酵液中氮組分的影響
2.2.1綠汁發酵液pH值的動態 對照組的pH值在綠汁發酵液發酵的第2天由6.3降為4.5左右,隨后變幅較小(圖4)。而PMSF處理組的pH值總體上緩慢下降,第14天時為4.9左右,極顯著高于對照組(P<0.01)。
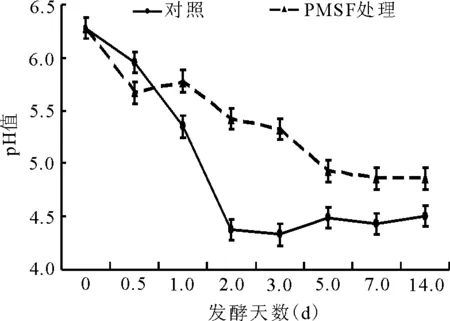
圖4 綠汁發酵液pH值的動態
2.2.2非蛋白氮占總氮比例的動態 試驗前期NPN含量變化較大(圖5),對照組的NPN含量從156 g/kg升高到351 g/kg;而PMSF處理對NPN抑制作用始于12 h以后,至第14天,PMSF處理組NPN的含量極顯著(P<0.01)低于對照組(圖5)。
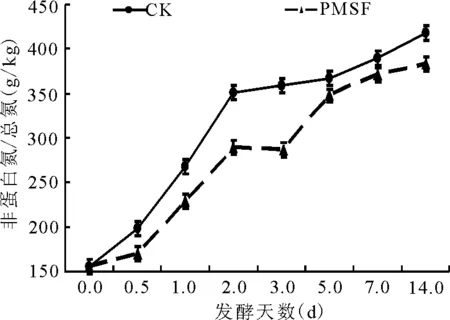
圖5 總氮中非蛋白氮的動態
2.2.3氨態氮占總氮比例的動態 對照組的氨態氮始見于發酵后的12 h,隨后于2 d內迅速升高;而PMSF添加處理組的氨態氮在第3天過后才開始形成,發酵至第14天,其含量仍極顯著(P<0.01)低于對照組(圖6)。
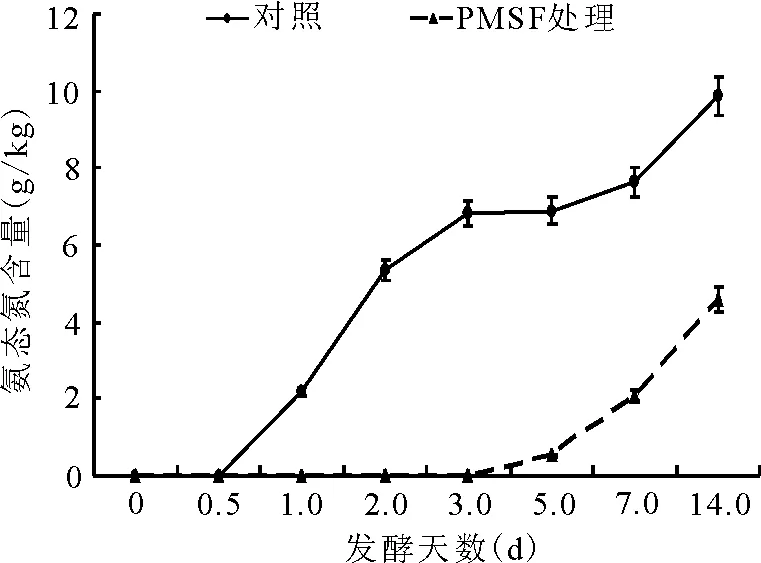
圖6 總氮中氨態氮的動態
2.2.4游離氨基酸占總氮比例的動態 發酵初期(前2天)游離氨基酸含量增加緩慢,自第2天至第5天增加最多。對照組從72 g/kg增加至140 g/kg;而此期間,PMSF處理組的游離氨基酸含量始終低于對照組,至發酵第14天,PMSF處理組顯著(P<0.01)低于對照組(圖7)。
2.2.5肽氮占總氮比例的動態 肽氮總體的變化趨勢為第1天增加,第2天減少;且前3 d內,PMSF處理組的肽氮含量小于對照組;3d后,兩者的肽氮含量都是呈先增后減再增的狀態。第14天,PMSF處理組的肽氮含量極顯著(P<0.01)高于對照組(圖8)。

圖7 總氮中游離氨基酸的動態
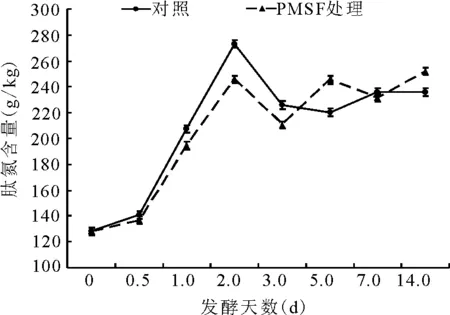
圖8 總氮中肽氮的動態變化
2.3可溶性蛋白質的動態 對照組可溶性蛋白(BSP)含量在第1天內,由開始的8.1 g/L迅速減少至5.2 g/L,隨后的13 d內逐漸減少;PMSF處理組的BSP含量在12 h下降后略有升高,而后趨于平緩下降。在第14天,PMSF處理組的可溶性蛋白的含量極顯著(P<0.01)高于對照組(圖9)。
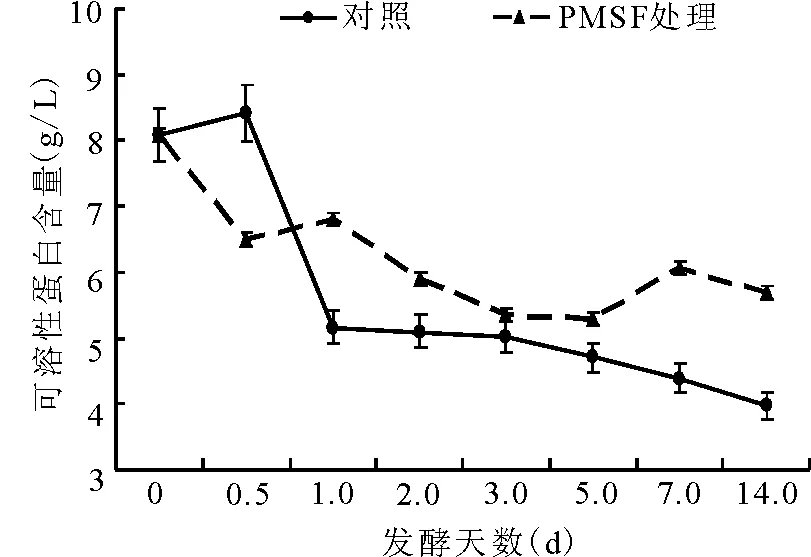
圖9 可溶性蛋白含量的動態變化
3 討論
苜蓿青貯發酵過程中可溶性蛋白被大量降解為非蛋白氮,對蛋白進一步在反芻動物瘤胃中降解利用帶來不利影響。本研究表明,5 mmol/L的苯甲基磺酰氟可以完全抑制絲氨酸蛋白酶的活性,這與James等[26]測玉米(Zeamays)中所得出的結果相同,高于Arulmani等[27]在芽孢桿菌中使用2 mmol/L苯甲基磺酰氟完全抑制其活性的結論,這可能是由于不同物種中的絲氨酸蛋白酶含量不同所造成的。苯甲基磺酰氟處理組的可溶性蛋白含量均顯著高于對照組,說明絲氨酸蛋白酶對蛋白降解有作用,且苯甲基磺酰氟抑制劑的添加阻止其對蛋白的降解作用。
在綠汁發酵液發酵的過程中pH值有上下浮動的現象,這可能是由于蛋白酶的降解,影響了青貯飼料pH值的穩定[26]。總體看來,在前3 d,pH值呈下降趨勢,隨后對照和苯甲基磺酰氟處理組的pH值基本呈平穩狀態,到7 d以后pH值維持在4.5左右,這與前人在苜蓿青貯實驗中的結果相似[28]。有研究表明[29-30],較低的pH值可以對蛋白的降解作用有抑制效果。絲氨酸蛋白酶的最適pH值為6.6,發酵2 d后對照的pH值為4.5,苯甲基磺酰氟處理的pH值在5.5左右,但是第2天時,苯甲基磺酰氟處理的非蛋白氮含量卻低于對照組,說明絲氨酸蛋白酶是苜蓿發酵過程中對非蛋白氮起作用的內肽酶的一種,即使在蛋白酶活性更合適的pH值下也沒有大量將蛋白分解成非蛋白氮。苯甲基磺酰氟添加處理組的非蛋白氮含量比對照減少8.2%;從肽氮的動態變化中可以看出,在第3天后,苯甲基磺酰氟處理的肽氮含量一直大于對照組;在發酵14 d后,肽氮的含量比對照增加7%左右,這說明絲氨酸蛋白酶在綠汁發酵液中對苜蓿蛋白降解成非蛋白氮和肽氮的過程中貢獻率較少。但苯甲基磺酰氟處理的游離氨基酸含量一直低于對照組的含量,在第14天時其含量比對照組低27%;從氨態氮的動態變化中也能看到,直到發酵第3天后,在苯甲基磺酰氟處理組中才測到氨態氮的存在,而有研究[26]表明,在青貯發酵的過程中,微生物的作用可以產生大量氨態氮,而植物蛋白酶的作用相對較小,所以苯甲基磺酰氟添加處理組在3 d后出現的氨態氮,可能并非由于絲氨酸蛋白酶的作用,而是由于某些微生物的作用形成的。
內肽酶在苜蓿青貯發酵過程中對蛋白的降解作用是造成蛋白損失的重要部分,絲氨酸蛋白酶僅是其中一種,進一步研究苜蓿其他內肽酶的特性和對蛋白降解的作用機理,以及各種內肽酶之間的相互作用,可為探討有效抑制苜蓿青貯蛋白降解的方法提供重要的科學依據。
[1] 李瑞琴,于安芬,水蓉,等.苜蓿蛋白質分組測定初探[J].草業科學,2009,26(5):99-102.
[2] 孫小龍,李平,周禾,等.苜蓿與玉米秸稈混貯的研究[J].草業學報,2009,18(5):86-92.
[3] Papadopoulos Y A,Mckersie B D.A comparison of protein degradation duriong wilting and ensiling of six forage species[J].Canadian Journal of Plant Science,1983,63:903-912.
[4] Rooke J A,Armstromg D G.The importance of the form of nitrogen on microbial protein synthesis in the rumen of cattle receiving grass silage and intrarumen infusions of sucrose[J].British Journal of Nutrition,1989,61:113-121.
[5] Givens D I,Rulquin H.Utilization by ruminants of nitrogen compounds in silage-based diets[J].Animal Feed Science and Technology,2004,114(1):1-18.
[6] 姜旭明,齊智利,齊德生,等.不同蛋白質來源的日糧對瘤胃發酵特性及蛋白質消化的影響[J].草業科學,2009,26(1):74-80.
[7] Owens V N,Albrecht K A,Muck R E.Protein degradation and fermentation characteristics of red clover and alfalfa silage harvested with varying levels of total nonstructural carbohydrates[J].Crop Science,1999,39:1873-1880.
[8] 郭旭生,周禾,劉桂霞.苜蓿青貯過程中蛋白的降解及抑制方法[J].草業科學,2005,22(11):46-50.
[9] 張鵬,王飛,張列峰,等.絲氨酸內肽酶在黃瓜葉片衰老中的作用[J].植物生理與分子生物學學報,2006,32(5):593-599.
[10] Rooke J A,Hatfield R D.Biochemistry of ensiling[A].In:Buxton D R,Muck R E,Harrison J H.Silage science and technology[M].Madison,WI,USA:ASA-CSSA-SSSA,2003:133.
[11] Slottner D,Bertilsson J.Effect of ensiling technology on protein degradation during ensilage[J].Animal Feed Science and Technology,2006,127:101-111.
[12] Gan S,Amasino R M.Making sense of senescence:molecular genetic regulation and manipulation of leaf senescence[J].Plant Physiology,1997,113:313-319.
[13] Beers E P,Woffenden B J,Zhao C S.Plant proteolytic enzymes:possible roles during programmed cell death[J].Plant Molecular Biology,2000,44:399-415.
[14] Domínguez F,Cejudo F J.Pattern of endoproteolysis following wheat grain germination[J].Physiologia Plantarum,1995,95:253-259.
[15] Wetherall J A,Armstrong D G,Finlayson H J.Reduction of proteolysis during ensilage of perennial ryegrass by protease inhibitors[J].Journal of the Science Food and Agriculture,1995,68:497-505.
[16] Nsereko V L,Rooke J A.Effects of peptidase inhibitors and other additives on fermentation and nitrogen distribution in perennial ryegrass silage[J].Science Food Agriculture,1999,79:679-686.
[17] Jiang W B,Lers A,Lomaniec E,etal.Senescence related serine protease in parley[J].Phytochemistry,1999,50:377-382.
[19] Wang B,Wu W P,Liu X Z.Purification and characterization of a neutral serine protease with nematicidal activity fromHirsutellarhossiliensis[J].Mycopathologia,2007,163:169-176.
[20] Feller U K,Soong T S,Hageman R H.Leaf proteolytic activities and senescence during grain development of field-grown corn (ZeamaysL.) [J].Plant Physiology,1977,59:290-294.
[21] 徐慶方,玉柱,李勝利,等.甲酸或綠汁發酵液對苜蓿青貯影響的研究[J].畜牧獸醫學報,2008,39(12):1709-1714.
[22] 謝飛文.凱氏定氮法測定飼料粗蛋白的注意細節[J].飼料廣角,2003,14:17-18.
[23] Licitra G,Mernandez T M,Van Soest P J.Standardization of procedures for nitrogen fractionation of ruminant feed[J].Animal Feed Science Technology,1996,57:347-358.
[24] Broderick G A,Kang J H.Automated simultaneous determination of ammonia and total amino acid in ruminal fluid and in vitro media[J].Journal of Dairy Science,1980,63:64-75.
[25] 李海玲,彭書明,李凜,等.4種常用蛋白濃度測定方法的比較[J].中國生化藥物雜志.2008,29(4):277-282.
[26] James F,Brouquisse R,Suire C,etal.Purification and biochemical characterization of a vacuolar serine endopeptidase induced by glucose starvation in maize roots[J].Biochemical Journal,1996:320:283-292.
[27] Arulmani M,Aparanjini K,Vasanthi K,etal.Purification and partial characterization of serine protease from thermostable alkalophilic Bacillus laterosporus-AK1[J].World Journal of Microbiology and Biotechnology,2007,23:475-481.
[28] Ohshima M,McDonal P.A review of the changes in nitrogenous compounds of herbage during ensilage[J].Journal of the Science of Food and Agriculture,1978,29:497-505.
[29] Guo X S,Zhou H,Zhu Y,etal.Changes in the distribution of nitrogen and plant enzymatic activity during ensilage of Lucerne treated with different additives[J].Grass and Forage Science,2007,62:35-43.
[30] Jones B A,Hatfield R D,Muck R E.Characterization of proteolysis in alfalfa and red clover[J].Crop Science,1995,35:537-541.

