垂穗披堿草ISSR反應體系的正交優化
劉新亮,德 英,趙來喜
(1.中國農業科學院草原研究所,內蒙古 呼和浩特 010010; 2.中國農業科學院研究生院,北京 100081)
垂穗披堿草(Elymusnutans)為禾本科(Gramineae)小麥族(Triticeae)披堿草屬(Elymus)多年生疏叢型草本植物,又名鉤頭草、彎穗草[1],染色體組構成為StStYYHH(2n=42)[2]。國外主要分布于俄羅斯、土耳其、印度、蒙古等地,我國主要分布于西北、西南、華北地區[1]。垂穗披堿草根莖分蘗能力強,具有極強的抗寒性和抗旱性,能適應各種不同類型的土壤,灘地、溝谷、陰坡山麓地帶到灌叢草甸和高山草甸均能生長。開花期前垂穗披堿草質地柔軟,無刺毛、剛毛,無異味,為馬、牛、羊喜食牧草,整個生長季節粗蛋白含量變化幅度較小,屬中上等品質牧草[1-6],同時也是最具經濟意義的草種[7-8]。簡單序列重復區間(inter-simple sequence repeat,ISSR)是Zietkiewicz等[9]于1994年創建的以重復序列的單一引物為主要引物序列的PCR標記,它結合了SSR和RAPD的優點,主要特點是操作簡單,遺傳多態性高,重復性好,耗資少,模板DNA用量少。基于這些優點,ISSR分子標記已廣泛應用于牧草種質資源鑒定、牧草遺傳多樣性與分類進化、DNA指紋圖庫的建立、親緣關系分析、遺傳圖譜構建、分子標記輔助育種等方面的研究[10]。ISSR分子標記在披堿草屬植物研究中的應用多見報道[11-12],而其在垂穗披堿草研究中應用相對較少。ISSR分子標記反應條件易受模板DNA、dNTPs、Mg2+、TaqDNA聚合酶、引物等因素的影響,ISSR擴增結果,若以單因素試驗,難免忽視其互作效應,而正交試驗能夠分析各因素之間的內在規律,具有均衡分散、整齊可比和效應明確的優點,能較快地找到最優組合,找出影響擴增的主要因素和次要因素[13]。本研究利用正交試驗設計,從模板DNA、dNTPs、Mg2+、TaqDNA聚合酶、引物5個因素4個水平,對垂穗披堿草ISSR-PCR反應體系進行優化,以期獲得垂穗披堿草的最佳反應體系。
1 材料與方法
1.1材料 供試的17份試驗材料由中國農業科學院草原研究所提供(表1),于2010年5月在溫室育苗,待幼苗長到一定高度,采集嫩葉,置于-80℃保存備用。參考馬嘯[11]和祁娟[3]所用引物序列,由上海生工生物工程有限公司合成(表2)。PCR所用的dNTPs、Mg2+、TaqDNA聚合酶、10×buffer(不含Mg2+)均購自大連寶生物工程有限公司(TaKaRa)。
1.2方法
1.2.1DNA提取 采用改良過的CTAB法[14]提取基因組DNA,利用0.8%的瓊脂糖凝膠電泳檢測DNA質量,利用UNICO公司生產的UN 4802型紫外分光光度計檢測DNA的濃度和DNA純度,并將質量濃度稀釋到30 ng/μL。

表1 試驗所用垂穗披堿草材料

表2 試驗所采用的引物序列
1.2.2ISSR-PCR反應體系的正交優化 以UBC822為試驗引物,引物序列為(TC)8A,用EN001樣品DNA作為模板,選用L16(45)正交表對Mg2+、Taq DNA聚合酶、模板DNA、dNTPs、引物5個因素各4個水平設計PCR擴增體系的因素-水平試驗(表3)。

表3 ISSR-PCR體系的因素水平
將表4的處理重復2次,PCR反應體系總體積為25 μL,除表4所列變化因素外,每個組合中還含有10×buffer(不含Mg2+)2.5 μL,用ddH2O補充總體積至25 μL。

表4 ISSR-PCR正交試驗數據表
1.2.3PCR擴增 PCR擴增反應是在DNAEngine(PTC-200)PCR儀上進行。PCR反應程序為:94℃預變性2 min,94℃變性1 min,51℃退火1 min,72℃延伸2 min,共40個循環,72℃延伸10 min,擴增完后4℃保存[11],用1.5%瓊脂糖凝膠電泳檢測,DL2000為Marker,在Bio-RAP凝膠成像系統成像。
1.2.4引物退火溫度的確定 在試驗最佳反應體系確定的基礎上,在DNAEngine(PTC-200)PCR儀上進行最佳退火溫度的篩選,從25條引物中篩選出多態性豐富的引物,根據理論退火溫度對每個引物進行退火溫度的梯度試驗,設置8個梯度:47.7、49.2、51.5、54.4、57.8、60.6、62.8和64.4℃。
1.2.5循環次數、延伸時間的確定 利用最佳反應體系和最適退火溫度對循環次數進行梯度試驗,設定梯度為:35、37、39、41、43和45次,每個梯度2個重復;利用最佳反應體系、最適退火溫度、最佳循環次數對體系延伸時間進行梯度試驗,設60、90、120 s 3個梯度,每個梯度2個重復。
1.2.6最佳體系的驗證 利用優化出的結果即最佳反應體系,引物的最適退火溫度、最適循環數、最適延伸時間對試驗材料進行驗證,以提高優化體系的穩定性。
2 結果與分析
2.1DNA提取結果 通過紫外分光光度計檢測,所提取的DNA OD260/OD280的比值為1.70~1.90,說明DNA純度比較高,進一步通過0.8%的瓊脂糖電泳檢測(圖1),得到清晰、無降解的條帶,說明DNA完整性較好,可用于ISSR-PCR擴增反應。

圖1 CTAB法提取的垂穗披堿草基因組DNA
2.2正交試驗的直觀分析 垂穗披堿草正交試驗的PCR產物電泳結果如圖2,正交試驗的結果不盡相同,原因可能是其組合與最佳組合組分相差較大。1~16組合擴增出的條帶分別為:0、0;4、1;6、1;1、2;8、8;8、9;9、10;10、10;2、0;9、9;10、10;7、9;4、0;8、8;8、7;6、4。可以看出處理5、6、7、8、10、11、14、15擴增條帶較多,而6、7、11、15主帶更為清晰明顯,因此這4個處理在垂穗披堿草中擴增效果最好。

從表5均值分析和表6的極差分析可知,各因素對垂穗披堿草ISSR-PCR反應的影響程度從大到小依次為:TaqDNA聚合酶、Mg2+、引物、dNTPs、模板DNA。

圖2 正交試驗PCR電泳產物(引物UBC822)

表5 因素水平均值分析
2.3方差分析 直觀分析法比較簡單易懂,只需對結果作少量計算,就可以得到最佳配合比和因素影響程度,但直觀分析法不能正確估計試驗過程中誤差的大小,不能說明某因素水平所對應的差異究竟是因素水平引起的還是試驗誤差引起的,但是方差分析能彌補這個不足,本試驗用SAS 8.0對試驗結果進行方差分析。
各因素對垂穗披堿草ISSR-PCR反應的影響程度從大到小依次為:TaqDNA聚合酶、Mg2+、引物、dNTPs、模板DNA,結果與極差分析相同(表7)。
方差分析的結果表明,模板DNA濃度、dNTPs對結果的影響未達到顯著水平;引物濃度對結果的影響達到了顯著水平,而TaqDNA聚合酶、Mg2+對結果的影響都達到了極顯著水平,所以有必要對TaqDNA聚合酶用量、Mg2+、引物濃度進行水平間的多重比較。
2.4各因素對ISSR-PCR擴增的影響
2.4.1TaqDNA聚合酶濃度對ISSR-PCR擴增的影響 TaqDNA聚合酶濃度在PCR中的用量受到反應體積、酶活性、酶耐熱性等因素的制約,TaqDNA聚合酶用量過多會引起非特異性反應,在凝膠上出現較深的背景,影響檢測結果,而且還會增加成本;TaqDNA聚合酶濃度過低,合成產物的量會減少,也會影響試驗結果。極差分析和方差分析發現,本試驗條件下TaqDNA聚合酶用量對試驗結果影響最大,與謝運海等[16]的研究結果相似。當TaqDNA聚合酶用量為1.0 U時,垂穗披堿草擴增效果最好,高于或者低于此用量,擴增條帶數變少(圖3)。從圖2可知,TaqDNA聚合酶為1.0 U時,條帶最清晰,主帶最明顯,帶數更多。經多重比較分析(圖3),TaqDNA聚合酶酶量為1.0 U時,與0.5、1.5、2.0 U 3個水平間差異均達到顯著水平。故本試驗條件下,TaqDNA聚合酶的最適用量為1.0 U。

表6 因素水平極差分析
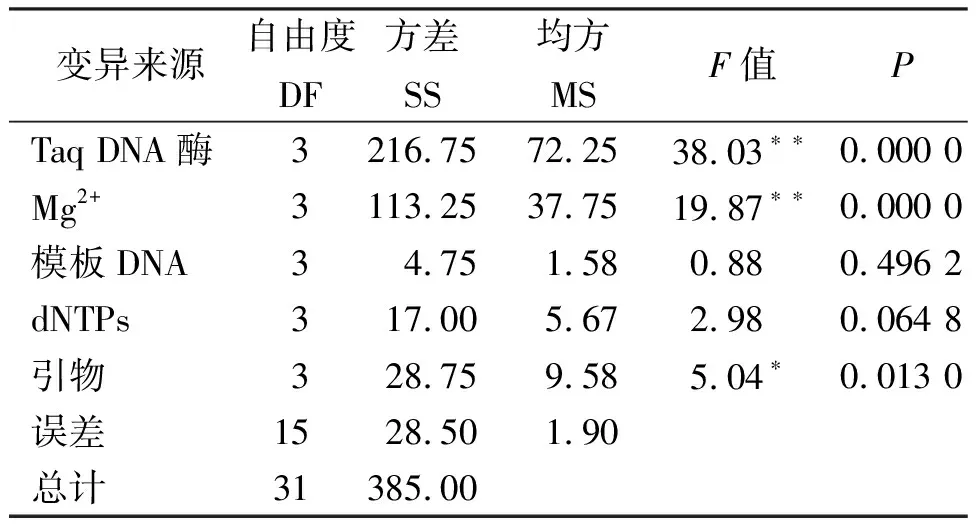
表7 正交試驗方差分析
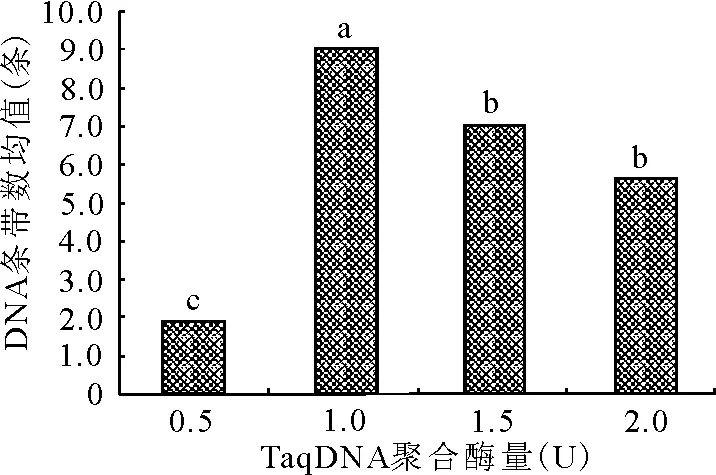
圖3 不同TaqDNA聚合酶量下DNA條帶數的均值
2.4.2Mg2+濃度對ISSR-PCR擴增的影響 TaqDNA聚合酶是Mg2+依賴性酶,對Mg2+濃度較為敏感,Mg2+濃度除影響酶活性外,還影響引物退火、模板與PCR產物的解鏈溫度、引物二聚體的形成等[10],所以Mg2+的濃度對PCR產物的特異性和產量影響明顯。過量的Mg2+會導致酶催化非特異性產物的擴增,而Mg2+濃度過低,又使酶的催化活性降低[17]。Mg2+濃度為1.0 mmol/L時擴增條帶數最少,高于此濃度時,條帶數明顯增多,濃度為2.0 mmol/L時條帶數最多(圖4)。由圖2可知,當Mg2+濃度為1.0 mmol/L時(1、5、9、13號泳道),只有1/4的泳道條帶數較明顯、清晰。多重比較表明(圖4),Mg2+濃度為1.0 mmol/L時,DNA條帶數顯著低于其他3個水平,而其他3個水平間差異不顯著。所以確定的Mg2+最適濃度為2.0 mmol/L。

圖4 Mg2+與條帶均值關系
2.4.3引物濃度對ISSR-PCR擴增的影響 ISSR擴增條帶數與引物濃度密切相關,引物濃度過低時,PCR產物量降低,引物濃度過高又會促進引物的錯誤引導,導致非特異性擴增,還會增加引物二聚體的形成[18],非特異性產物和引物二聚體又可作為PCR反應的底物,與靶序列競爭DNA聚合酶和dNTPs底物,從而使靶序列的擴增量減少[17]。當引物濃度為0.20 μmol/L時,擴增條帶數最少,低于或高于此濃度,擴增條帶數逐漸增加(圖5)。多重分析表明,引物濃度為0.25 μmol/L時,與其他3個水平均有顯著差異,且相對于其他水平,條帶也更為清晰(圖2),故確定引物濃度為0.25 μmol/L。

圖5 引物濃度與條帶均值關系
2.4.4dNTPs濃度對ISSR-PCR擴增的影響 dNTPs濃度直接影響PCR擴增,當dNTPs濃度較低時,產生的條帶較少且弱,當dNTPs濃度過低時,其與TaqDNA聚合酶競爭Mg2+,從而降低TaqDNA聚合酶活性,影響PCR結果。dNTPs在0.15、0.20和0.25 mmol/L水平上差異不顯著,三者顯著高于0.30 mmol/L(圖6),dNTPs 濃度為0.25 mmol/L時擴增條帶最清晰(圖2),主帶最明顯,當dNTPs 濃度為0.25 mmol/L時擴增條帶最多。故該試驗采用的最適dNTPs 濃度為0.25 mmol/L。

圖6 dNTPs濃度與條帶均值關系
2.4.5模板DNA濃度對ISSR-PCR擴增的影響 模板DNA是ISSR擴增的基礎,主要從純度和反應量產生影響,模板量過低,引物不能有效配對,產物量小,模板量過高則過早消耗掉引物,使退火發生在模板DNA間或PCR間,反應終止[19]。試驗所選的4個水平的模板DNA濃度對PCR擴增結果影響差異不顯著(圖7),與白錦軍等[19]結果不同,但與桂騰琴等[20]的研究結果相似,這可能是與模板DNA的純度有關。本試驗選取30~120 ng作為最佳模板質量。

圖7 模板DNA與條帶均值關系
2.5退火溫度的確定 退火溫度決定著PCR的特異性。引物復性所需的溫度和時間取決于引物堿基組成、長度,降低退火溫度能保證模板與引物穩定結合,但也可能導致產生錯誤擴增,一定范圍內提高退火溫度可減少引物和模板之間的非特異性結合,提高PCR反應的特異性。根據正交試驗結果所得的最佳反應體系,即TaqDNA聚合酶1.0 U,Mg2+2.0 mmol/L,模板DNA 30~120 ng,dNTPs 0.25 mmol/L,引物0.25 μmol/L在DNAEngine(PTC-200)PCR儀上進行退火溫度梯度試驗。由圖8可知,退火溫度較低時(47.7、49.2℃),擴增條帶較弱,較彌散,條帶不清晰,擴增條帶特異性差,54.4℃時條帶最清晰,條帶數最多,主帶最明顯,隨著退火溫度的升高擴增的條帶數減少,到60.6℃幾乎沒有條帶,由此確定引物UBC822的最適退火溫度為54.4℃。通過對篩選出的11條擴增穩定、多態性較好的引物進行了退火溫度梯度試驗,并確定了各引物的最佳退火溫度(表8)。
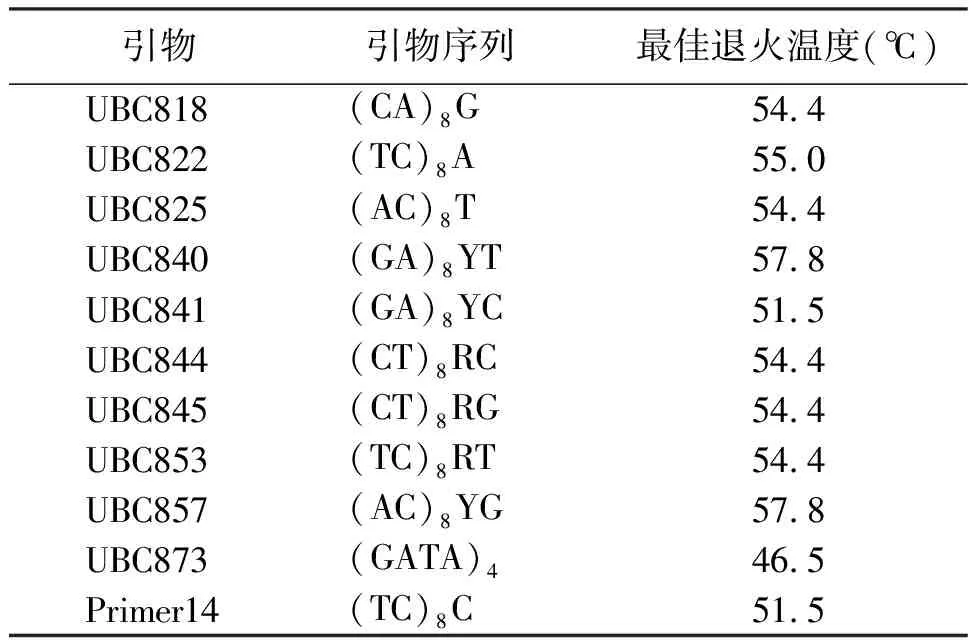
表8 試驗所選引物序列和退火溫度
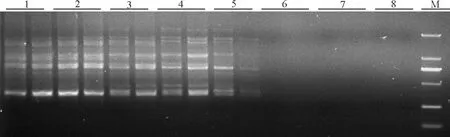
圖8 溫度梯度PCR電泳圖
2.6最佳循環數和最適延伸時間的確定 根據正交試驗結果所得的最佳反應體系,在最適退火溫度下,對PCR循環數進行梯度試驗,設置6個梯度。循環數較少時(35次)條帶不清晰,擴增不穩定,37次時擴增條帶逐漸變清晰,但其主帶不明顯,循環數為41次時擴增效果最好,循環數大于41次時,擴增結果也不理想(圖9)。因此,41次作為引物UBC822的最佳循環次數。
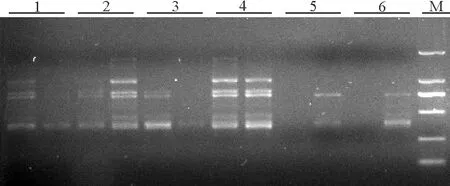
圖9 最佳循環數的選擇
延伸時間的長短取決于待擴增模板序列的長度和濃度,以及延伸溫度的高低,在條件一定的情況下,延伸時間過短無法完成擴增導致擴增產量低,延伸時間太長會引起非特異性條帶的產生[17]。利用最佳反應體系、最適退火溫度和最佳循環數,對PCR延伸時間進行梯度試驗,設置3個梯度。延伸時間為60 s時擴增條帶彌散,延伸時間為120 s時主帶不明顯也帶有一定的彌散現象,延伸時間為90 s時擴增效果最好(圖10),故確定最適延伸時間為90 s。
2.7最佳反應體系的驗證 運用正交設計所獲得的最佳反應體系和程序隨機選用引物UBC825對17份不同的野生垂穗披堿草進行ISSR擴增,結果顯示,擴增條帶清晰,穩定性好、多態性豐富(圖11),表明該反應體系和反應程序穩定性、重復性較好,適合于垂穗披堿草進行ISSR-PCR反應。

圖10 最適延伸時間的選擇
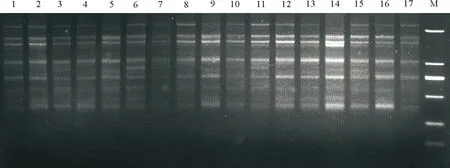
圖11 最佳反應體系的驗證
3 結論
本研究利用正交優化設計建立了垂穗披堿草的ISSR-PCR反應體系,試驗過程中對影響PCR擴增的TaqDNA聚合酶、Mg2+、模板DNA、dNTPs、引物等因素進行了正交優化,對PCR程序進行了梯度試驗,通過對擴增結果的量化分析得到了穩定性好的反應體系和擴增程序,即:TaqDNA聚合酶1.0 U,Mg2+2.0 mmol/L,模板DNA 30~120 ng,dNTPs 0.25 mmol/L,引物0.25 μmol/L;PCR擴增程序為:94℃預變性2 min,94℃變性1 min,51℃退火1 min(視不同引物而定),72℃延伸1.5 min,共41個循環,72℃后延伸10 min,擴增完后4℃保存。
正交設計相對于其他設計方法節省了人力和財力,對結果的分析更均衡更完善,但對擴增效果的評價方面帶有一定的主觀性,不能很好地評估各因素之間的交互作用,還需更客觀的評價標準。此外,在正交優化中所設置的濃度梯度較大,可采用與單因素試驗或細調性正交試驗[21]相結合的方法進一步確定最優體系。盡管如此,本研究所建立的較為穩定的ISSR-PCR反應體系,可以為垂穗披堿草的研究提供科學的理論基礎,同時為披堿草屬內其他種在品種鑒定、遺傳多樣性研究、親緣關系分析等領域提供一定的依據。
[1] 陳默君,賈慎修.中國飼用植物[M].北京:中國農業出版社,2002:119-120.
[2] 周永紅,鄭有良,楊俊良,等.10種披堿草屬植物的RAPD分析及其系統學意義[J].植物分類學報,1999,37(5):425-432.
[3] 祁娟.披堿草屬植物野生種質資源生態適應性研究[D].蘭州:甘肅農業大學,2009.
[4] 陳智華,苗佳敏,鐘金城,等.野生垂穗披堿草種質遺傳多樣性的SRAP研究[J].草業學報,2009,18(5):192-200.
[5] 馬嘯,周永紅,于海清,等.野生垂穗披堿草種質的醇溶蛋白遺傳多樣性分析[J].遺傳,2006,28(6):699-706.
[6] 嚴學兵.披堿草屬植物遺傳多樣性研究[D].北京:中國農業大學, 2005.
[7] 劉蓉,張衛國,江小雷,等.垂穗披堿草群落退化演替的植被特性及其與土壤性狀的相關性研究[J].草業科學,2010,27(10):96-103.
[8] 李治強.紫花苜蓿與垂穗披堿草混播防治褐斑病試驗[J].草業科學,2009,26(10):177-180.
[9] Zietkiewicz E,Rafalske A,Labuda D.Genome fingerprinting by simple sequence repeat(SSR)-anchored polymerase chain reaction amplification[J].Genomics,1994,20:176-183.
[10] 周延清.DNA分子標記技術在植物研究中的應用[M].北京:化學工業出版社,2005.
[11] 馬嘯.老芒麥野生種質資源的遺傳多樣性及群體遺傳結構研究[D].雅安:四川農業大學,2006.
[12] 李永祥,袁慶華.披堿草屬12個物種遺傳多樣性的ISSR和SSR比較分析[J].中國農業科學,2005,38(8):1522-1527.
[13] 蓋鈞益.試驗統計方法[M].北京:中國農業出版社,2000:28-288.
[14] 李榮華,夏巖石,劉順枝,等.改進的CTAB提取植物DNA方法[J].實驗室研究與探索,2009,28(9):14-16.
[15] 董如何,肖必華,方永水.正交設計的理論分析方法及應用[J].安徽建筑工業學院學報(自然科學版),2004,12(6):103-106.
[16] 謝運海,夏德安,姜靜,等.利用正交設計優化水曲柳ISSR-PCR反應體系[J].分子植物育種,2005,3(3):445-450.
[17] 屈伸,劉志國.分子生物學實驗技術[M].北京:化學工業出版社,2007:80-86.
[18] Jackson J A,Hemken R W.Calcium and cation-anion balance effects on feed intake,body weight gain,and hunoral response of dairy calves[J].Journal of Dairy Science,1994,77:1430-1436.
[19] 白錦軍,魏安智,王佳,等.仁用杏ISSR分析體系的正交優化[J].分子植物育種,2009 (6):1237-1244.
[20] 桂騰琴,孫敏,喬愛民,等.正交優化果梅ISSR反應體系[J].果樹學報,2009,26(1):108-112.
[21] 陳志宏,黃琳凱,張新全,等.正交優化法建立沙打旺ISSR-PCR最佳反應體系[J].安徽農業科學,2006,34(13):2980-2982.

