木糖對多年生黑麥草愈傷組織生長的影響
毛 萍,蔣 彬,馬欣榮,鄧霄禹,喬定君,楊 宏
(1.中國科學院成都生物研究所生態恢復重點實驗室,四川 成都 610041; 2.中國科學院研究生院,北京 100049; 3.成都大學生物產業學院,四川 成都 610106)
隨著生物技術的發展,轉基因技術已成為牧草和作物遺傳改良的有效途徑[1];而隨著轉基因技術的發展、轉基因作物種植面積的擴大和轉基因產品商品化程度的加深,“轉基因”以及其衍生物的生物安全性引起了政界、商界、產業界、學術界和民眾的廣泛關注和深入討論。其中,轉基因植物投放大田中,因選擇標記基因的存在而產生的安全性問題是爭論中的焦點[2-3]。目前,已經有超過50種標記基因用于科研和商業,而傳統的選擇標記基因,如抗生素和除草劑等抗性篩選基因[4],在很多國家和地區受到質疑,認為它們的存在會對人類健康、食品安全和生態環境帶來威脅。因此,選擇合適的、安全的、有效的標記基因,是擺在轉基因科研人員眼下的難題,也是必須要解決的技術問題之一[5-6]。糖類代謝酶標記基因顯示出了巨大的應用潛力。它們的編碼產物是某種糖類的分解代謝酶,轉化細胞能利用選擇劑糖類作為主要碳源,可在選擇培養基上生長擴增,而非轉化細胞因不能利用選擇劑糖類,處于饑餓狀態,生長受到抑制但不被殺死,被稱為正選擇系統(positive selection system)[7]。由于非轉化細胞不被殺死,從而避免了死亡細胞所釋放的有毒代謝物對轉化細胞的不利影響,并且選擇劑無毒副作用也有利于轉化細胞的再生,所以一般正選擇系統都可以取得較高的轉化率[8]。
木糖異構酶(xylose isomerase,xylA)基因編碼木糖異構酶,大部分植物細胞不能以木糖作為碳源,但能以D-木酮糖作為主要碳源。木糖異構酶能催化D-木糖轉化為D-木酮糖, 然后再經過磷酸戊糖途徑分解代謝,為細胞生長所利用。在以D-木糖為篩選劑的培養基上, 轉化細胞能將D-木糖轉化為D-木酮糖而獲得優勢生長,非轉化細胞因缺乏碳源而被抑制生長。早在1998年,Haldrup等[9]用D-木糖為唯一碳源的培養基篩選轉化的馬鈴薯(Solanumtuberosum)、煙草(Nicotianatabacum)和西紅柿(Lycopersiconesculentum)等植物細胞,成功地獲得了轉基因植株,且在馬鈴薯和西紅柿的轉化中,獲得了比用npt II基因作為篩選標記基因時高幾倍的轉化效率。郭新梅等[10]也認為,以木糖作為篩選劑, 可以減小潛在的生物安全隱患。該研究小組利用木糖異構酶基因作為篩選標記,在含有不同濃度木糖的培養基上篩選出玉米(Zeamays)再生植株。韋正乙[11]從大腸桿菌(Escherichiacoli)基因組中克隆了木糖異構酶基因xylA,遂利用xylA為篩選標記,建立了百脈根(Lotuscorniculatus)轉基因技術體系,其轉化效率為45.5%,與除草劑篩選轉化體系的效率(46.7%)相當,但轉化周期提前10 d以上。趙輝等[12]在對香蕉(Musanana)進行甘露糖和木糖敏感性研究過程中發現,香蕉對D-木糖特別敏感,D-木糖可以作為香蕉有效的正篩選劑。天然D-木糖以多糖的形態存在于植物中,有的細菌能利用D-木糖為碳源進行發酵,動物能夠完全或部分地利用木糖,木糖異構酶已在食品工業中達到了商品化的程度,所以在植株轉化中利用xylA基因作為選擇標記是十分安全的[13]。
多年生黑麥草(Loliumperenne)原產于亞洲和北非的溫帶地區,因具有抗寒、耐踐踏、再生能力強、成坪快等優點而被廣泛應用于世界各地的溫帶地區[14]。由于不同植物對木糖具不同的敏感性,目前多年生黑麥草轉基因的木糖篩選體系在國內外沒有任何報道。并且有關木糖對植物生長影響的研究,亦鮮有報道。為了在多年生黑麥草遺傳轉化中有效地利用木糖篩選系統,本研究以多年生黑麥草成熟種子誘導出的愈傷組織為外植體,研究以木糖為碳源對其愈傷組織培養的影響,有望為利用木糖異構酶基因作為篩選標記基因的多年生黑麥草遺傳轉化提供依據,為進一步建立穩定、有效、安全的篩選體系打下基礎。
1 材料與方法
1.1材料 多年生黑麥草種子,品種“匹克”,購自百綠國際草業有限公司。
無機鹽,有機鹽,維生素類,氨基酸,蔗糖,麥芽糖,木糖購自成都科龍試劑公司;瓊脂粉為日本進口分裝;植物凝膠(phytagel,gelrite),購自SIGMA公司;6-芐氨基嘌呤(BA)、二氯苯氧乙酸(2,4-D)、吲哚乙酸(IAA)、萘乙酸(NAA)均由荷蘭Duchefa公司生產;其他化學試劑均為進口分裝或國產分析純產品。
1.2愈傷組織誘導、培養和處理 愈傷組織誘導和繼代的基本培養基是MS培養基[15]。愈傷組織誘導培養基(callus induction medium,IM)組分為MS+7 mg/L 2,4-D (2,4-二氯苯氧乙酸)+2.4 g/L植物凝膠+30 g/L麥芽糖;愈傷組織繼代培養基(callus sub-cultivation medium,SM)組分為MS+3 mg/L 2,4-D+2.4 g/L植物凝膠+糖(不同質量濃度蔗糖、木糖或蔗糖+木糖),pH值5.8。在24~26℃下暗培養。蔗糖、木糖和蔗糖+木糖質量濃度及相應的培養基編號見表1。

表1 不同糖質量濃度處理
選取外觀均一、飽滿的成熟種子,70%乙醇處理2 min后,加入含活性氯3%~4%的次氯酸鈉水溶液(加入少量Triton X-100)滅菌15~20 min,再用無菌水清洗5~6次。超凈臺剝取胚接種到愈傷組織誘導培養基(IM)上,誘導培養3周。選取生長狀態良好、顏色淡黃、大小一致的愈傷組織,轉接到含30 g/L麥芽糖的繼代培養基中培養4周。選取生長良好的愈傷組織,剝離成直徑約4 mm大小,分別轉接到含不同糖濃度的繼代培養基(SM)中,于24~26℃黑暗條件下培養5周[15]。愈傷組織數為30個/皿,每處理5皿,共150個愈傷組織。觀察愈傷組織的生長情況,并統計接入前后愈傷組織的質量變化情況。
1.3統計分析 采用SPSS V 16.0統計分析軟件,進行DUNCAN 測驗(P<0.05)。
2 結果與分析
2.1相同濃度的蔗糖和木糖對愈傷組織生長的影響 分別以蔗糖5 g/L(編號S1)、10 g/L(S2)、20 g/L(S3)、30 g/L(S4)和木糖5 g/L(編號X1)、10 g/L(X2)、20 g/L(X3)、30 g/L(X4)以及蔗糖+木糖混合糖作為SM培養基中的碳源,添加到培養基中(表1),培養5周后觀察并統計生長量,結果見圖1、2。
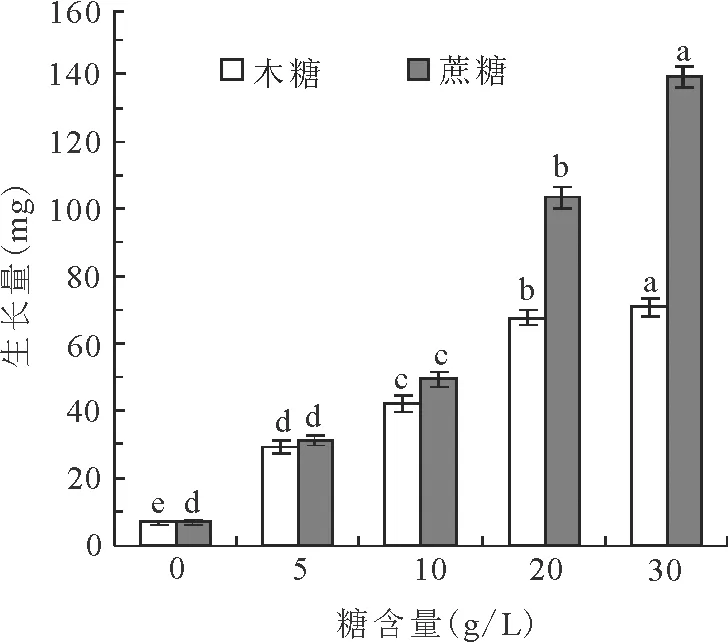
圖1 含蔗糖或木糖的培養基中愈傷組織的生長情況

圖2 蔗糖與木糖不同配比下愈傷組織的生長狀態
比較蔗糖和木糖對多年生黑麥草愈傷組織生長的影響,結果顯示,在添加單糖(0~30 g/L)的繼代培養基中,隨著糖質量濃度的增加,愈傷組織生長量呈上升趨勢,添加蔗糖的培養基中愈傷組織的生長狀況顯著(P<0.05)優于添加木糖的培養基的(圖1)。添加蔗糖的S1、S2、S3、S4愈傷組織平均生長量(mg/個)分別比添加木糖的X1、X2、X3、X4增加2.190、7.377、35.956、68.370 mg。方差分析表明,質量濃度為20和30 g/L時差異極顯著(P<0.01)(圖1)。
在添加蔗糖的培養條件下, 0、5、10、20和30 g/L質量濃度之間愈傷組織生長量差異顯著(P<0.05)。在添加木糖的培養條件下,20和30 g/L質量濃度之間愈傷組織生長量差異不顯著(P>0.05),其他質量濃度間差異顯著(P<0.05)。
上述結果表明,黑麥草愈傷組織在同等條件下,分解和利用木糖的能力要遠低于利用蔗糖作為碳源的能力,顯示多年生黑麥草不能有效利用木糖作為碳源。但是與對照相比,生長量均高于對照。并且對照組在基本MS培養基中,亦有一定程度地生長。
2.2蔗糖/木糖不同比例對愈傷組織生長的影響 以總糖含量為30 g/L作為培養基中添加糖分的質量濃度,分析蔗糖+木糖不同比例對愈傷組織生長的影響,結果見圖2。隨著木糖質量濃度增加、蔗糖降低,愈傷組織生長量下降。S4(30 g/L蔗糖)培養條件下愈傷組織生長量最大;M1(25 g/L蔗糖+5 g/L木糖)、M2(20 g/L蔗糖+10 g/L木糖)、M3(15 g/L蔗糖+15 g/L木糖)生長量較S4低,但明顯高于M4(10 g/L蔗糖+20 g/L木糖)、M5(5 g/L蔗糖+25 g/L木糖)和X4(30 g/L木糖)。S4與M1、M2和M3相比,差異顯著(P<0.05);而M1、M2和M3較之M4、M5和X4,差異也顯著(P<0.05)。
M5和X4培養條件下愈傷組織生長量為最小,平均生物量積累分別為73.50和70.66 mg/個,且二者之間差異不顯著(P>0.05)。
上述研究結果表明,木糖能顯著限制多年生黑麥草愈傷組織生長。因此,在維持細胞正常的滲透壓下,可以在培養基中加入5 g/L蔗糖+25 g/L木糖或者30 g/L木糖作為木糖篩選體系中的篩選壓。
3 討論與結論
大部分植物細胞不能以木糖作為碳源,但能以D-木酮糖作為主要碳源。木糖經過木糖異構酶催化,能將D-木糖轉化為D-木酮糖,然后再經過磷酸戊糖途徑分解代謝,為細胞生長所利用。大部分植物不含木糖異構酶基因。黑麥草是否能利用木糖作為碳源,迄今未見報道。本研究表明,木糖對黑麥草愈傷組織生長有顯著影響。愈傷組織生長量隨糖濃度增加呈增加趨勢,且在含蔗糖培養基中愈傷組織的生長顯著優于含木糖的培養基。在混合培養中(糖總量30 g/L),隨著蔗糖含量減少、木糖含量增加,愈傷組織生長量下降,表明木糖能顯著抑制多年生黑麥草愈傷組織的生長。推測多年生黑麥草愈傷組織不能有效分解D-木糖為自己所用而導致缺乏碳源,生長受到較大程度地限制。
然而,在含木糖培養基中愈傷組織能有一定程度的生長,并且生長明顯高于對照。通常在組織培養中,加30~40 g/L的蔗糖或麥芽糖或葡萄糖等,不僅為植物生長提供碳源,同時對維持植物細胞正常的滲透壓起著重要作用。因此,推測可能是一定濃度的糖,對于維持細胞的滲透壓起著重要作用,因此生長優于對照,并且以30 g/L生長最好。
觀察發現,對照亦有一定地生長。由于MS基本培養基中含有植物生長所需要的大量元素、微量元素、鐵鹽、維生素等,能維持愈傷組織的基本生長,因此沒有加糖的對照,亦能保持活性并緩慢生長。
在總糖量為30 g/L時, MS+5 g/L蔗糖+25 g/L木糖和只含有30 g/L木糖的培養基中,愈傷組織生長量最低。因此,在以多年生黑麥草愈傷組織為外植體的木糖篩選體系中,在維持細胞正常的滲透壓條件下推薦使用5 g/L蔗糖+25 g/L木糖或者只含有30 g/L的木糖作為選擇壓。該結果與在玉米中的研究結果相似[10]。由于在木糖培養基中愈傷組織有一定地生長,推測可能在選擇中會產生一定量的假陽性。有關木糖對愈傷組織分化和植株生長的影響有待進一步研究。
目前,以糖類為正向篩選標記基因的遺傳轉化體系已經應用到多種植物轉基因工作中,其中研究較多的為甘露糖陽性選擇系統[17-20]。糖類篩選系統優于抗生素和除草劑等負向篩選系統,因其不產生細胞毒性,也不會產生由于選擇劑的使用而對環境造成污染和破壞的不良后果,可作為綠色安全的篩選基因。本研究表明,木糖作為安全的選擇標記,具有潛在的應用價值。因此,異構酶在植物遺傳轉化中有良好的應用前景。但是,目前利用木糖異構酶基因的木糖陽性選擇系統在在植物轉基因的運用中,有關報道較少,相關研究尚需深入進行。
綜上所述,本研究結果為進一步建立木糖為選擇劑的黑麥草遺傳轉化系統提供了依據。
[1] 張磊,吳金霞,董芳,等.抗逆轉ABP 9基因黑麥草和高羊茅植株的鑒定[J].草業科學,2010,27(7):72-77.
[2] 錢方,高志芳,滕木子,等.轉基因作物的安全標記基因[J].河南農業科學,2007(7):17-20.
[3] 楊英軍,周鵬.轉基因植物中的標記基因研究新進展[J].遺傳,2005,27(3):499-504.
[4] 劉立俠,李桂民,路云俠,等.中國牧草生物技術的研究現狀和展望(英文)[J].草地學報,2009,17(3):389-401.
[5] Sundar I K,Sakthivel N.Advances in selectable marker genes for plant transformation[J].Journal of Plant Physiology,2008,165:1698-1716.
[6] Ramessar K,Peremarti A,Gómez-Galera S,etal.Biosafety and risk assessment framework for selectable marker genes in transgenic crop plants:A case of the science not supporting the politics[J].Transgenic Reseach,2007,16:261-280.
[7] Bojsen K,Donaldson I,Haldrup A,etal.Mannose or xylose based positive selection:United States,5767378[P].1998-06-16.
[8] Joersbo M,Okkels F T.A novel principle for selection of transgenic plant cells:Positive selection[J].Plant Cell Reports,1996,16:219-221.
[9] Haldrup A,Petersen S G,Okkels F T.The xylose isomerase gene from Thermoanaerobacterium thermosulfurogenes allows effective selection of transgenic plant cells using D-xylose as the selection agent[J].Plant Molecular Biology, 1998,37(2):287-296.
[10] 郭新梅, 張曉東, 梁榮奇,等.以木糖異構酶基因為篩選標記的玉米遺傳轉化[J].植物生理與分子生物學學報,2007,33(6):547-552.
[11] 韋正乙.利用安全篩選標記轉化系統獲得抗逆轉基因百脈根[A].中國遺傳學會第八次代表大會暨學術討論會論文摘要匯編(2004-2008)[C].重慶:中國遺傳學會第八次代表大會暨學術討論會,2008:53-54.
[12] 趙輝,范武波,朱蕓,等.香蕉對甘露糖和木糖的敏感性研究[J].果樹學報,2010,27(2):233-237.
[13] Pawan K J,Lingaraj S,Dolendro Singh N,etal.Strategies to deal with the concern about marker genes in transgenic plants:Some environment friendly approaches[J].Current Science,2002,83(2):128-136.
[14] 于玉紅,王亮,黃曉露,等.6個多年生黑麥草品種的交播性狀比較[J].草業科學,2009,26(8):172-176.
[15] Murashige T,Skoog F.A revised medium for rapid growth and bioassays with tobacco cultures[J].Plant Physiology,1962,15:473-497.
[16] 趙小強,馬暉玲,林棟,等.草地早熟禾新格萊德胚性愈傷組織原生質體培養及植株再生的研究[J].草業學報,2010,19(2):55-60.
[17] 王彩芬,付永彩.甘露糖陽性選擇系統在水稻遺傳轉化中的應用研究進展[J].中國稻米,2008(4):22-24.
[18] 彭世清,陳守才.甘露糖陽性選擇系統的建立及在番茄轉化中的應用[J].農業生物技術學報,2005,13(2):141-144.
[19] 姚明鏡,李和平,廖玉才.甘露糖對小麥不同外植體愈傷誘導及生長的影響[J].麥類作物學報,2007,27(1):7-11.
[20] 吳楊,傅華英,趙書環,等.甘露糖對甘蔗外植體再生的影響[J].福建農林大學學報,2008,37(3):225-229.

