利用科學史促進學生微粒觀的形成
蘇愛娣
(浙江省臺州市白云學校浙江臺州318000)
利用科學史促進學生微粒觀的形成
蘇愛娣
(浙江省臺州市白云學校浙江臺州318000)
分析初中科學教學中物質微粒觀的教學難點與影響教學有效性的因素,提出利用科學史促進學生微粒觀形成的方法與教學功能:從日常生活經驗到古代先哲的詰問,引發學生探究物質本原的欲望;從波義耳到道爾頓,向學生展現近代原子論提出的歷史背景;從道爾頓到盧瑟福,與學生一起探究原子結構的認識;從蓋·呂薩克到阿伏加德羅,引領學生從原子論探究分子論。
初中科學;物質微粒觀;科學史
教學實踐表明,物質的微粒觀是學生學習的難點,多數學生對這些微粒觀的認識僅處于記憶層面,很難實現認知上的內化。表現在:由于沒有將物質微粒觀內化上升到理解層面,物質微粒觀游離于科學系統之外,阻礙了化學反應本質認識的遷移;對物質結構的多元化認識不到位,往往把物質的組成一律當成是原子組成或分子組成,導致后續學習化學鍵、晶體類型和物質結構與物質性質的相關性等知識時感到困難。
影響微粒觀教學有效性的因素有很多,我認為主要有兩點:一是物質微粒觀的的學習需要學生有較強微觀想象力和學習接受力,然而不少學生缺乏對物質本原的認識和思考,缺乏物質微觀結構想象的認知基礎,缺乏與物質微粒觀相關的生活經驗;二是在探索物質微粒性的歷史長河中雖然出現了眾多的哲學思想、設計精巧結論精確的實驗,但這些實驗多數無法在中學重現,加上教師對相關科學史料掌握不多等原因,無法引領學生達到更高的認識層次。
提高微粒觀教學有效性在于學習者根據自身的生活經驗和多種形式的信息,建構物質可分性與微粒觀知識及其意義。針對物質微粒觀知識本身的發展史、實驗依據、概念意義,可以借助科學史“濃縮”人類建立物質微粒觀的過程,引領學生打開探究物質微粒觀的“閾閥”,品味科學先驅的探究歷程,從而建構起“自己”的物質微粒觀。
一、從日常生活經驗到古代先哲的詰問,引發學生探究物質本原的欲望
有關物質的可分性與微粒性學生并非沒有生活經驗,我們可以找到能引發學生思考物質是否可分以及物質是由微觀粒子組成的生活經驗。例如:我們呼吸空氣,而空氣是看不見的,那么,諸如這類看不見的物質說明了該物質是由細小到肉眼無法看見的微粒組成的;液態水和固態水是看得見摸得著的,受熱后,就變成了水蒸氣分散到空氣中去,于是,成為看不見的空氣的一部分,這說明,可見的物質也可轉變成很細小的看不見的微粒,物質的有形與無形是可以相互轉化的;一張紙我們可以輕易地撕成兩半,那么,有沒有想過,一直不停地撕下去,會有盡頭嗎?
早在我國春秋戰國時期,我們的先哲就提出了相似的詰問:如《莊子·天下》中的“一尺之棰,日取其半,萬世不竭”,他主張物質結構是無限可分的,但最終結果是什么,并沒有說;又如《管子·心術上》中的“道在天地之間也,其大無外,其小無內”,“無內”者,不可分割之謂也,他主張物質結構有限可分的,至于能分到哪個層次,同樣也沒有明確回答。
關于物質是否可分的問題同樣也引起古希臘哲學家的興趣,公元前6世紀古希臘的泰勒斯就開始對物質可分性問題進行了探討,也出現過兩種觀點:一是“種子論”,主張物質結構無限可分;二是“原子論”,主張物質結構有限可分。
這些古代先哲的詰問與觀點都停留在哲學的思考層面上,不能成為科學觀點。這些爭論導致人類對物質的微粒組成的認識不斷深入。直到18世紀后半葉,道爾頓提出了科學的原子論,揭開近現代科學的物質微粒觀的序幕。
二、從波義耳到道爾頓,向學生展現近代原子論提出的歷史背景
“元素”、“原子”等概念對初學微粒觀的學生來說因缺乏認知基礎而成為難點。在學習道爾頓的原子論觀點時,如果撇開道爾頓提出原子論的歷史背景而從現代原子論的視角分析其觀點的錯誤性,無助于學生形成科學的原子觀,不利于培養學生的科學素養。在教學中,有必要將如下科學史作為閱讀素材,向學生展現當時風起云涌的科學潮。
最早提出“元素”這一概念的是古希臘一位著名的唯心主義哲學家柏拉圖,他認為是萬物都源自“火、水、氣、土”四元素。為了確定科學的化學,英國著名科學家波義耳通過一系列實驗,對傳統的元素觀產生了懷疑,提出:只有那些不能用化學方法再分解的簡單物質才是元素,作為萬物之源的元素,將不會是古希臘的“四種”而一定會有許多種。經三百多年的發展,直到20世紀初終于形成現代意義上的元素概念:具有相同核電荷數的同一類原子的統稱。
一百多年后,又一位英國著名科學家道爾頓在研究氣體性質的基礎上提出了氣體的熱膨脹定律、分壓定律等。為了解釋說明這些定律,道爾頓在1803年系統地提出了他的原子論,1808年道爾頓發表了“圖形加字母”的原子符號。道爾頓的原子論使化學成為科學,促進了化學的快速發展。然而,原子是否還可再分的爭論并沒有停息,相反,更激發起科學家的探索興趣。
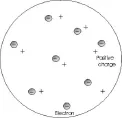
圖1
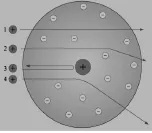
圖2
三、從道爾頓到盧瑟福,與學生一起探究原子結構的認識
結合相關史料,與學生一起探究“原子結構”教學片段實錄如下:
師:1803年,道爾頓創立了原子學說,他的主要觀點是:物質的基本組成是原子,原子就像一個小得不能再小的實心球。道爾頓提出原子學說,在科學上產生積極影響,使化學成為近現代意義上的科學。近100年后,又一位英國人湯姆生在實驗中發現,從原子中能跑出比它質量小1700倍帶負電的電子來。如果你是湯姆生,在發現原子內有電子的時候,你會產生怎樣的想法?
生1:原子是不帶電的,而電子是帶負電的,這不是有矛盾嗎?
生2:原子是電中性的,既然能分離出帶負電的電子,肯定還有帶正電的微粒。
生3:電子質量極小,肯定有質量較大的微粒。
生4:說明道爾頓所認為的原子是不可再分實心球觀點是錯誤的。
師:根據你發現的問題,結合你所學過的知識,你認為原子的結構可能是怎么樣的呢?
生1:原子應該由電子和另外一個質量比電子大、帶正電的微粒組成。
生2:而且電子帶的電荷數與另一帶正電的微粒所帶的電荷數應該是相等的,只有這樣,原子才能呈電中性。
師:根據科學實踐和當時的實驗觀測結果,物理學家發揮了他們豐富的想象力,提出了各種不同的原子模型。1897年英國科學家湯姆生提出的“葡萄干蛋糕模型”。他認為原子是一個平均分布著正電荷的球體,電子分布在球體中,很有點像葡萄干點綴在一塊蛋糕里(如圖1)。
根據你所學過的知識,你對湯姆生模型有什么疑問嗎?你認可湯姆生模型嗎?
生:帶負電的電子怎么可能嵌在帶正電的球體中存在呢,它們的電性不是會相互中和了嗎,怎么還能保持著自己的電性呢?
師:盧瑟福用α粒子轟擊金箔,發現絕大多數α粒子就像炮彈穿越空氣一樣沒有發生什么變化,只有極少數的粒子發生了偏轉,有的甚至被反彈回來(圖2)。同時播放α粒子轟擊金箔的動畫。
如果你是盧瑟福,當你發現了這些現象之后,你會怎么想?
生1:α粒子有的有偏轉、有的被反彈、有的不改變原來的路線,說明原子內部的結構是不均勻的。
生2:大多數的α粒子能夠直接穿過去,說明原子內部大部分是空心的。
生3:α粒子是帶正電的,它發生偏轉也有可能是受到原子內部帶正電的微粒的排斥。
生4:也有可能是撞到什么東西上,被撞偏了。
……
師:盧瑟福就是根據當時的發現,提出了“盧瑟福模型”。認為原子的中心是一個帶正電荷的核,它的質量幾乎等于原子的全部質量,電子在它的周圍沿著不同的軌道運轉,就像行星環繞太陽運轉一樣,所以又稱為“太陽系模型”。
生:太陽系模型中的正負電荷不是會吸到一起嗎?為什么它們還能夠保持一定的距離?
師:兩年后,丹麥科學家玻爾在此基礎上又提出新的原子結構模型,認為電子在原子核外空間的一定軌道上繞核做高速運動,即“分層模型”(如圖3)。到近代,科學家們又提出了“電子云模型”(如圖4)。若干年后,人們可能還會提出更加完善的模型。
原子結構模型就是這樣經過科學家們的不斷發現,不斷探索而得到逐步的完善和不斷的修正,使模型越來越與事物的本質接近。
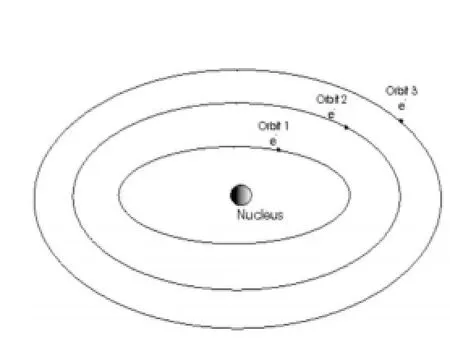
圖3

圖4
四、從蓋·呂薩克到阿伏加德羅,引領學生從原子論探究分子論
法國科學家蓋·呂薩克提出了一個極其重要的假說:在同溫同壓下,相同體積的不同氣體無論是單質還是化合物都含有相同數目的原子(實為分子,因當時還沒有“分子”一詞)。
按蓋·呂薩克的觀點,相同體積的不同氣體中的原子數相同,那么,由1體積的氫與1體積的氯化合后生成2體積的氯化氫中,每個氯化氫“原子”都只能是由半個原子的氫和半個原子的氯所組成,這樣的“半個原子”是與道爾頓原子論中關于原子不可分割和最小的觀念相矛盾。這說明,原子論需要進一步發展,必須在其中加入新的概念方能克服之。
1811年6月意大利科學家阿伏加德羅在道爾頓原子論中引入了“分子”概念,提出了分子學說。初步解決了道爾頓原子論的內在矛盾及其外化的“半個原子”問題,從而使近代科學的“原子—分子”論趨于完美。然而,阿伏加德羅沒能對分子作出系統的明確論證,加上當時化學界權威的極力反對,這一學說并沒有得到當時化學界的認同。
1860年,意大利科學家坎尼扎羅對分子概念進行了理論論證,將道爾頓的原子論和阿伏加德羅的分子學說加以有機整合,終于提出了科學的“原子——分子”理論,加上此時無機化學與有機化學得到迅速發展,該學說終于得到了化學界的肯定。
[1]錢長康.從物質可分性看元極學與現代科學相結合.http://www.chinaexpertsweb.net/yxlw001
[2]張玉春.“原子—分子”論的創立及其對我們的啟迪[J].化學教育,2009,(12)
[3]劉兵,江洋.科學史與教育[M].上海:上海交通大學出版社,2008
[4]張穎之,劉恩山.科學本質教育的課堂教學方法初探[J].課程·教材·教法,2007,(10)
[5]王秀紅.運用科學史培養初中生的科學本質觀[J].化學教育,2005,(12)
1008-0546(2011)07-0005-03
G633.8
B
10.3969/j.issn.1008-0546.2011.07.002

