飼料中添加枯草芽孢桿菌對草魚生長性能、免疫和抗氧化功能的影響
沈文英 李衛芬 梁 權 鄧 斌 陳南南 周緒霞
我國水產養殖的集約化發展導致水環境日益惡化,病害頻繁發生,直接影響養殖動物的生長發育,甚至導致養殖動物的大量死亡。益生菌因其安全性好且具有促進動物生長和改善水質等功能而被廣泛應用于水產養殖業中[1]。研究表明,益生菌的促生長機理主要與改善水體水質、調節腸道菌群平衡、提高機體免疫和抗氧化功能有關[2-5]。益生菌作為飼料添加劑可以促進魚類免疫器官的成熟[6]、刺激呼吸爆發活性[7]、提高免疫和抗氧化能力[8-10],從而提高其抗病力和促進生長。研究表明,益生菌芽孢桿菌能提高鯽魚[11]、南美白對蝦[1-2,10]的消化酶活力和免疫能力。而有關枯草芽孢桿菌(Bacillus subtilis)對魚類免疫和抗氧化功能的研究較少。因此,本試驗擬在草魚(Ctenopharyngodon idellus)飼料中添加枯草芽孢桿菌,探討其對草魚生長性能、免疫和抗氧化功能的影響,為枯草芽孢桿菌在草魚養殖中的應用提供理論依據。
1 材料與方法
1.1 試驗飼料
試驗用枯草芽孢桿菌制劑由本實驗室制備,枯草芽孢桿菌含量為 1×108CFU/g。根據草魚配合飼料營養標準(SC/T 1024—1997)配制基礎飼料,基礎飼料組成及營養水平見表 1。根據預試驗并結合參考文獻[10],在基礎飼料中添加 1‰枯草芽孢桿菌制劑,使得試驗飼料中枯草芽孢桿菌含量達到 1×105CFU/g。
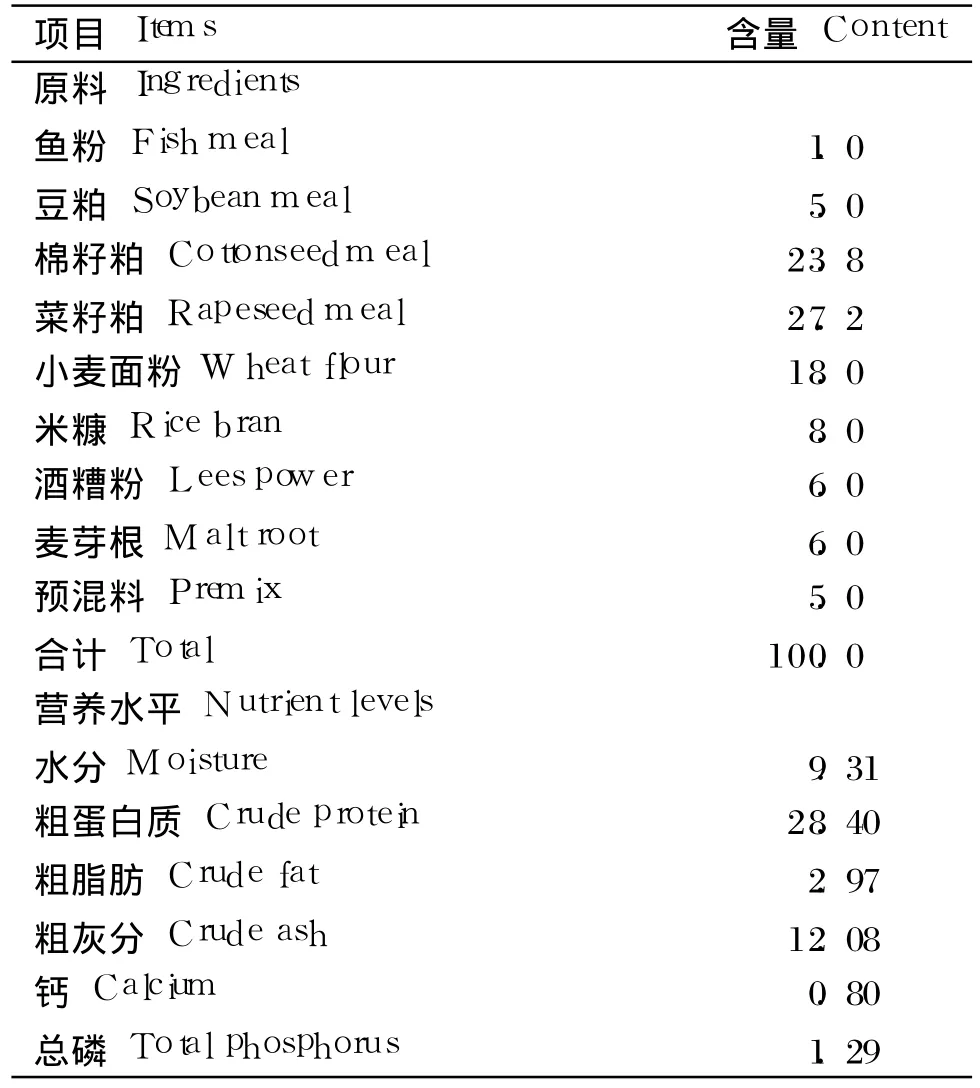
表1 基礎飼料組成及營養水平(風干基礎)Table 1 Composition and nutrient levels of the basal diet(air-dry basis) %
1.2 試驗設計與飼養管理
試驗用草魚由浙江省紹興市淡水養殖場提供,在試驗前先馴養 1周,然后選取體重(51.0±2.3)g的健康無病草魚 300尾,隨機分成 2組(對照組和試驗組),每組 3個重復,每個重復 50尾魚。對照組飼喂基礎飼料,試驗組飼喂試驗飼料(含枯草芽孢桿菌 1×105CFU/g)。按草魚體重3%的日投餌量飼喂,每天分 3次(08:00、12:00和19:00)投餌,試驗期為 45 d。試驗在室內過濾式循環水系統中進行,試驗魚以重復為單位飼養于圓形水族箱(體積為 2.75 m3,實際水體積為1.33 m3)內,試驗用水為充分曝氣的水庫水,每周換水 1/3。試驗期間水溫為 18~25℃,用ACO-318型空氣壓縮機 24 h增氧。
1.3 樣品采集
飼養試驗結束后,停飼 24 h,從每個重復隨機抽取 10尾魚,以 0.2 g/L的 3-氨基苯甲酸乙酯甲基磺酸鹽麻醉后取樣。
血清樣品:通過尾椎靜脈采血,將血樣在 4℃冰箱中靜置 24 h后,4℃4 000 r/min離心15 min,取上清液于 1.5 mL Eppendorf管中,立即保存于-80℃冰箱中備用。
肝胰臟樣品:將每尾魚的肝胰臟裝于密封樣品袋中,立即用液氮快速冷凍,然后轉至 -80℃冰箱中保存。準確稱取 0.5 g草魚肝胰臟樣品于滅菌的 10 mL離心管中,加 4.5 mL預冷滅菌的生理鹽水,然后用自動勻漿器于冰上勻漿,得 10%組織勻漿液。將 10%組織勻漿液于 4℃ 4 000 r/min離心 20 min,取上清液于 1.5 mL Eppendorf管中,立即保存于 -80℃冰箱中備用。
1.4 指標測定與方法
1.4.1 生長性能
在養殖試驗開始和結束時分別對草魚進行稱重,計算增重率(WGR)和特定生長率(SGR),公式如下:
WGR(%)=100×(終末體重 -初始體重)/初始體重;
SGR(%/d)=100×(ln終末體重 -ln初始體重)/試驗天數。
1.4.2 血清免疫指標
血清總蛋白和白蛋白含量分別采用考馬斯亮藍 G-250染料法和溴甲酚綠法測定,球蛋白含量即為總蛋白含量減去白蛋白含量。血清溶菌酶(LZM)活性采用比濁法測定,髓過氧化物酶(MPO)活性采用比色法測定,堿性磷酸酶(AKP)活性采用磷酸苯二鈉法測定,谷草轉氨酶(GOT)和谷丙轉氨酶(GPT)活性均采用賴氏法測定。血清補體 3(C3)和免疫球蛋白 M(IgM)含量分別采用速率散射濁度法和免疫透射比濁法測定。血清總蛋白、白蛋白含量以及 LZM、MPO、AKP、GOT和 GPT活性的測定所用試劑盒均購自南京建成生物工程研究所,而血清 C3和 IgM含量的測定所用試劑盒購自寧波慈城生化試劑廠。
1.4.3 血清和肝胰臟抗氧化指標
血清和肝胰臟中超氧化物歧化酶(SOD)活性采用鄰苯三酚自氧化法測定,過氧化氫酶(CAT)活性采用紫外吸收法測定,谷胱甘肽過氧化物酶(GSH-Px)活性和還原型谷胱甘肽(GSH)含量均采用 5,5-二巰基雙 -2-硝基苯甲酸(DTNB)法測定,抗超氧陰離子自由基(O-2?)活性采用鄰苯三酚自氧化法測定,丙二醛(MDA)含量采用硫代巴比妥酸(TBA)法測定,總抗氧化能力(T-AOC)采用比色法測定。血清和肝胰臟中 SOD、CAT、GSH-Px、抗 O-2?活性,GSH、MDA含量以及 TAOC的測定所用試劑盒均購自南京建成生物工程研究所。
1.5 數據統計與分析
利用 Excel對數據進行處理,數據均以平均值 ±標準差表示。采用 SPSS 16.0統計軟件對數據進行配對 t檢驗分析,P<0.05表示存在顯著差異。
2 結 果
2.1 飼料中添加芽孢桿菌對草魚生長性能的影響
由表 2可見,與對照組相比,試驗組草魚的WGR提高了 21.78%,SGR提高了 16.67%,差異達到顯著水平(P<0.05)。

表2 飼料中添加枯草芽孢桿菌對草魚生長性能的影響Table 2 Effects of dietary Bacillus subtilis on growth performance of grass carp
2.2 飼料中添加枯草芽孢桿菌對草魚免疫功能的影響
由表 3可知,與對照組相比,試驗組草魚血清中 IgM、C3含量和 AKP活性顯著升高(P<0.05),而 MPO和 GPT活性則顯著降低 (P<0.05)。飼料中添加枯草芽孢桿菌對草魚血清中總蛋白、白蛋白、球蛋白含量,白球比以及 LZM和GOT活性無顯著影響(P>0.05)。

表3 飼料中添加枯草芽孢桿菌對草魚血清免疫指標的影響Table 3 Effects of dietary Bacillus subtilis on serum immune indices of grass carp
2.3 飼料中添加枯草芽孢桿菌對草魚抗氧化功能的影響
由表 4可知,與對照組相比,試驗組草魚血清和肝胰臟中 T-AOC以及 CAT、SOD活性和肝胰臟GSH含量顯著升高(P<0.05),血清 T-AOC以及CAT、SOD活性分別提高了 18.31%、44.23%和11.01%,肝胰臟 T-AOC,CAT、SOD活性和 GSH含量分別提高了 37.60%、52.00%、39.05%和51.39%;血清和肝胰臟中抗 O-2?活性和 MDA含量均顯著降低(P<0.05),抗 O-2?活性分別降低了 21.73%和 25.97%,MDA含量分別降低了48.62%和 12.62%。飼料中添加枯草芽孢桿菌對草魚血清和肝胰臟中 GSH-Px活性以及血清中GSH含量無顯著影響(P>0.05)。
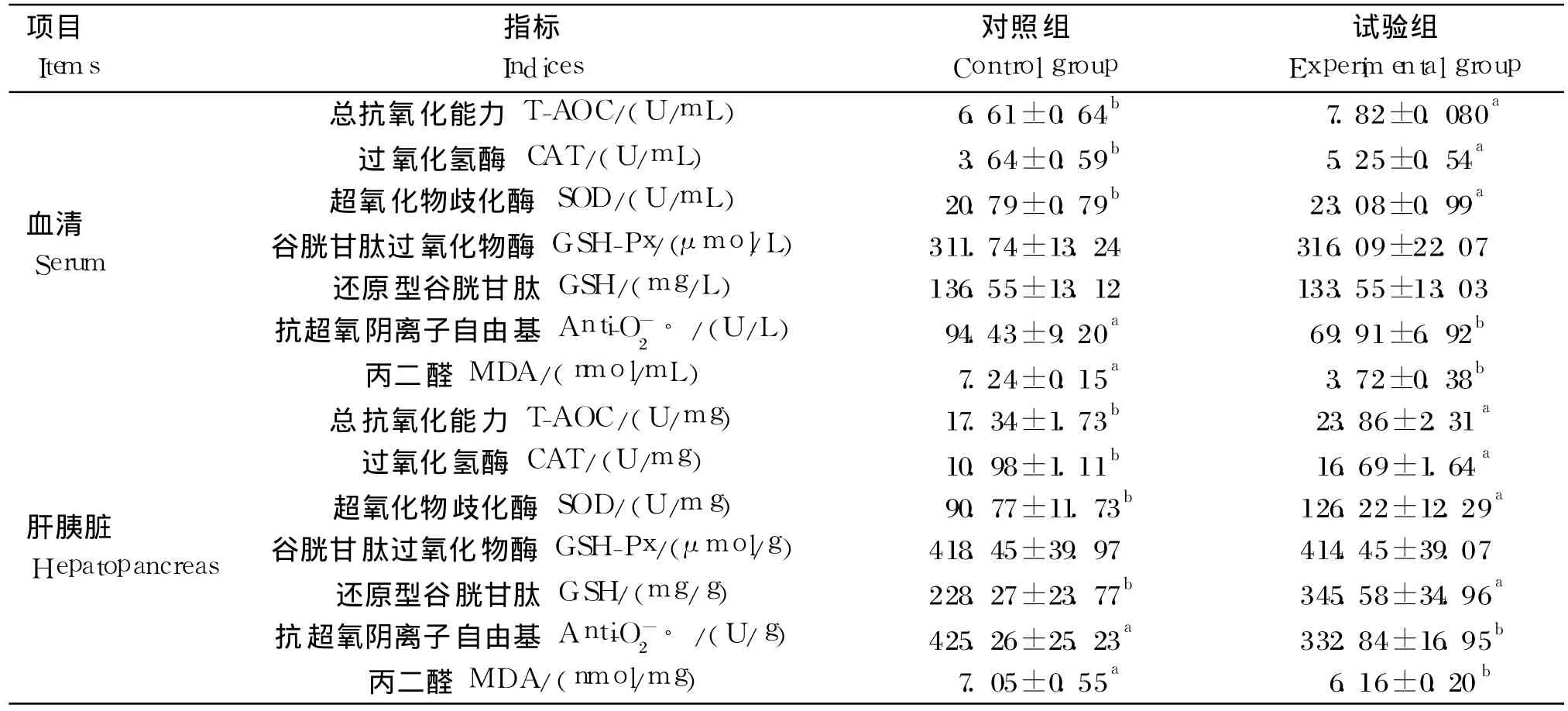
表4 飼料中添加枯草芽孢桿菌對草魚血清和肝胰臟抗氧化指標的影響Table 4 Effects of dietary Bacillus subtilis on antioxidant indices in serum and hepatopancreas of grass carp
3 討 論
益生菌在水產養殖中應用的研究主要集中于改善水質和促進水產動物生長方面[2-5],而對水產動物自身免疫和抗氧化功能影響的報道較少。研究表明,枯草芽孢桿菌投喂鯉魚能顯著提高鯉魚的巨噬細胞呼吸爆發活力和抗嗜水氣單胞菌的能力,促進鯉魚免疫器官的成熟[6]。枯草芽孢桿菌和乳酸菌單獨或復合投喂能提高金頭海鯛(Sparus aurata)非特異性免疫力[8]。鼠李糖乳桿菌(Lactobacillus rhamnosus)可刺激虹鱒魚(Oncorhynchus mykiss)巨噬細胞的呼吸爆發活力[7]。本試驗結果顯示,飼料中添加枯草芽孢桿菌能顯著提高草魚的 WGR和 SGR,提高草魚血清中 IgM、C3含量和AKP活性。這說明飼料中添加枯草芽孢桿菌可以提高草魚部分特異性和非特異免疫功能。飼料中添加芽孢桿菌等益生菌增強動物機體免疫功能的機理可能是通過改善水生動物腸道微生態環境和通過自身分泌免疫激活劑來實現的[12-15],芽孢桿菌通過口服作用于腸道集合淋巴結的抗原結合位點或通過調整動物的微生物群間接地發揮免疫賦活的作用,提高機體的局部或整體防御功能,進而起到防病、抗病的作用[16]。此外,本試驗還檢測了草魚血清 GPT和 GOT活性,發現試驗組草魚血清GPT和 GOT活性均低于對照組,這與朱學芝等[17]在凡納濱對蝦上得到的結果一致,表明枯草芽孢桿菌對草魚的肝胰臟功能無損傷。
本試驗結果顯示,飼料中添加枯草芽孢桿菌可通過提高血清和肝胰臟中的相關抗氧化物的活性或含量來增強草魚血清和肝胰臟的抗氧化功能,具體表現為草魚血清中 T-AOC,CAT、SOD活性和肝胰臟中 T-AOC,CAT、SOD活性和 GSH含量顯著提高,血清和肝胰臟中抗 O-2?活性和MDA含量顯著降低。這與前人得出的地衣芽孢桿菌提高三角帆蚌[9]和枯草芽孢桿菌提高凡納濱對蝦[10]抗氧化功能的結果一致。研究表明,芽孢桿菌和乳酸菌均具有清除機體羥自由基、CAT以及抗脂質過氧化的能力[9-10,18]。大多數乳酸菌通過提高 SOD活性和 GSH含量來抵抗機體的氧化[19-20],而枯草芽孢桿菌隨飼料進入魚體后也可能通過自身分泌抗氧化酶或者作為激活劑促進機體抗氧化酶分泌,從而有效清除自由基,阻止脂質過氧化。因此在飼料中添加適量枯草芽孢桿菌可以提高草魚的免疫和抗氧化功能,減輕自由基對機體的損傷,減少草魚養殖過程中的病害發生。這也是枯草芽孢桿菌作為飼料添加劑促進草魚生長的原因之一。
4 結 論
①飼料中添加枯草芽孢桿菌可促進草魚的生長。
②飼料中添加枯草芽孢桿菌可提高草魚的部分特異性和非特異免疫功能,且對其肝胰臟功能無不良影響。
③飼料中添加枯草芽孢桿菌可提高草魚的抗氧化功能,進而減輕自由基對機體的損傷。
[1] GATESOUPE F J.The use of probiotics in aquaculture[J].Aquaculture,1999,180:147-165.
[2] THOMPSON F L,ABREU P C,CAVALLI R.The use of microorganisms as food source for Penaeus vannamei larvae[J].Aquaculture,1999,174:139-153.
[3] VERSCHUERE L,ROMBAUT G,SORGELOOS P,et al.Probiotic bacteria as biological control agents in aquaculture[J].Mocrobiology and Molecular Biology Reviews,2000,64:655-671.
[4] 王夢亮.光合細菌對鯉魚養殖水體生態系統的影響[J].水生生物學報,2001,25(1):98-101.
[5] 沈錦玉,尹文林,劉問,等.光合細菌 HZPSB對水產養殖水質的改良和對魚類促生長作用[J].科技通報,2004,20(6):481-484.
[6] 劉克琳,何明清.益生菌對鯉魚免疫功能影響的研究[J].飼料工業,2000,21(6):24-25.
[7] NIKOSKELAINEN S,OUWEHAN A,SALMINEN S,et al.Protection of rainbow trout(Oncorhynchus mykiss)from furunculosis by Lactobacillus rhamnosus[J].Aquaculture,2001,198:229-236.
[8] SALINAS I,CUESTA A,ESTEBAN M A,et al.Dietary administration of Lactobacillus delbrüeckii and Bacillus subtilis,singleor combined,on gilthead seabream cellular innate immune responses[J].Fish&Shellfish Immunology,2005,19(1):67-77.
[9] 沈文英,余東游,李衛芬,等.地衣芽孢桿菌對三角帆蚌消化酶活性、免疫指標和抗氧化指標的影響[J].動物營養學報,2009,21(1):95-100.
[10] SHEN W Y,FU L L,LI W F,et al.Effects of dietary supplementation with Bacillus subtilis on growth perfermance,immuneresponse and antioxidant activities of the shrimp(Litopenaeus vannamei)[J].Aquaculture Research,2010,41:1691-1698.
[11] 劉波,劉文斌,王恬.地衣芽孢桿菌對異育銀鯽消化機能和生長的影響[J].南京農業大學學報,2005,28(4):80-84.
[12] 胡毅,譚北平,麥康森,等.飼料中益生茵對凡納濱對蝦生長、腸道茵群及部分免疫指標的影響[J].2008,15(2):244-251.
[13] 李長慧.光合細菌的營養價值及在養殖業中的應用[J].青海大學學報:自然科學版,2001,19(2):34-35.
[14] 邢芳芳,孔祥峰,印遇龍,等.微生態制劑對水產養殖動物的作用機理及科學應用[J].中國飼料添加劑,2007,9:38-42.
[15] 周利梅.微生態制劑在飼料中的應用[J].糧食與飼料工業,2000,11:29-31.
[16] 潘康成,楊漢博.飼用芽孢菌作用機理的研究進展[J].飼料工業,1997,18(9):32-34.
[17] 朱學芝,鄭石軒,潘慶軍,等.芽孢桿菌對凡納濱對蝦免疫和生化指標的影響[J].飼料研究,2007,4:56-59.
[18] ITO M,OHISHI K,YOSHIDA Y.Antioxidative effects of lactic acid bacteria on the colonic mucosa of iron-overloaded mice[J].Agriculture Food Chemistry,2003,51(15):4456-4460.
[19] 孟凡倫,馬桂榮,孔健.益生素制劑在中國對蝦養殖中的應用研究[J].山東大學學報:自然科學版,1998,33(1):101-105.
[20] AL-DOHAIL M A,HASHIM R,ALIYU-PAIKO M.Effects of the probiotic,Lactobacillus acidophilus,on the growth performance,haematology parameters and immunoglobulin concentration in African catfish(Clarias gariepinus,Burchell 1822)fingerling[J].Aquaculture Research,2009,40:1642-1652.

