pTAT-XIAP融合蛋白表達載體的構(gòu)建及其在大腸桿菌中的表達
張曉紅,夏春波,劉源劼,蔣常文,門 楠
(桂林醫(yī)學院人體解剖學教研室,廣西桂林541004)
X連鎖凋亡抑制蛋白(XIAP)是IAP家族中最有效的Caspase抑制劑[1],可直接抑制Ccaspase并可多途徑調(diào)節(jié)細胞凋亡[2],與腫瘤的發(fā)生、發(fā)展及預(yù)后有密切關(guān)系。但XIAP是大分子物質(zhì),難以通過血腦屏障而限制了其臨床應(yīng)用[3]。研究顯示人類免疫缺陷病毒—反式轉(zhuǎn)錄激活因子(TAT)蛋白的轉(zhuǎn)導(dǎo)域(PTD)是TAT蛋白的堿性氨基酸區(qū)[4,5],是轉(zhuǎn)導(dǎo)功能較強而確切的一種PTD。以TAT連接構(gòu)成融合蛋白,在體內(nèi)、外已成功使膠質(zhì)細胞源性神經(jīng)營養(yǎng)因子等生物大分子跨越血腦屏障至腦內(nèi)[6]。2010年4~9月,我們將大鼠 XIAP基因克隆至pTAT-HA質(zhì)粒載體,構(gòu)建了pTAT-XIAP融合蛋白表達載體,旨在為其用于臨床神經(jīng)系統(tǒng)疾病的治療奠定基礎(chǔ)。
1 材料與方法
1.1 材料 質(zhì)粒及菌株:pTAT-HA質(zhì)粒(美國Steven F Dowdy惠贈),BL21plysS感受態(tài)細胞(TI ANGEN公司)。主要試劑:UNIQ-10柱式質(zhì)粒小量抽提試劑盒(Sangon公司),DNA Marker(MBI公司),考馬斯亮藍蛋白測定試劑盒(南京建成科技有限公司),蛋白Marker(Fermentas公司),IPTG、考馬斯亮藍R250染色液、尿素、咪唑(Amresco公司),氨芐青霉素。
1.2 實驗方法
1.2.1 XIAP基因合成 根據(jù)大鼠XIAP的cDNA序列由上海生工公司合成基因,兩端帶有Nco I和Xho I酶切位點。
1.2.2 pTAT-XIAP融合蛋白表達載體構(gòu)建 用Nco I和Xho I酶對pTAT-HA質(zhì)粒進行雙酶切,將XIAP基因插入Nco I和Xho I酶切位點,構(gòu)建pTAT XIAP融合蛋白表達載體。取50 μl BL21plysS感受態(tài)細胞于冰水浴,加入5 μl pTAT-XIAP質(zhì)粒DNA,冰浴靜置30 min,將離心管置于42℃水浴90 s,冰浴冷卻3 min,向離心管中加入450 μl LB液體培養(yǎng)基(不含抗生素),37℃搖床震蕩培養(yǎng)45 min。取轉(zhuǎn)化菌液加到LB固體培養(yǎng)基(含氨芐青霉素),37℃培養(yǎng)12~16 h。以未轉(zhuǎn)化菌和轉(zhuǎn)化pTAT-HA空載體的菌株作為對照。
1.2.3 pTAT-XIAP質(zhì)粒擴增及鑒定 挑取pTATXIAP質(zhì)粒陽性菌落接種至LB液體培養(yǎng)基培養(yǎng)過夜,以UNIQ-10柱式質(zhì)粒小量抽提試劑盒說明書操作,獲取質(zhì)粒DNA,1%瓊脂糖凝膠上電泳,凝膠成像系統(tǒng)檢測。質(zhì)粒于-80℃保存?zhèn)溆谩?/p>
1.2.4 pTAT-XIAP融合蛋白在大腸桿菌中的誘導(dǎo)表達及可溶性分析 將陽性克隆菌落接種于含氨芐青霉素的LB固體培養(yǎng)基中,37℃過夜培養(yǎng),挑取轉(zhuǎn)化的陽性菌落置于3 ml含氨芐青霉素100 mg/L的LB培養(yǎng)液中,37℃搖床培養(yǎng)過夜,取活化的大腸桿菌(pTAT-XIAPBL21plysS)菌液接種于 10 ml LB (Amp 100 mg/L)培養(yǎng)液中,當OD600達0.8~1時,IPTG 30℃誘導(dǎo)表達4 h。離心收集誘導(dǎo)菌,PBS洗滌2次,用菌裂解液[含0.5 mol/L的NaCl、0.02 mol/L的Tris-HCI(pH7.9)、0.01 mol/L的咪唑]重懸菌體,4℃靜置30 min,冰浴下超聲破菌,4℃、12 000 r/min離心10 min,留取總蛋白、上清進行電泳分析,沉淀部分分別用2 M和4 M尿素洗滌,8 M尿素溶解包涵體于4℃過夜。將總蛋白、上清和包涵體蛋白及空質(zhì)粒轉(zhuǎn)化菌,加入1×SDS凝膠加樣緩沖液100℃煮沸10 min,沉淀4℃離心1 min取上清加樣,用12%聚丙烯酰胺凝膠進行SDS-PAGE電泳,將凝膠浸泡于考馬斯亮藍R250染色2 h,脫色液脫色至背景清晰為止。照相,確定融合蛋白的表達情況。
1.2.5 重組pTAT-XIAP融合蛋白鑒定 各取20 μl蛋白樣品100℃加熱10 min,行12%SDS-PAGE,電泳結(jié)束后電轉(zhuǎn)移到硝酸纖維素膜上進行Western blot分析:5%脫脂奶粉封閉1 h,加入小鼠抗6×His單克隆抗體作用3 h,TBS洗滌3×10 min,再用HRP標記的山羊抗小鼠IgG抗體孵育1 h,洗膜后用ECL發(fā)光試劑顯色,X線曝光顯影。
2 結(jié)果
2.1 載體瓊脂糖凝膠電泳結(jié)果 pTAT-XIAP質(zhì)粒約4 500 bp,pTAT-HA質(zhì)粒約3 000 bp,條帶大小與質(zhì)粒圖譜一致。pTAT-XIAP經(jīng) NcoI/XhoI酶切鑒定,在Marker 3 000 bp可見載體pTAT-HA的條帶,在Marker1 500 bp可見XIAP的條帶,與預(yù)期結(jié)果相符。
2.2 融合蛋白表達形式鑒定 SDS-PAGE顯示pTAT-XIAP在約64 kD有一明顯的蛋白條帶出現(xiàn),與理論值相符。pTAT-XIAP主要以包涵體的形式存在,進一步優(yōu)化誘導(dǎo)條件,經(jīng)調(diào)整誘導(dǎo)溫度及IPTG濃度、誘導(dǎo)時間等,pTAT-XIAP仍主要以包涵體的形式存在。見圖1。
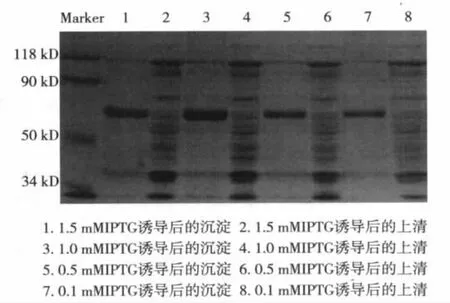
圖1 不同濃度IPTG 37℃誘導(dǎo)4 h的SOS-PAGE分析
2.3 重組pTAT-XIAP融合蛋白鑒定 取誘導(dǎo)后上清和沉淀、未誘導(dǎo)菌體及空載體蛋白進行 SDSPAGE,然后電轉(zhuǎn)移到NC膜上,用小鼠抗6×His單克隆抗體作為一抗,HRP標記的山羊抗小鼠IgG作為二抗,顯影后于約64 kD處可見一清晰條帶,與預(yù)期結(jié)果相符。
3 討論
影響E.coil蛋白表達量的因素除載體啟動子結(jié)構(gòu)外,表達菌對密碼子的偏好性、表達產(chǎn)物對宿主菌毒性作用而引起質(zhì)粒的不穩(wěn)定等均是導(dǎo)致原核表達失敗的原因[7,8]。本研究質(zhì)粒構(gòu)建及轉(zhuǎn)化菌的選擇時已排除以上因素的影響,目的融合蛋白主要以包涵體的形式存在。
人類Ⅰ型免疫缺陷病毒(HIV-1)的轉(zhuǎn)錄反式激活因子(Tat)能夠主動穿過細胞膜進入細胞內(nèi)部。研究表明,TAT蛋白轉(zhuǎn)導(dǎo)域能夠?qū)⑴c之共價連接的生物大分子(如核酸、多肽、蛋白質(zhì)等)非特異地轉(zhuǎn)導(dǎo)入細胞內(nèi)部,這種過程既不依賴于受體和轉(zhuǎn)運蛋白,也與溫度和能量無關(guān)[9],且對宿主細胞幾乎沒有毒性,顯示出巨大的應(yīng)用價值。TAT蛋白轉(zhuǎn)導(dǎo)域具有以下優(yōu)點:①操作簡單,轉(zhuǎn)導(dǎo)效率高。②轉(zhuǎn)導(dǎo)的蛋白質(zhì)在細胞中均具有生物活性,并能夠穿過血腦屏障,因此對心腦血管疾病的治療具有重要意義[10]。③作用迅速,可進入所有細胞,對細胞的損害相對較小。TAT蛋白轉(zhuǎn)導(dǎo)域目前已成功將相對分子質(zhì)量在15~120 kD的不同蛋白導(dǎo)入細胞,且均具有生物活性,并能夠穿過血腦屏障[11]。另有研究顯示XIAP具有強大的抗凋亡作用,有望用于治療神經(jīng)退行性疾病、腦缺血等神經(jīng)系統(tǒng)疾病。
本研究構(gòu)建了pTAT-XIAP原核表達載體并成功表達出目的融合蛋白,為研究該蛋白的體內(nèi)生物活性奠定了基礎(chǔ);pTAT-XIAP原核表達載體有望為治療神經(jīng)退行性疾病開辟新途徑。
[1]Holcik M,Korneluk RG.XIAP,the guardian angel[J].Nat Rev Mol Cell Bio,2001,2(7):550-556.
[2]Devereaux QL,Takahashi R,Salvesen GS,et al.X-linked IAP is a direct inhibitor of cell-death proteases[J].Nature,1997,388 (6639):300-304.
[3]蔣常文,夏春波,徐雅娟,等.pTAT-XIAP融合蛋白表達載體的構(gòu)建[J].醫(yī)學研究雜志,2009,38(4):65-66.
[4]Kerkis A,Hayashi MA,Yamane T,et al.Properties of cell penetrating peptides(CPPs)[J].IUBMB Life,2006,58(1):7-13.
[5]Mae,Langel U.Cell-penetrating peptides as vector for peptide,protein and oilgonucleotide delivery[J].Curr Opin Phamacol,2006,6 (5):509-514.
[6]Kilic U,Kilic E,Dietz G,et al.Intravenous TAT-GDNF Is Protective After Focal Cerebral Ischemia in Mice[J].Stroke,2003,34 (5):1304-1310.
[7]樊永鋒,呂傳真,趙延欣,等.融合蛋白PTD-XIAP的原核表達、純化及其血腦屏障穿透功能的初步鑒定[J].中國臨床神經(jīng)科學,2003,11(4):397-399.
[8]Boon P,Vandekerckhove T,Achten E,et al.Epilepsy surgery in Belgium,the experience in Gent[J].Acta Neurol Belg,1999,99(4): 256-265.
[9]王海珍,許予明,陳奎生,等.反式激活蛋白轉(zhuǎn)導(dǎo)結(jié)構(gòu)域介導(dǎo)綠色熒光蛋白在小鼠體內(nèi)的跨膜轉(zhuǎn)運[J].中國現(xiàn)代醫(yī)學雜志,2007,17(10):1161-1163.
[10]Dietz GP,Bahr M.Delivery of bioactive molecules into the cell: the Trojan horse approach[J].Mol Cell Neurosci,2004,27(2): 85-131.
[11]秦成峰,秦鄂德.TAT蛋白轉(zhuǎn)導(dǎo)域:蛋白質(zhì)治療的新曙光[J].中國生物化學與分子生物學報,2007,23(7):519-524.

