液相色譜-串聯質譜檢測獸藥殘留中的基質效應研究進展
王立琦,賀利民,曾振靈,陳建新
(華南農業大學獸醫學院,獸醫藥理研究室,廣東 廣州 510642)
液相色譜-串聯質譜(high-performance liquid chromatography tandem mass spectrometry,LC-MS/MS)技術是通過接口裝置將分離性能優異的液相色譜法與靈敏、專屬、能提供分子質量和結構信息的質譜法相結合的現代分離分析技術。單級的液相色譜-質譜聯用(LC/MS)技術始于20世紀70年代,隨著大氣壓電離(atmospheric pressure ionization,API)技術的成功應用以及現代質譜技術的發展,20世紀90年代,LC/MS迅速取代HPLC成為藥物分析的主要手段,特別是進入21世紀以來,LC-MS/MS技術得到了極大的重視和發展,在藥物分析[1-4]、食品安全檢測[5-10]、環境分析[11-16]及生命科學[17-18]等許多領域得到了廣泛應用。然而,隨著LC-MS/MS應用的不斷深入和成熟,人們欣賞該技術在分析檢測一般基質試樣中化合物所擁有的高抗基質干擾能力、高分析速度、高檢測通量、高選擇性、高靈敏度及化學結構定性的同時,也逐漸認識到該技術的一些不足[19]。LC-MS/MS分析中雖然非目標分析物可以不被監測(因檢測基于目標物母離子與其相應特征子離子的匹配),但樣品中的共流出物(非目標分析物)并非不存在,它們對目標分析物的離子化有很大影響。實驗也已證明,復雜樣品共提取基質成分和試樣前處理引入的外來雜質會嚴重抑制或增強目標分析物在噴霧接口處的離子化,從而影響到檢測的選擇性和靈敏度,進而影響到分析結果的準確度和精密度。這一現象,即所謂的基質效應(matrix effect,ME),已引起有關研究人員的重視,并正成為該領域研究的熱點。
液相色譜-質譜分析中的基質效應可追溯到20世紀90年代初,當改變樣品基質的種類和濃度時,待測物電噴霧離子化(electrospray ionization,ESI)質譜的響應值降低了[20]。2001年,美國食品藥品管理局(Food and Drug Administration,FDA)在《生物分析方法驗證準則》中明確要求:在液相色譜-質譜分析方法開發和驗證過程中需要對基質效應進行評價[21]。
因不同離子源、不同質譜分析器的基質效應情況不同,液相色譜-電噴霧串聯質譜儀在藥物殘留定性定量分析檢測中應用最廣;而從目前文獻報道來看,復雜生物樣品中藥物分析檢測的基質效應研究最多、最深。因此,本工作主要綜述LC-ESI-MS/MS分析測定生物樣品中基質效應的來源、產生的可能機制、影響因素及評價方法的基礎上,總結近年國內外有關 LC-ESI-MS/MS檢測動物性食品中獸藥殘留的基質效應消除和/或補償方法或措施,為深入研究可食性動物組織中獸藥和有害物殘留測定中的基質效應提供參考。
1 引起基質效應的物質來源
在LC-ESI-MS(/MS)分析中,常常發現樣品基質對目標化合物測定值有很大影響,一般認為這是由于色譜分離過程中與目標化合物共流出的物質對目標化合物離子化過程的影響[22]。共流出干擾物可分為內源性雜質和外源性雜質。內源性雜質是指樣品經前處理過程后依然保留在待分析樣品溶液中的各種有機物(脂類、色素、糖類、可溶性蛋白或肽類、胺類及目標化合物的同系物及其代謝物等)或無機物(各種無機鹽),當這些物質與目標化合物共流出色譜柱進入電離源時,將嚴重影響目標化合物的離子化過程。Little等[23]認為血漿試樣中磷脂是最主要的內源性雜質,其對ESI和大氣壓化學電離(atmospheric pressure chemical ionization,APCI)模式都產生明顯的離子抑制作用。外源性雜質由樣品前處理各步驟引入,主要包括無機離子、緩沖溶液、有機酸、離子對試劑、增塑劑、表面活性劑殘留、固相萃取(solid-phase extraction,SPE)小柱材料及色譜柱固定相流失物等。
2 基質效應的重要性
早在液相色譜-質譜分析技術發展的初期,就有學者開始關注由生物基質引起的目標分析物質譜響應與濃度之間的非線性問題[24]。基質效應是由于樣品中非待測物的存在,使待測物在儀器中的響應受到影響,或增強或減弱,進而影響待測物的檢出限(limit of detection,LOD)、定量限(limit of quantification,LOQ)、線性、準確度和精密度等[25]。
Taylor指出分析生物樣品時LC-ESI-MS/MS法普遍存在基質效應,若分析方法未對基質效應進行評價,所得的實驗結果不可靠[22]。Annesley[26]系統考察了 ESI-MS分析血漿樣品中的離子抑制現象,并提出了消除基質效應的多種方法,充分強調基質效應的重要性。Rogatsky等[27]建議在 LC-MS/MS分析方法建立時必須評價基質效應的強度,并提出“抑制系數”和“增強因子”作為LC-MS/MS分析方法的兩個質控參數。由此可見,基質效應是LC-MS/MS分析中非常嚴重的問題,應該引起相關學者的重視。
3 基質效應產生的可能機制
一般認為LC-ESI-MS/MS測定中目標物的電離是這樣實現的:從色譜柱流出的目標物經過帶有高電壓的毛細管出口尖端時,噴霧產生帶電液滴,在加熱霧化氣的作用下,帶電液滴溶劑不斷蒸發而收縮,液滴表面電荷密度越來越大,當達到瑞利(Rayleigh)極限時會發生庫侖爆炸,帶電液滴分裂成更小的液滴,在質量和電荷重新分配后,更小的液滴進入穩定態,然后再重復蒸發、電荷過剩和液滴分裂系列過程。當帶電液滴半徑小于10nm時,液滴表面形成的電場足夠強,電荷的排斥作用導致部分離子從液滴表面逃逸出來,而不再是液滴的分裂,最終目標物以單電荷或多電荷離子的形式從溶液中轉移至氣相,形成氣相離子,在電場作用下目標物的氣相離子進入質量分析器[28]。由此可見,噴霧液滴中的基質組分和儀器的色譜、質譜條件等各種因素都會對這一過程中目標物的電離和轉化效率產生影響,進而影響到目標物的定性和定量。
雖然產生這種影響的機制目前尚不十分清楚,但通常認為共提取基質成分與待測目標物在色譜柱出口電離競爭是引起基質效應的主要機理[22,29]。隨同目標物從色譜柱上一起被洗脫出來的共提取基質成分(共流出物),會同目標物離子競相競爭液滴表面,從而導致目標物的離子化效率降低或增強,引起響應降低或增高,便產生了所謂的基質抑制或基質增強效應。King等[30]實驗證明:血漿提取液在電噴霧電離過程中,帶電液滴中的難揮發性溶質是產生離子抑制的主要原因,它們阻止小帶電液滴的形成,使其較難達到離子發射所需的半徑和表面電荷,從而減少了目標物氣相離子的形成,而氣相中離子的中和反應和凈電荷的損失不是主要因素。
4 基質效應的評價方法
LC-MS/MS分析中用以評價基質效應的方法主要有柱 后 注 射 法 (post-column infusion method)與提取后添加法(post-extraction spiking method)。其中,柱后注射法能直觀的顯示基質效應產生的時間和影響程度,適合在色譜方法篩選過程中評估基質效應的影響情況,為色譜條件的優化提供信息;而提取后加入法能量化基質效應,廣泛運用于方法學驗證過程。
4.1 柱后注射法
柱后注射法可以對基質效應進行動態分析,測定過程示于圖1。經液相色譜柱分離的空白基質提取液與通過注射泵恒速注射的克倫特羅純溶劑標準溶液在三通接口處混合,經過帶有高電壓的毛細管出口時噴霧電離,明顯可見有2個時間段的克倫特羅信號強度受到抑制。柱后注射法由Bonfiglio等[31]首次提出,此法可以定性評價基質效應,且有助于確定基質效應產生的時間,對消除或補償基質效應起指導作用。若待測物的保留時間在基質效應產生時間范圍內,可以通過調整色譜分離條件,使待測物避開基質效應產生的時間出峰,即可減少基質對檢測的影響。作為一門有效的基質效應評價工具,柱后注射法被許多學者用于方法驗證中基質效應的考察[26,30-35]。使用該方法需要注意的是,通過注射泵恒速注射的待測物濃度應該在分析范圍內,若濃度過高以致超過儀器線性范圍時,可造成檢測結果不可靠。
4.2 提取后添加法
提取后添加法是將空白樣品按前處理方法進行提取凈化后,在提取液中添加待測物,再按已定的色譜、質譜條件進行檢測,與同樣濃度的純溶劑或流動相中待測物的離子強度進行比較,觀察基質效應,測定過程示于圖2(質量色譜圖為待測物萊克多巴胺)。Matuszewski等[19]首次提出這種可以對基質效應的強度進行定量的評價方法,分別測定提取后添加待測物與流動相中添加同樣濃度待測物的離子響應強度,計算它們的相對比值來評價基質效應情況。若比值小于1.0,說明基質對待測物的響應產生抑制作用;若大于1.0,說明基質的存在增強了待測物的響應;若等于1.0,說明待測物的響應未受影響,這是最為理想的一種情況,也是建立檢測方法時所追求的最高目標。但在實際中,很難得到這樣的結果,一般相對比值在0.85~1.15之間則認為基質效應不明顯。
5 基質效應的影響因素
從目前的研究分析,基質效應的產生及強度大小主要與待測物本身的極性及濃度、選用的樣品前處理方法、樣品基質來源及成分、色譜分析條件與離子源結構等多種因素有關[36]。

圖1 柱后注射法測定過程示意圖Fig.1 Diagram of the post-column infusion system
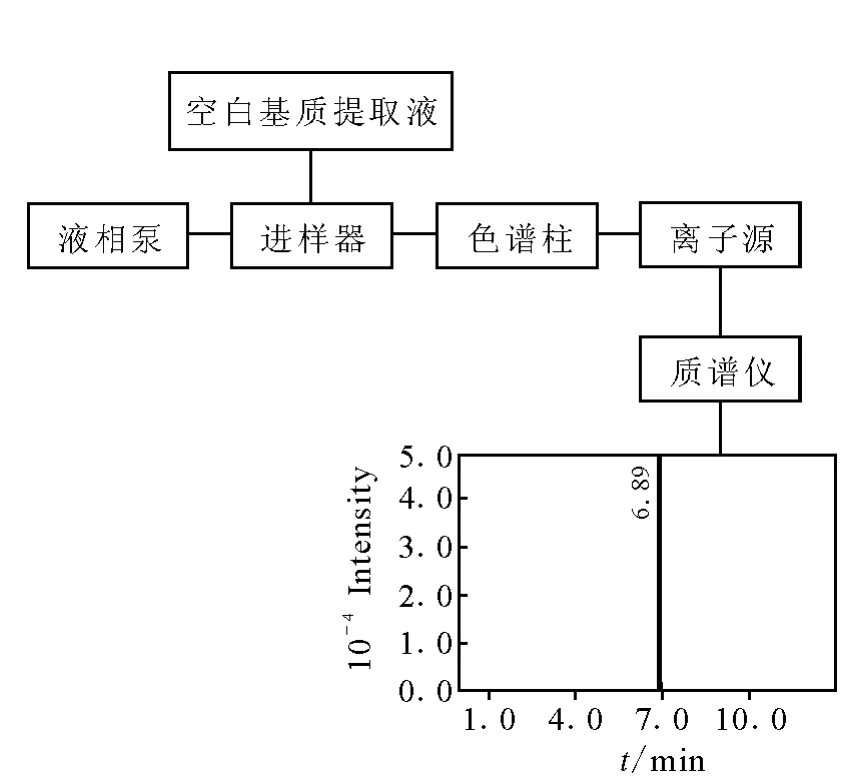
圖2 提取后添加法測定過程示意圖Fig.2 Diagram of post-extraction addition
5.1 待測物的極性及濃度
Bonfiglio等[31]采用反相色譜柱對3種極性不同的藥物進行LC-ESI-MS/MS分析,結果表明基質效應與藥物的化學性質有關:藥物極性越大,離子響應強度受抑制越嚴重。這種現象的發現對選擇非同位素內標具有指導意義。若選定的內標與待測物極性相差較大,色譜分離保留時間差異大,基質效應對它們的影響會不同,導致二者信號強度的變化不一致,因而無法起到校正作用,有時還適得其反。本文作者在采用LC-ESI-MS/MS分析蛋白同化類激素時,發現用氘代睪酮內標計算諾龍、勃地龍、康力龍等激素時,回收率有的竟達到200%,而采用基質匹配標準溶液校正可獲得滿意的結果[37]。因此,在同時檢測多種極性不同的待測物時,力求選擇多種相應待測物的同位素內標進行校正或采用基質匹配標準溶液校正,否則得出的結果不可靠[38]。
通常基質中待測物濃度不同,受到的基質效應影響也不同。Van Hout等[39]考察了不同濃度水平的克倫特羅在豬尿中的響應情況,發現隨著豬尿中克倫特羅濃度的增加,基質效應會相對減弱。
5.2 樣品前處理方法
基質效應的產生主要依賴于樣品基質,因此,上機溶液中基質成分的含量是影響基質效應的重要因素之一。樣品前處理方法的選擇直接影響基質效應的強度,提取凈化好的方法,基質成分含量少,基質效應會減小,否則,會放大基質效應。上樣前對樣品進行濃縮或增加進樣體積,都會使基質效應加強。藥物殘留分析檢測中,傳統的樣品提取凈化方法主要可分為組織搗碎法、振蕩提取法、液-液萃取法(liquid-liquid extraction,LLE)、超聲提取法、索氏抽提法及蛋白質沉淀法(protein precipitation,PPT)。通常振蕩提取法、索氏抽提法和LLE法的基質效應相對較弱,而組織搗碎法、超聲提取法和PPT法的基質效應相對較強。有學者詳細研究了生物樣品不同的前處理方法對基質效應的影響,發現LLE法引起的基質效應最小,PPT法則最明顯,其共提取的內源性物質會在較大程度上影響樣品的檢測[29,31]。現代固相萃取技術不僅能對傳統提取方法的產物進一步凈化,而且本身集提取、凈化與富集于一體,在樣品前處理過程中越來越受到青睞。根據目標分析物在SPE小柱上的保留機制不同,可將SPE柱分為反相、正相和離子交換等模式,實際應用中應根據測定基質和待測物的理化性質進行選擇[40]。近年迅速發展的分子印跡固相萃取(molecularly imprinting solid-phase extraction,MISPE)柱具有高度的選擇性和良好的適應性,不斷應用于環境分析、藥物分析、食品安全檢測等領域的樣品前處理,可有效消除基質效應[41]。Zorita等[42]采用 MISPE柱對廢水中的酸性藥物進行提取凈化,結果發現,與自來水相比,池水與污水均未出現明顯的基質效應。
5.3 樣品來源及基質成分
通常情況下,研究者們在建立檢測方法時,往往忽略了不同來源的樣品對方法適應性和可靠性的考察,但實際檢測的樣品來自于不同個體、不同地方,個體間及地區間樣品的差異會引起不同的基質效應。Matuszewski等[19]指出考察基質效應時,應對不同來源、不同批次的樣品進行分析測定評價。Ismaiel等[43]研究也證明,僅僅用同源基質不足以評價方法的可靠性。因此,在考察一種方法是否準確可靠時,需要對不同來源的樣品進行分析測定,若其結果的變異系數在15%以上,則需要對方法進行改進[22]。筆者采用LC-ESI-MS/MS分析豬肌肉中9種β-興奮劑類殘留時,分別對采自8個地區的樣品進行基質效應比較,發現地區間樣品基質效應存在一定差異。
不同的樣品基質,如肌肉、肝臟、尿液等的組成不盡相同,因此也會對基質效應產生影響[44]。Dams等[33]指出:基質效應的存在還取決于分析的生物液體種類。不同生物液體的特征基質成分不同,會在不同時間產生干擾。如尿液中的主要干擾物質是親水性成分(無機鹽、尿酸等);而唾液中可能同時含有親水性與親脂性成分(蛋白質、氨基酸、粘液素等),因此其對分析物的干擾比尿液更顯著。
前述基質效應物(內源性物質和外源性雜質)是LC-ESI-MS/MS分析中引起基質效應的物質基礎,必須設法去除或通過色譜分離條件改變來避開。Shen等[45]研究發現,采用強離子交換(SCX)小柱可有效去除磷脂從而減小基質效應,若待測物可通過離子交換機制得到保留,建議不要選擇混合模式的SPE小柱(如MCX)凈化,因為其反相保留機制不利于消除由磷脂引起的離子信號抑制現象。Little等[23]建立了源內多反應監測(in-source multiple reaction monitoring)法,以監測基質中甘油磷脂酰膽堿的濃度,以量化其產生的基質效應。Ismaiel等[35,46]在研究LC-ESI-MS/MS分析人血漿中二氫可待因、偽麻黃堿及撲爾敏的基質效應時,采用監測甘油磷脂酰膽堿的特征離子來評價基質效應,發現基質效應出現的時間與甘油磷脂酰膽堿的保留時間一致。
5.4 色譜分析條件
若待測物在基質效應嚴重的時間段內被洗脫,則會對實驗結果產生較大影響。在常采用的反相色譜分離過程中,基質效應主要產生于分析的前段時間,因此,實際檢測時應通過調整色譜條件使待測物盡量延后出來,以與快速流出的強極性基質成分分開。但在高通量分析時,由于分析時間很短,基質會對出峰較早的待測物產生干擾,因此高通量分析極性大的待測物時,應該審慎評定測定結果[34]。若采用梯度洗脫或延長色譜分離時間,可在一定程度上解決這個問題。流動相的組成及流速、進樣體積也可影響基質效應。通常說來,流速越小、進樣量越小,引起的基質效應越小。筆者在采用LC-ESI-MS/MS分析豬肌肉中β-興奮劑類殘留時,比較了不同進樣量(10μL和20μL)基質效應的差別,結果發現進樣量越大,基質效應越明顯。此外,前一個樣品待測物或基質成分在色譜柱中的殘留、聚集均有可能導致基質效應[38,47]。
5.5 離子源
在藥物殘留分析中,采用API技術的LC-MS/MS應用最為廣泛。Matuszewski等[19]采用提取后添加法對LC-MS/MS分析中的基質效應進行了定量評價,實驗結果表明,采用APCI源時,未觀察到基質效應,而采用ESI源時則出現嚴重的基質效應。Souverain等[29]采用傳統的PPT、LLE、SPE及在線SPE前處理方法對ESI源與APCI源的基質效應進行研究,實驗發現無論用何種前處理方法,ESI源均比APCI源的基質效應更明顯。Dams等[33]采用LC-MS/MS分析生物樣品中非法藥物嗎啡時發現,APCI源與ESI源均存在基質效應,但是APCI源不如ESI源明顯。
6 消除或補償基質效應的方法
基質效應在化學分析中客觀存在,不可能被完全消除。在生物樣品分析中通常采用內標法、空白基質標準添加法及優化色譜-質譜分析條件對可能的基質效應進行消除和(或)補償。動物組織中獸藥殘留檢測中的基質效應研究較少、較淺,但事實上也存在較強的基質效應,特別是采用LC-ESI-MS/MS進行多殘留快速篩查時(因認為其具有高選擇性而簡化了前處理程序)。近年來,致力于消除和補償基質效應的研究逐漸增多,表1中概括了LC-ESI-MS/MS分析動物性食品中獸藥殘留時應對基質效應所采取的方法和對典型獸藥產生基質效應的評價。
6.1 同位素內標法
同位素與待測組分在樣品制備、色譜分離及質譜檢測的全過程中具有相似的行為,受基質效應的影響也一致,因此,同位素內標法被認為是補償基質效應最理想的方法[48-50]。但因同位素內標價格昂貴,且不易得到,使其應用受到限制,一般在嚴格的分析測定中使用較多。用待測物的同系物代替同位素,有時可有效補償基質效應,但正式檢測前應進行方法效能指標考察,否則,有可能適得其反。
6.2 空白基質匹配標準校正法
空白基質匹配標準校正法是將空白樣品經過前處理后,加入系列濃度待測物標準作為基質匹配標準溶液,用以對檢測結果進行校正。Hernndez等[51]指出,處理生物樣品時不采用空白基質匹配標準溶液法,而應采用空白基質標準添加法來補償基質效應。Hernando等[13]在建立食品中阿弗麥菌素殘留的LC-MS/MS方法時,采用空白基質匹配標準溶液方法有效補償了基質效應。武志雄等[52]研究LC-MS/MS法測定豬肉組織中的阿維菌素、伊維菌素殘留,采用空白樣品提取液配制標準以補償基質效應。張麗芳等[53]在建立LC-MS/MS法測定肉腸中萊克多巴胺殘留量的過程中,通過基質加標法考察了基質對萊克多巴胺響應值的抑制現象。楊雯筌等[54]利用 LC-MS/MS法對禽類產品中的克球酚殘留進行分析,采用基質匹配標準溶液校準法對其進行定量。王全林等[55]在建立純牛奶、嬰兒配方奶粉中苯甲酸雌二醇殘留檢測的UPLC-MS/MS分析方法時,用基質匹配標準校正方法補償基質效應。
6.3 優化凈化方法及色譜分離條件
Bogialli等[56]研究指出,多層凈化可以有效消除基質干擾物對待測物的影響。需要注意的是,并不是凈化效果越好,對分析待測物就越有利。因為在通過優化提取凈化方法來減少基質成分的同時,待測物也會受到損失,使其回收率受到影響(但同位素內標法一般沒有關系),因此,需要對樣品凈化程度和回收率進行綜合衡量。而通過調整流動相的組成及流速、色譜分離的時間及上樣量等亦可有效減小基質效應。

表1 LC-MS/MS分析獸藥殘留中的基質效應評價Table 1 Evaluation of matrix effect in analysis of residues of veterinary drugs with LC-MS/MS

續表

續表
7 展望
基質效應對待測物的定性與定量準確性有影響,建立分析方法時需對其進行考察以保證方法的可靠性。動物性食品中獸藥殘留檢測中的基質效應問題已引起越來越多學者的重視。盡管基質效應產生的原因復雜、來源廣泛、影響因素較多,研究者在探索基質效應產生機制的同時,應該投入更多的時間和精力研究消除和(或)補償基質效應的可行方法和有效措施,研制通用性基質和構建基質效應估算的數學模型是一個新思路。
[1]LEE M S,KERNS E H.LC/MS applications in drug development[J].Mass Spectrom Reviews,1999,18:187-279.
[2]SRINIVAS N R.Applicability of bioanalysis of multiple analytes in drug discovery and development:Review of select case studies including assay development considerations[J].Biomed Chromatogr,2006,20:383-414.
[3]劉福艷,劉福強,謝元超,等.液質聯用技術在藥物分析中的應用研究進展[J].中國藥品標準,2008,9(6):443-446.
[4]JEMAL M,OUYANG Z,XIA Y Q.Systematic LC-MS/MS bioanalytical method development that incorporates plasma phospholipids risk avoidance,usage of incurred sample and well thought-out chromatography[J].Biomed Chromatogr,2010,24(1):2-19.
[5]HERNANDO M D,SUREZ BARCENA J M,BUENO M J,et al.Fast separation liquid chromatography tandem mass spectrometry for the confirmation and quantitative analysis of avermect in residues in food[J].J Chromatogr A,2007,1 155(1):62-73.
[6]CRNOGORAC G,SCHMAUDER S,SCHWACK W.Trace analysis of dithiocarbamate fungicide residues on fruits and vegetables by hydrophilic interaction liquid chromatography/tandem mass spectrometry[J].Rapid Commun Mass Spectrom,2008,22(16):2 539-2 546.
[7]王鳳池.液質聯用技術在食品安全檢測中的的應用研究[D].河北:河北大學,2008.
[8]MALIK A K,BLASCO C,PICO Y.Liquid chromatography-mass spectrometry in food safety[J].J Chromatogr A,2010,1 217(25):4 018-4 040.
[9]REBANE R,LEITO I,YURCHENKO S,et al.A review of analytical techniques for determination of Sudan I-IV dyes in food matrixes[J].J Chromatogr A,2010,1 217(17):2 747-2 757.
[10]GOTO T.Development of analytical methods for residual N-methyl carbamate pesticides in foods[J].J Pharm Soc Japan,2010,130(8):999-1 010.
[11]PEREZ C E,HANSEN M,LEON V M,et al.Multiresidue method for the determination of 32 human and veterinary pharmaceuticals in soil and sediment by pressurized-liquid extraction and LCMS/MS[J].Anal Bioanal Chem,2010,398(3):1 173-1 184.
[12]BABIC S,PAVLOVIC D M,APERGER D,et al.Determination of multi-class pharmaceuticals in wastewater by liquid chromatography-tandem mass spectrometry (LC-MS-MS)[J].Anal Bioanal Chem,2010,398(3):1 185-1 194.
[13]FANG G Z,WANG X N,WANG S.Multiwalled carbon nanotubes as SPE adsorbents for simultaneous determination of seven sulfonylurea herbicides in environmental water by LC-MS-MS[J].Chromatogr,2010,72(5/6):403-409.
[14]PIEPER C,RISSE D,SCHMIDT B,et al.In-vestigation of the microbial degradation of phenazone-type drugs and their metabolites by natural biofilms derived from river water using liquid chromatography/tandem mass spectrometry (LC-MS/MS)[J].Water Res,2010,44(15):4 559-4 569.
[15]GINEYS N,GIROUD B,VULLIET E.Analytical method for the determination of trace levels of steroid hormones and corticosteroids in soil,based on PLE/SPE/LC-MS/MS[J].Anal Bioanal Chemistry,2010,397(6):2 295-2 302.
[16]WILLE K,NOPPE H,VERHEYDEN K,et al.Validation and application of an LC-MS/MS method for the simultaneous quantification of 13 pharmaceuticals in seawater[J].Anal Bioanal Chem,2010,397(5):1 797-1 808.
[17]DAKNA M,HE Z Y,YU W C,et al.Technical,bioinformatical and statistical aspects of liquid chromatography-mass spectrometry(LC-MS)and capillary electrophoresis-mass spectrometry(CE-MS)based clinical proteomics:A critical assessment[J].J Chromatogr B,2009,877(13):1 250-1 258.
[18]LIN L C,WU H Y,TSENG V S M,et al.A statistical procedure to selectively detect metabolite signals in LC-MS data based on using variable isotope ratios[J].J Am Soc Mass Spectrom,2010,21(2):232-241.
[19]MATUSZEWSKI B K,CONSTANZER M L,CHAVEZ-ENG C M.Strategies for the assessment of matrix effect in quantitative bioanalytical methods based on HPLC-MS/MS[J]. Anal Chem,2003,75:3 019-3 030.
[20]FENN J B,MANN M,MENG C K,et al.Electrospray ionization-principles and practice[J].Mass Spectrom Reviews,1990,9:37-70.
[21]Anon.Guidance for industry.Bioanalytical method validation[EB/OL].http://www.fda.gov/cder/guidance/guidance.htm. Accessed May 28,2001.
[22]TAYLOR P J.Matrix effects:The achilles heel of quantitative high-performance liquid chromatography electrospray-tandem mass spectrometry[J].Clin Biochem,2005,38:328-334.
[23]LITTLE J L,WEMPE M F,BUCHANAN C M.Liquid chromatography-mass spectrometry/mass spectrometry method development for drug metabolism studies:Examining lipid matrix ioni-zation effects in plasma[J].J Chromatogr B,2006,833:219-230.
[24]BROWN F R,DRAPER W M.The matrix effect in particle beam liquid chromatography/mass spectrometry and reliable quantification by isotope dilution[J].Biol Mass Spectrom,1991,20(9):515-521.
[25]向 平,沈 敏,卓先義.液相色譜-質譜分析中的基質效應[J].分析測試學報,2009,2(86):753-756.
[26]ANNESLEY T M.Ion suppression in mass spectrometry[J].Clin Chem,2003,49(7):1 041-1 044.
[27]ROGATSKY E,STEIN D.Evaluation of matrix effect and chromatography efficiency:New parameters for validation of method development[J].J Am Soc Mass Spectrom,2005,16:1 757-1 759.
[28]陳耀祖,涂亞平.有機質譜原理及應用[M].北京:科學出版社,2001:18.
[29]SOUVERAIN S,RUDAZ S,VEUTHEY J L.Matrix effect in LC-ESI-MS and LC-APCI-MS with off-line and on-line extraction procedures[J].J Chromatogr A,2004,1 058:61-66.
[30]KING R,BONFIGLIO R,FERNANDEZ-METZLER C,et al.Mechanistic investigation of ionization suppression in electrosprayionization[J].J Am Soc Mass Spectrom,2000,11:942-950.
[31]BONFIGLIO R,KING R C,OLAH T V,et al.The effects of sample preparation methods on the variability of the electrospray ionization response for model drug compounds[J].Rapid Commun Mass Spectrom,1999,13:1 175-1 185.
[32]SHOU W Z,NAIDONG W.Post-column infusion study of the‘dosing vehicle effect’in the liquid chromatography/tandem mass spectrometric analysis of discovery pharmacokinetic samples[J].Rapid Commun Mass Spectrom,2003,17:589-597.
[33]DAMS R,HUESTIS M A,LAMBERT W E,et al.Matrix effect in bio-analysis of illicit drugs with LC-MS/MS:Influence of ionization type,sample preparation,and biofluid[J].J Am Soc Mass Spectrom,2003,14:1 290-1 294.
[34]MULLER C,SCHAFER P,STORTZEL M,et al.Ion suppression effects in liquid chromatographyelectrospray ionisation transport-region collision induced dissociation mass spectrometry with dif-ferent serum extraction methods for systematic toxicological analysis with mass spectra libraries[J].J Chromatogr B,2002,773:47-52.
[35]POLSON C,SARKAR P,INCLEDON B,et al.Optimization of protein precipitation based upon effectiveness of protein removal and ionization effect in liquid chromatography-tandem mass spectrometry[J].J Chromatogr B,2003,785:263-275.
[36]FABIO G,ELEONORA M,DAVIDE Z,et al.Signal suppression/enhancement in high-performance liquid chromatography tandem mass spectrometry[J].J Chromatogr A,2010,1 217:3 929-3 937.
[37]動物源食品中11種激素多殘留的測定 液相色譜-串聯質譜法[S],農業部公告1031-1-2008.
[38]LAGERWERF F M,VAN DONGEN W D,STEENVOORDEN R J J M,et al.Exploring the boundaries of bioanalytical quantitative LC-MSMS[J].Trends Anal Chem,2000,19:418-427.
[39]VAN HOUT M W J,NIEDERLANDER H A G,DE ZEEUW R A,et al.Ion suppression in the determination of clenbuterol in urine by solidphase extraction atmospheric pressure chemical ionisation ion-trap mass spectrometry[J].Rapid Commun Mass Spectrom,2003,17:245-250.
[40]POOLE C F.New trends in solid phase extraction[J].Trends in Anal Chem,2003,22(6):362-373.
[41]KOLE P L,VENKATESH G,KOTECHA J,et al.Recent advances in sample preparation techniques for effective bioanalytical methods[J].Biomed Chromatogr,2011,25:199-217.
[42]ZORITA S,BOYD B,J?NSSON S,et al.Selective determination of acidic pharmaceuticals in wastewater using molecularly imprinted solidphase extraction[J].Anal Chim Acta,2008,626:147-154.
[43]ISMAIEL O A,HALQUIST M S,ELMAMLY M Y,et al.Monitoring phospholipids for assessment of matrix effects in a liquid chromatographytandem mass spectrometry method for hydrocodone and pseudoephedrine in human plasma[J].J Chromatogr B,2008,875:333-343.
[44]謝家樹,葛慶華.LC/MS測定中生物樣品的基質效應問題[J].藥物分析雜志,2008,28(8):1 386-1 388.
[45]SHEN J X,MOTYKA R J,ROACH J P,et al.Minimization of ion suppression in LC-MS/MS analysis through the application of strong cation exchange solid-phase extraction (SCX-SPE)[J].J Pharm Biomed Anal,2005,37:359-367.
[46]ISMAIEL O A,HALQUISTB M S,ELMAMLY M Y,et al.Monitoring phospholipids for assessment of ion enhancement and ion suppression in ESI and APCI LC/MS/MS for chlorpheniramine in human plasma and the importance of multiple source matrix effect evaluations[J].J Chromatogr B,2007,59:84-93.
[47]PASCOE R,FOLEY J P,GUSEV A I,et al.Reduction in matrix-related signal suppression effects in electrospray ionization mass spectrometry using on-line two-dimensional liquid chromatography[J].Anal Chem,2001,73:6 014-6 023.
[48]MATUSZEWSKI B K.Standard line slopes as a measure of relative matrix effect in quantitative HPLC-MS bioanalysis[J].J Chromatogr B,2006,830:293-300.
[49]MARCHI I,VIETTE V,BADOUD F,et al.Characterization and classi?cation of matrix effects in biological samples analyses[J].J Chromatogr A,2010,1 217:4 071-4 078.
[50]O’HALLORAN S,ILETT K F.Evaluation of a deuterium-labeled internal standard for the measurement of sirolimus by high-throughput HPLC electrospray ionisation tandem mass spectrometry[J].Clin Chem,2008,54:1 386-1 389.
[51]HERNNDEZ F,SANCHO J V,POZO O J.Critical review of the application of liquid chromatography/mass spectrometry to the determin at ion of pesticide residues in biological samples[J].Anal Bioanal Chem,2005,382(4):934-946.
[52]武志雄,胡江濤,鄭衛東,等.豬肉組織中阿維菌素、伊維菌素殘留的高效液相色譜-串聯質譜法研究[J].四川大學學報:醫學版,2010,41(3):523-526.
[53]張麗芳,王霄旸,張 濤,等.液相色譜-串聯質譜法測定肉腸中萊克多巴胺殘留量的研究[J].食品科學,2009,30(8):197-200.
[54]楊雯筌,徐錦忠,楊功俊,等.液相色譜-電噴霧串聯質譜法測定禽類產品中克球酚的殘留[J].色譜,2009,l27(2):144-148.
[55]王全林,張愛芝,陳立仁.超高效液相色譜-串聯質譜法對奶制品中苯甲酸雌二醇殘留的測定[J].分析測試學報,2009,28(9):1 069-1 073.
[56]BOGIALLI S,CIAMPANELLA C,CURINI R,et al.Development and validation of a rapid assay based on liquid chromatography-tandem mass spectrometry for determining macrolide antibiotic residues in eggs[J].J Chromatogr A,2009,12(16):6 810-6 815.
[57]王 娟,李秀琴,張慶合,等.液相色譜-串聯質譜法檢測牛奶中10種β-興奮劑[J].食品安全質量檢測技術,2009,1(1):51-56.
[58]郭德華,鄧曉軍,趙善貞,等.固相萃取-高效液相色譜/串聯質譜同時檢測動物源性食品中76種獸藥殘留[J].分 析化學,2010,38(3):318-324.
[59]HOOF N V,COURTHEYN D.ANTIGNAC J,et al.Multi-residue liquid chromatography/tandem mass spectrometric analysis of beta-agonists in urine using molecular imprinted polymers[J].Rapid Commun Mass Spectrom,2005,19:2 801-2 808.
[60]JUAN C,IGUALADA C,MORAGUES F,et al.Development and validation of a liquid chromatography tandem mass spectrometry method for the analysis of beta-agonists in animal feed and drinking water[J].J Chromatogr A,2010,1 217:6 061-6 068.
[61]ZHU W X,YANG J Z,WEI W,et al.Simultaneous determination of 13aminoglycoside residues in foods of animal origin by liquid chromatography-electrospray ionization tandem mass spectrometry with two consecutive solid-phase extraction steps[J].J Chromatogr A,2008,1 207:29-37.
[62]GREMILOGIANNI A M,MEGOULAS N C,KOUPPARIS M A.Hydrophilic interaction vs ion pair liquid chromatography for the determination of streptomycin and dihydrostreptomycin residues in milk based on mass spectrometric detection[J].J Chromatogr A,2010,1 217:6 646-6 651.
[63]劉永濤,劉振紅,丁運敏,等.HPLC-MS/MS同時測定水產品中喹烯酮、喹乙醇和5種大環內酯類抗生素殘留[J].食品科學,2009,30(24):294-298.
[64]王鳳美,陳軍輝,林黎明,等.UPLC-MS/MS法對動物源性食品中12種大環內酯類抗生素殘留的測定 [J].分析測試學報,2009,28(7):784-788.
[65]HE L M,ZHAO D H,SU Y J,et al.Determi-nation of macrocyclic lactone drug residues in animal muscle by liquid chromatography/tandem mass spectrometry[J].J AOAC INT,2009,92(1):348-358.
[66]劉勇軍,吳銀良,姜艷彬,等.高效液相色譜-串聯質譜法測定豬肉中泰拉霉素殘留[J].分析化學,2009,37(10):1 489-1 493.
[67]倪姮佳,黃顯會,方炳虎,等.高效液相色譜-串聯質譜法測定豬組織中的土拉霉素[J].分析測試學報,2011,3:307-311.
[68]岳振峰,陳小霞,謝麗琪,等.高效液相色譜串聯質譜法測定動物組織中林可酰胺類和大環內酯類抗生素殘留[J].分析化學,2007,35(9):1 290-1 294.
[69]BOSCHER A,GUIGNARD C,PELLET T,et al.Development of a multi-class method for the quantification of veterinary drug residues in feedstuffs by liquid chromatography-tandem mass spectrometry[J].J Chromatogr A,2010,1 217:6 394-6 404.
[70]CHIAOCHAN C,KOESUKWIWAT U,YUDTHAVORASIT S,et al.Efficient hydrophilic interaction liquid chromatography-tandem mass spectrometry for the multiclass analysis of veterinary drugs in chicken muscle[J].Anal Chim Acta,2010,682:117-129.
[71]VIDAL J L M,LUIZ M D M A,GONZALEZ R R,et al.Multiclass analysis of antibiotic residues in honey by ultra-performance liquid chromatography tandem mass spectrometry[J].J Agric Food Chem,2009,57:1 760-1 767.
[72]CARRETERO V,BLASCO C,PICóY.Multiclass determination of antimicrobials in meat by pressurized liquid extraction and liquid chromatography-tandem mass spectrometry[J].J Chromatogr A,2008,1 209:162-173.
[73]趙東豪,賀利民,聶建榮.豬肉組織中阿維菌素類藥物殘留的高效液相色譜-串聯質譜法測定[J].分析測試學報,2008,27(8):862-865.
[74]TURNIPSEED S B,ANDERSEN W C,KARBIWNYK C M,et al.Multi-class,multi-residue liquid chromatograph tandem mass spectrometry screening and confirmative methods for drug residues in milk[J].Rapid Commun Mass Spectrom,2008,22:1 467-1 480.
[75]SMITH S,GIESEKER C,REIMSCHUESSEL R,et al.Simultaneous screening and confirmation of multiple classes of drug residues in fish by liquid chromatography-ion trap mass spectrometry[J].J Chromatogr A,2009,1 216:8 224-8 232.
[76]賀利民,黃顯會,方炳虎,等.超高效液相色譜-串聯質譜法測定動物肌肉組織和雞蛋中殘留的11種甾體激素類藥物[J].色譜,2008,26(6):714-719.
[77]SHERIDAN R,POLICASTRO B,THOMAS S,et al.Analysis and occurrence of 14sulfonamide antibacterials and chloramphenicol in honey by solid-phase extraction followed by LC/MS/MS analysis[J].J Agric Food Chem,2008,56:3 509-3 516.
[78]SZILAGYI S,DE LA CALLE B.Development and validation of an analytical method for the determination of semicarbazide in fresh egg and in egg powder based on the use of liquid chromatography tandem mass spectrometry[J].Anal Chim Acta,2006,572:113-120.
[79]MOTTIER P,PARISOD V,GREMAUD E.Determination of the antibiotic chloramphenicol in meat and seafood products by liquid chromatography-electrospray ionization tandem mass spectrometry[J].J Chromatogr A,2003,994(1/2):75-84.
[80]MITROWSKA K,POSYNIAK A,ZMUDZKI J.Multiresidue method for the determination of nitroimidazoles and their hydroxy-metabolites in poultry muscle,plasma and egg by isotope dilution liquid chromatography-mass spectrometry[J].Talanta,2010,81:1 273-1 280.

