尼莫地平對(duì)耳蝸缺血再灌注損傷的保護(hù)作用
夏樹(shù)前 龔樹(shù)生 李嬌 張富剛
內(nèi)耳動(dòng)脈似彈簧螺旋樣走行,血流經(jīng)過(guò)這種極端彎曲的血管后,一方面變得緩慢而平穩(wěn),另一方面,彈簧樣結(jié)構(gòu)是保持局部血流自我調(diào)節(jié)穩(wěn)定的生理結(jié)構(gòu)基礎(chǔ),再加上血管路徑較長(zhǎng),易發(fā)生血流淤滯和脂質(zhì)沉積,故易發(fā)生阻塞。疑為缺血引起的內(nèi)耳病變,經(jīng)顳骨解剖觀察,僅少數(shù)出現(xiàn)完全動(dòng)脈阻塞的病理變化,可能為一過(guò)性內(nèi)耳血流受阻后又部分或完全恢復(fù),即發(fā)生了缺血再灌注。組織器官缺血再灌注損傷中均發(fā)現(xiàn)有鈣離子內(nèi)流,細(xì)胞鈣超載,從而導(dǎo)致細(xì)胞凋亡,抑制鈣離子內(nèi)流以期抑制細(xì)胞凋亡是目前研究的熱點(diǎn)。尼莫地平作為鈣離子拮抗劑,在心腦等器官缺血再灌注損傷中具有良好的保護(hù)作用,本研究旨在探討尼莫地平對(duì)耳蝸缺血再灌注損傷的保護(hù)作用及可能機(jī)制。
1 材料與方法
1.1實(shí)驗(yàn)動(dòng)物與分組 選取42只豚鼠,雌雄不拘,隨機(jī)分為:實(shí)驗(yàn)組18只,尼莫地平干預(yù)組18只,對(duì)照組6只。實(shí)驗(yàn)組與干預(yù)組按ABR檢測(cè)時(shí)間及斷頭取聽(tīng)泡時(shí)間又分為再灌注1、2和6 h 3個(gè)時(shí)間點(diǎn),每一時(shí)間點(diǎn)6只豚鼠。對(duì)照組6只豚鼠不造模,作為空白對(duì)照。
1.2實(shí)驗(yàn)儀器及試劑 激光多普勒血流量?jī)x(Periflux System 5000,Perimed,瑞典),視窗版perisoft軟件分析數(shù)據(jù),ABR檢測(cè)儀(Bio-logic Systems 美國(guó))。FeCl3(三氯化鐵,天津化學(xué)試劑三廠),分析純,配成40%水溶液;尼莫地平(德國(guó)拜耳股份有限公司),用量為0.5 mg/kg。
1.3實(shí)驗(yàn)方法
1.3.1缺血再灌注模型的制備 實(shí)驗(yàn)組與干預(yù)組豚鼠腹腔注射6%水合氯醛0.6 ml/100 g,麻醉后動(dòng)物仰臥于手術(shù)臺(tái),頭架固定頭部,頸前正中氣管切開(kāi),插管,自主呼吸。自氣管旁進(jìn)路,分離附著于顱底的肌肉組織,暴露枕部顱底,于右側(cè)顱底用電鉆磨開(kāi)一約2 mm×4 mm骨窗,刺破硬、軟腦膜,暴露小腦前下動(dòng)脈。將浸有5 μl 40%FeCl3的濾紙覆蓋于小腦前下動(dòng)脈上,5分鐘后撤除濾紙,生理鹽水沖洗局部。連續(xù)記錄耳蝸血流量(cochlear blood flow,COBF)變化,30分鐘后COBF不再下降并穩(wěn)定,標(biāo)志血栓形成。干預(yù)組在應(yīng)用FeCl310分鐘前經(jīng)頸外靜脈注射尼莫地平0.5 mg/kg,實(shí)驗(yàn)組注射等量生理鹽水,正常對(duì)照組不注射任何藥物。小腦前下動(dòng)脈血栓形成后,生理鹽水稀釋尿激酶至1×104U/ml,干預(yù)組和實(shí)驗(yàn)組于頸外靜脈給予尿激酶4 000 U/kg緩慢推注,30分鐘后COBF不再上升且穩(wěn)定,標(biāo)志血栓溶解、血流再灌注。
1.3.2耳蝸血流量測(cè)量方法 打開(kāi)右側(cè)聽(tīng)泡,暴露耳蝸,三維固定儀固定激光多普勒流量?jī)x探針型探頭,使探頭尖端輕輕接觸耳蝸底回外側(cè)壁,測(cè)量耳蝸血流,穩(wěn)定三分鐘后連續(xù)記錄,結(jié)果以PSW軟件分析數(shù)據(jù)輸出。
1.3.3ABR檢測(cè)方法 干預(yù)組和實(shí)驗(yàn)組分別在缺血前、再灌注1、2、6 h時(shí)行ABR檢測(cè),對(duì)照組行一次ABR檢測(cè)。同上法麻醉豚鼠,電極皆用直徑0.38 mm、長(zhǎng)13 mm的針灸針,記錄電極置于雙側(cè)耳廓前緣連線中點(diǎn)的頭頂皮下,參考電極置于同側(cè)耳垂皮下,鼻尖部接地。刺激聲為click,升降時(shí)間1 ms,平臺(tái)期10 ms,交替波,帶寬為100~1 500 Hz,刺激重復(fù)率為11次/秒,平均疊加300次,掃描時(shí)間10 ms,間期100 μs,聲刺激強(qiáng)度以120 dB SPL開(kāi)始,每10 dB一檔減至閾值上下,然后5 dB一檔升降確定閾值,以能引出明確的可重復(fù)波Ⅲ的最小刺激聲強(qiáng)度作為閾值。
1.3.4耳蝸基底膜鋪片及熒光染色 各組于ABR測(cè)試完畢后,斷頭取聽(tīng)泡,經(jīng)4%多聚甲醛室溫固定1小時(shí)后,于10 mmol/L PBS(pH7.4)中分離基底膜,平鋪于玻片上,將濃度為10 μg/ml Hoechest33342 熒光染料 25 μl滴加在每一只標(biāo)本上,避光30分鐘,PBS沖洗三遍后,50%甘油封片,共聚焦顯微鏡下觀察細(xì)胞核形態(tài)學(xué)變化。
1.3.5免疫組織化學(xué)染色觀察螺旋神經(jīng)節(jié)凋亡因子Casepase-3變化 10%水合氯醛溶液腹腔注射30 mg/kg,仰臥固定,開(kāi)胸暴露心臟,灌流沖洗,隨后灌注4%多聚甲醛磷酸緩沖液(pH 7.4)500 ml。將豚鼠迅速斷頭,快速取出耳蝸,在蝸?lái)斻@孔并挑破圓窗膜和卵圓窗,用上述固定液重復(fù)進(jìn)行耳蝸灌流至少5 次后,放入相同固定液中,4 ℃過(guò)夜。修剪后置入10%乙二胺四乙酸二鈉充分脫鈣3周左右,梯度酒精脫水,常規(guī)石蠟包埋,耳蝸中軸5 μm連續(xù)切片。Caspase-3免疫組化染色:耳蝸組織切片常規(guī)脫蠟至水,3%H2O2孵育10 min,蒸餾水沖洗。滴加抗原修復(fù)液1~3滴,孵育10 min,,蒸餾水沖洗。10%正常羊血清封閉20 min;實(shí)驗(yàn)組和干預(yù)組滴加兔多抗Caspase-3抗體(1:200),4 ℃過(guò)夜,對(duì)照組用正常羊血清代替一抗;加生物素標(biāo)記二抗,37 ℃孵育30 min;PBS漂洗三次,滴加鏈酶親和素-生物素-過(guò)氧化物酶復(fù)合物(SABC)反應(yīng)液1~2滴,37 ℃二氨基聯(lián)苯胺(DAB)顯色; Mayer蘇木素復(fù)染,梯度酒精脫水,透明、封片,顯微鏡(10×40)視野觀察照相。以上試劑均由北京中山公司提供。
1.3.6圖像分析處理 Caspase-3染色切片由新9.0版HPIAS-100高清晰度彩色病理圖像免疫組化測(cè)量系統(tǒng),在40倍視野下,每張切片隨機(jī)取5個(gè)視野,測(cè)量每組螺旋神經(jīng)節(jié)細(xì)胞的平均吸光度。各組動(dòng)物于400倍光鏡下在耳蝸底回末段和第二回起始段分別取三個(gè)視野計(jì)數(shù)缺損內(nèi)毛細(xì)胞(缺失和損傷細(xì)胞),并計(jì)算內(nèi)毛細(xì)胞缺損率(缺失加損傷細(xì)胞核與原有細(xì)胞核的比例)。
1.4統(tǒng)計(jì)學(xué)方法 全部數(shù)據(jù)經(jīng)SPSS11.5統(tǒng)計(jì)包處理。采用重復(fù)測(cè)量資料方差分析進(jìn)行統(tǒng)計(jì)。
2 結(jié)果
2.1耳蝸血流量監(jiān)測(cè) 各組耳蝸血流量見(jiàn)表1,可見(jiàn),栓塞30分鐘時(shí)實(shí)驗(yàn)組和干預(yù)組耳蝸血流量較各組缺血前及對(duì)照組明顯降低,再灌注后耳蝸血流量又有所回升,但仍較缺血前低,說(shuō)明造模成功。耳蝸缺血再灌注前后,實(shí)驗(yàn)組與干預(yù)組耳蝸血流量差異無(wú)統(tǒng)計(jì)學(xué)意義(P>0.05)。
2.2ABR檢測(cè)結(jié)果 各組ABR閾值變化見(jiàn)表2,可見(jiàn),缺血前實(shí)驗(yàn)組、干預(yù)組、對(duì)照組的ABR閾值差異無(wú)統(tǒng)計(jì)學(xué)意義(P>0.05),再灌注后干預(yù)組ABR閾值較實(shí)驗(yàn)組明顯降低(P<0.01),較對(duì)照組和缺血前仍明顯升高(P<0.01)。
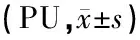
表1 各組不同時(shí)間點(diǎn)耳蝸血流量
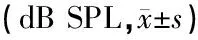
表2 各組不同時(shí)間點(diǎn)ABR閾值
注:*與缺血前及實(shí)驗(yàn)組同時(shí)間點(diǎn)比較,P<0.01
2.3耳蝸基底膜鋪片及熒光染色 對(duì)照組各回均有整齊排列的三排外毛細(xì)胞和一排內(nèi)毛細(xì)胞,毛細(xì)胞無(wú)缺失,實(shí)驗(yàn)組和干預(yù)組外毛細(xì)胞未見(jiàn)明顯的細(xì)胞核形態(tài)異常,內(nèi)毛細(xì)胞均有不同程度的丟失及細(xì)胞核形態(tài)異常,各回基底膜中內(nèi)毛細(xì)胞的損傷以底回為最,其次為第二回(圖1)。各組各時(shí)間點(diǎn)內(nèi)毛細(xì)胞缺損率見(jiàn)表3,實(shí)驗(yàn)組與干預(yù)組在同一時(shí)間點(diǎn)差異均有統(tǒng)計(jì)學(xué)意義(P<0.01)。
2.4螺旋神經(jīng)節(jié)細(xì)胞Casepase-3免疫組化染色 實(shí)驗(yàn)組螺旋神經(jīng)節(jié)細(xì)胞胞質(zhì)內(nèi)有染色程度不同的棕黃色顆粒分布,并隨時(shí)間的延長(zhǎng)逐漸增加,以再灌注6 h最多,干預(yù)組各時(shí)間點(diǎn)SGC有少量細(xì)胞質(zhì)棕黃色顆粒分布,表達(dá)趨勢(shì)同實(shí)驗(yàn)組,對(duì)照組染色陰性(圖2)。圖像分析各組平均吸光度值見(jiàn)表3,干預(yù)組和實(shí)驗(yàn)組各個(gè)時(shí)間點(diǎn)差異有統(tǒng)計(jì)學(xué)意義(P<0.01)。

表3 各組各時(shí)間點(diǎn)內(nèi)毛細(xì)胞缺損率和耳蝸螺旋神經(jīng)節(jié)細(xì)胞Caspase-3平均吸光度值
注:*與實(shí)驗(yàn)組比較,P<0.01
3 討論
內(nèi)耳缺血或栓塞可影響內(nèi)耳的功能,自身免疫性疾病、感染、噪聲、耳毒性藥物等也可引起內(nèi)耳缺血或缺血再灌注,從而引起內(nèi)耳毛細(xì)胞和神經(jīng)節(jié)細(xì)胞凋亡,導(dǎo)致耳聾或眩暈。
耳蝸由基底動(dòng)脈的分支小腦前下動(dòng)脈供血,小腦前下動(dòng)脈屬于終末動(dòng)脈,無(wú)側(cè)枝循環(huán),發(fā)生阻塞時(shí),不能由其他動(dòng)脈的供血加以補(bǔ)償,因而易造成耳蝸缺血。相對(duì)于部分研究者[1]通過(guò)栓塞雙側(cè)椎動(dòng)脈,以微動(dòng)脈夾鉗夾—松開(kāi)一側(cè)頸總動(dòng)脈來(lái)完成耳蝸缺血再灌注的造模方法, 本實(shí)驗(yàn)用FeCl3誘導(dǎo)小腦前下動(dòng)脈血栓形成,以尿激酶溶解,更符合生理實(shí)際,并通過(guò)激光多普勒檢測(cè)耳蝸血流的變化,客觀地反映了耳蝸缺血再灌注變化過(guò)程。本實(shí)驗(yàn)結(jié)果顯示,使用FeCl330分鐘時(shí),耳蝸血流量顯著降低;再灌注1 h后,耳蝸血流量有所回升,動(dòng)物ABR反應(yīng)閾急劇升高,表明造模成功、可靠。
DNA熒光染料(PI或Hoechest33342)是一種快速、簡(jiǎn)便、可靠的方法,可用于定量檢測(cè)壞死和凋亡的毛細(xì)胞[2]。而Casepase-3是casepase家族中重要一員,一般認(rèn)為它是細(xì)胞凋亡過(guò)程中最重要的終末剪切酶,是細(xì)胞凋亡的執(zhí)行者[3],它的出現(xiàn)標(biāo)志著細(xì)胞凋亡。因此,本試驗(yàn)選取DNA熒光染料染色和Casepase-3免疫組化法分別觀察耳蝸缺血再灌注過(guò)程中毛細(xì)胞和螺旋神經(jīng)節(jié)細(xì)胞變化。結(jié)果顯示,實(shí)驗(yàn)組外毛細(xì)胞核幾乎無(wú)形態(tài)學(xué)上的變化,部分內(nèi)毛細(xì)胞核固縮、缺失。Taniquchi[4]通過(guò)對(duì)豚鼠耳蝸缺血再灌注實(shí)驗(yàn)發(fā)現(xiàn),耳蝸缺血再灌注30 min后即有內(nèi)毛細(xì)胞核固縮,再灌注1 h即有核缺失,并且在24 h之內(nèi)隨時(shí)間延長(zhǎng)缺失率上升,與本實(shí)驗(yàn)結(jié)果一致。本研究實(shí)驗(yàn)組缺血再灌注1、2、6 h螺旋神經(jīng)節(jié)細(xì)胞均有大量Casepase-3表達(dá),并且隨著時(shí)間的延長(zhǎng)而增加,表明在耳蝸缺血再灌注條件下,螺旋神經(jīng)節(jié)細(xì)胞內(nèi)促凋亡因素極為活躍,說(shuō)明耳蝸缺血再灌注早期,內(nèi)毛細(xì)胞和螺旋神經(jīng)節(jié)細(xì)胞發(fā)生凋亡。
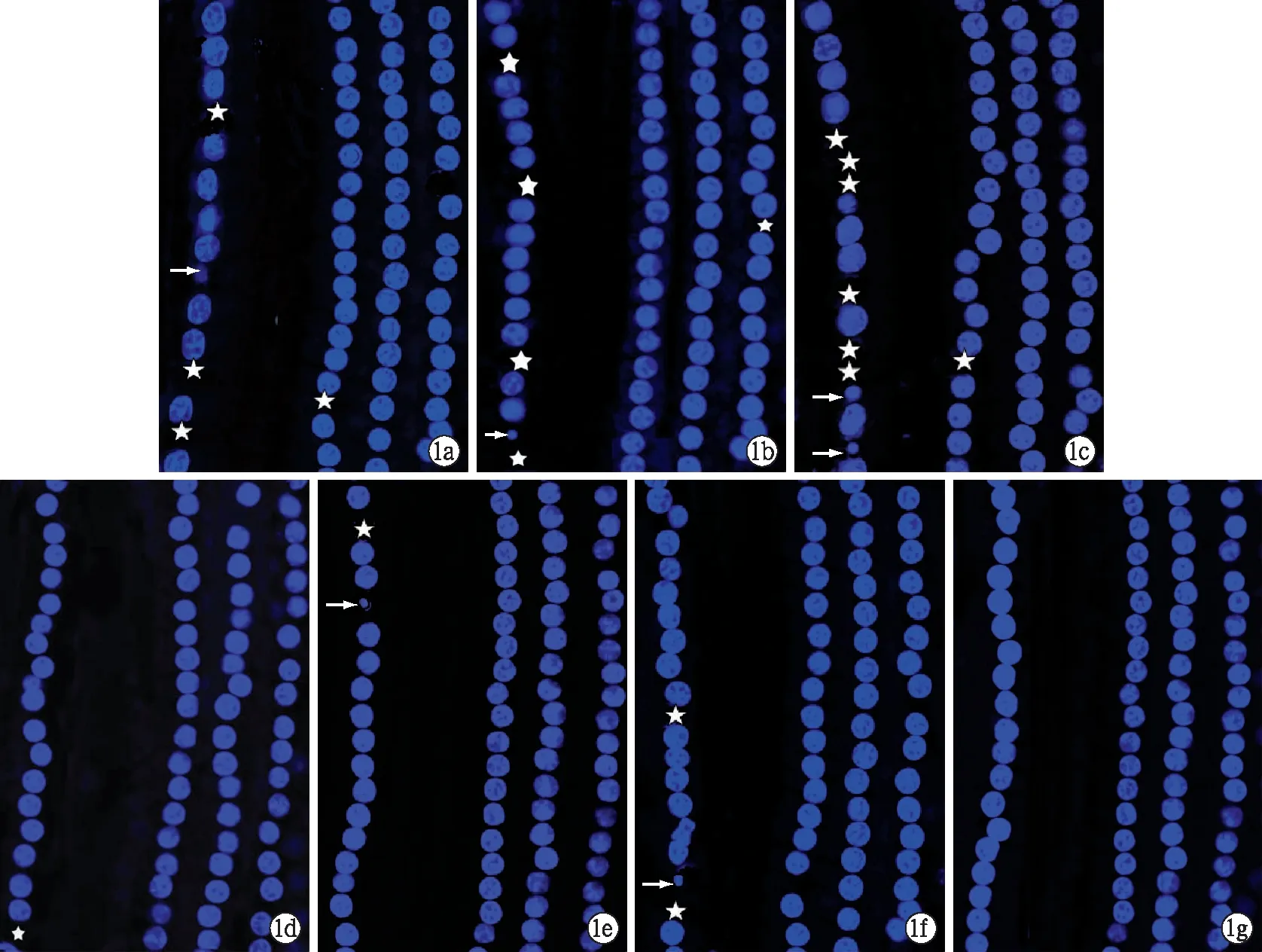
圖1 各組耳蝸毛細(xì)胞核Hochest33342染色 a、b、c分別為實(shí)驗(yàn)組再灌注后1、2、6 h毛細(xì)胞核Hochest33342染色,d、e、f分別為對(duì)干預(yù)組再灌注后1、2、6 h毛細(xì)胞核 Hochest33342染色;g為正常對(duì)照組。 ★表示細(xì)胞核缺失,(→)表示細(xì)胞受損(細(xì)胞核固縮)。(共聚焦顯微鏡×400)
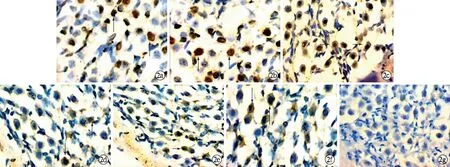
圖2 各組螺旋神經(jīng)節(jié)細(xì)胞Caspase-3免疫組織化學(xué)染色 a、b、c為實(shí)驗(yàn)組1、2、6 h螺旋神經(jīng)節(jié)Caspase-3免疫組織化學(xué)染色,d、e、f為干預(yù)組1、2、6 h,g為正常對(duì)照組。箭頭表示Caspase-3免疫組織化學(xué)染色陽(yáng)性細(xì)胞(SABC×400)
關(guān)于耳蝸缺血再灌注的損傷機(jī)制,目前尚無(wú)定論。研究表明,耳蝸Cort器、螺旋神經(jīng)節(jié)細(xì)胞中存在親離子谷氨酸受體AMPA(α-氨基羥甲基惡唑丙酸),Corti器中AMPA受體位于內(nèi)毛細(xì)胞和傳入神經(jīng)樹(shù)突之間的軸突上,缺血再灌注后,刺激耳蝸內(nèi)毛細(xì)胞和鄰近的支持細(xì)胞釋放大量的谷氨酸,激活A(yù)MPA受體,引起內(nèi)毛細(xì)胞鈣離子內(nèi)流[5~7]。耳蝸螺旋神經(jīng)節(jié)細(xì)胞除存在AMPA受體外,還存在ryanodine受體及 ryanodine受體門控的鈣池,這種鈣池有助于與聽(tīng)覺(jué)神經(jīng)傳導(dǎo)通路有關(guān)的鈣離子信號(hào)傳導(dǎo)[8],缺血時(shí),內(nèi)流的鈣離子激活ryanodine受體,導(dǎo)致鈣池鈣離子釋放[9]。另外,耳蝸缺血再灌注還可引起細(xì)胞膜鈣離子ATP酶(PMCA)失活,不能有效地泵出鈣離子[10]。通過(guò)上述機(jī)制,最終引起細(xì)胞內(nèi)鈣超載,從而導(dǎo)致細(xì)胞發(fā)生凋亡。
以往使用尼莫地平對(duì)心腦等器官缺血再灌注的研究表明,尼莫地平對(duì)缺血再灌注的作用為:①抑制鈣離子內(nèi)流,減輕線粒體鈣超載,抑制線粒體氧化磷酸化藕聯(lián),從而恢復(fù)ATP生成[11];②減輕細(xì)胞內(nèi)乳酸酸中毒:當(dāng)細(xì)胞內(nèi)pH值下降和鈣積聚時(shí),細(xì)胞通過(guò)鈉—?dú)浔煤外c—鈣交換排出鈣離子,因鈣離子內(nèi)流被抑制,使鈉-鈣交換減少,鈉—?dú)浣粨Q相對(duì)增加,而排出更多氫離子;而對(duì)線粒體功能的保護(hù)亦抑制了乳酸的生成[12]。Schnee等[13]研究離體耳蝸外毛細(xì)胞鈣離子電流時(shí)發(fā)現(xiàn),尼莫地平可部分阻斷海龜耳蝸毛細(xì)胞電壓依賴性鈣電流,減輕細(xì)胞內(nèi)鈣離子負(fù)荷,其抑制率與尼莫地平濃度有關(guān)。本實(shí)驗(yàn)干預(yù)組使用尼莫地平后,內(nèi)毛細(xì)胞缺失減少,螺旋神經(jīng)節(jié)Casepase-3表達(dá)下調(diào),ABR反應(yīng)閾較實(shí)驗(yàn)組明顯降低,表明作為一種L型電壓門控性鈣通道阻滯劑,尼莫地平可能通過(guò)抑制鈣離子內(nèi)流從而直接或間接抑制促凋亡基因的表達(dá),最終對(duì)缺血再灌注后的耳蝸起到有效的保護(hù)作用。
鈣通道阻滯劑尼莫地平作為降壓和擴(kuò)管藥物,應(yīng)用于心腦血管疾病方面取得了良好的療效,目前在耳科應(yīng)用方面,大部分人仍然把它作為改善內(nèi)耳血供的藥物使用。但有學(xué)者[14]在豚鼠耳蝸缺血后使用尼莫地平,發(fā)現(xiàn)其并不能改善耳蝸血流,據(jù)此認(rèn)為內(nèi)耳缺血時(shí)不宜使用尼莫地平。本試驗(yàn)結(jié)果也證實(shí)尼莫地平無(wú)法有效的增加耳蝸血流,但并不能由此否定其對(duì)耳蝸缺血再灌注損傷的保護(hù)作用。另外,尼莫地平的濃度可能也是一個(gè)關(guān)鍵因素,有報(bào)道一定量尼莫地平會(huì)導(dǎo)致血管內(nèi)皮細(xì)胞損傷,從而加重缺血再灌注時(shí)耳蝸細(xì)胞的損傷。本實(shí)驗(yàn)所用尼莫地平的濃度參閱多篇文獻(xiàn),并在預(yù)試驗(yàn)中反復(fù)試驗(yàn),確保了作為保護(hù)劑的合理濃度。至于尼莫地平干預(yù)組與正常對(duì)照組ABR反應(yīng)閾之間仍有統(tǒng)計(jì)學(xué)差異,表明尼莫地平還不能對(duì)缺血再灌注損傷起到完全預(yù)防保護(hù)作用,其機(jī)制尚有待進(jìn)一步研究。
4 參考文獻(xiàn)
1 吳昊,周維镕,徐彬.脈鼠耳蝸微循環(huán)障礙模型的實(shí)驗(yàn)研究[J].南通醫(yī)學(xué)院報(bào),2003,23:246.
2 Tabuchi K,Pak K,Chavez E, et al.Role of inhibitor of apoptosis protein in gentamicin-induced cochlear hair cell damage[J].Neuroscience,2007 ,12,149:213.
3 Mizutairi K, Matsunaqa T,Kamiya K,et al.Caspase inhibitor facilitates recovery of hearing by protecting the cochlear lateral wall from acute cochlear mitochondrial dysfunction[J].J Neurosci Res,2008,86:215.
4 Taniquchi M ,Hakuba N,Koqa K,et al.Apoptotic hair cell death after transient cochlear ischemia in gerbils[J].Neuroreport,2002,13:2 459.
5 Osborn KD, Zaidi A, Mandal A,et al. Single-molecule dynamics of the calcium-dependent activation of plasma-membrane Ca2+-ATPase by calmodulin[J]. Biophys J,2004, 87: 1 892.
6 Rizzuto R, Pozzan T. Microdomains of intracellular Ca2+: Molecular determinants and functional consequences[J].Physiol Rev,2006,86: 369.
7 Rachel T, Morton-Jones R T.Ca2+entry via AMPA-type glutamate receptors triggers Ca2+induced Ca2+release from ryanodine receptors in rat spiral ganglion neurons[J].Cell Calcium, 2008,43 : 356.
8 Morton-Jones RT,Cannel MB, Jeyakumar LH,et al. Differential expression of ryanodine receptors in the rat cochlea[J]. Neuroscience, 2006,137:275.
9 Erausquin GA. Transactivation of cell death signals by glutamate transmission in dopaminergic neurons[J]. Crit Rev Neurobiol,2004, 16:107.
10 Verkhratsky A. Physiology and pathophysiology of the calcium store in the endoplasmic reticulum of neurons[J]. Physiol Rev,2005,85:201.
11 Johnson JE Jr, Perkins GA, Giddabasappa A.Spatiotemporal regulation of ATP and Ca2+dynamics in vertebrate rod and cone ribbon synapses[J].Mol Vis,2007,13:887.
12 Dietz RM, Kiedrowski L, Shuttleworth CW.Contribution of Na+/Ca2+exchange to excessive Ca2+loading in dendrites and somata of Ca1 neurons in acute slice Hip[J].Pocampus,2007,17:1 049.
13 Schnee ME,Ricci AJ. Biophysical and pharmacological characterization of voltage-gated calcium currents in turtle auditory hair cells[J]. J Physiol,2003,549(Pt 3):697.
14 馬英蓉,李學(xué)佩,趙一鳴,等.尼莫地平對(duì)正常和椎基底動(dòng)脈供血障礙時(shí)耳蝸血流的影響[J].臨床耳鼻咽喉科雜志,2002,16:174.

