回聲定位蝙蝠耳蝸聽黃斑區毛細胞形態研究
李勝利 趙謙 任田英 張少強 閆利英 劉思偉 王婉瑩 朱宏亮
全世界蝙蝠種類繁多,有1 100多個品種,占地球上哺乳動物的五分之一以上,大多數蝙蝠依靠回聲定位進行導航和捕食,其最顯著的特征是具有敏銳的聽覺和纖細調諧分析多普勒頻移回聲(CF2)的功能。因此,其耳蝸明顯出現了有別于非回聲定位蝙蝠和哺乳類動物的特化現象,集中表現在耳蝸基底膜上和(中樞)下丘出現極度擴展從而得到極度表達的區域,被稱之為“聲黃斑” (acoustic fovea)[1~5],也有作者稱之為“聽黃斑”(auditory fovea)[6~8],Russell等[9]曾測定髯蝠稱之為耳蝸斑(cochlear fovea)。普遍認為哺乳類動物的耳蝸外毛細胞(OHC)胞體運動和/或纖毛束運動在耳蝸放大器機制中起重要作用[10],而蝙蝠的OHC卻不具備耳蝸放大器功能,恰好相反,它在最佳頻率起限制和阻抗基底膜放大的作用。有關回聲定位蝙蝠耳蝸的蓋膜(tectorial membrance ,TM)和基底膜(basilar membrane, BM)及附著結構與聽黃斑的生理關系已進行了較多研究[3,7,9,11~15],但對聽黃斑區的毛細胞超微結構研究較少[4,16~19]。為探討回聲定位蝙蝠與哺乳動物耳蝸機制上差異的原因,本研究觀察了蹄蝠、菊頭蝠和犬吻蝠耳蝸毛細胞形態的超微結構,以了解回聲定位蝙蝠聽黃斑區的毛細胞形態特征,現報告如下。
1 材料與方法
1.1實驗材料 從陜西柞水縣溶洞捕捉百余只蝙蝠,品種經中國科學院動物研究所鑒定有三種:蹄蝠(Hipposiderid)、菊頭蝠(Rhinolophus)和犬吻蝠(Molossidae)。用12只C57小鼠、20只豚鼠和6只棕色田鼠耳蝸作為對照。蝙蝠捕獲時間及觀察品種和數量見表1。

表1 不同時間觀察的蝙蝠的種類、數量和性別
1.2聽功能檢測 三種蝙蝠各取10只分別測試ABR,實驗動物麻醉后,置于屏蔽室內,顱頂為記錄電極,參考電極在測試耳乳突部,接地電極接鼻尖。以鍍有銀化物的專用電極刺入約0.5 mm,保證針刺電極的極間電阻在1 kΩ左右(不超過3 kΩ),由RA4LI模塊自帶電阻檢測顯示。
蝙蝠在實驗過程中被固定于屏蔽室內的記錄臺上,并保證受測耳與喇叭的位置固定距鼓膜2~3 cm。Tucker-Davis Technologies TDT System Ⅲ用于聽覺刺激信號的發送和采集。
本儀器配置TDT RP2.1 實時信號處理器,刺激聲為TDT軟件自帶的Black man短純音修改的2 ms短純音(tone burst),以每秒21.01次刺激率由Tucker-Davis Technologies TDT System Ⅲ的RX5模塊產生,經RP2.1模塊在PA5衰減后由TDT ED1 Electrosatatic Speaker Driver驅動靜電場揚聲器發聲,頻率范圍2~100 kHz,分別為2、4、8、12、16、20、24、28、32、36、40、44、48、52、56、60、64、68、72、76、80、84、88、92、96和100 kHz,由TDT PA5以 5 dB梯度強度從100 dB向0 dB自動衰減,前置放大增益100 k,RX5-2 數字濾波。帶通濾波100~3 000 Hz,疊加500~1 000次,純音刺激間期2 ms,上升和下降時間1 ms,以波Ⅰ、Ⅱ和Ⅴ的出現或消失(<1 μV)為標志波進行測試。信號的疊加在TDT硬件系統和BiosigRP幫助下進行。
1.3耳蝸電鏡標本制作及觀察方法 在檢測聽功能后,將處于麻醉狀態的蝙蝠快速斷頭處死,取出雙側聽泡,在手術顯微鏡下暴露出耳蝸,用細鋼針挑破蝸頂和耳蝸底回圓窗及卵圓窗,快速灌入2.5%戌二醛PBS 液,4 ℃固定4 h ,1.0%鋨酸固定2 h,PBS 洗滌后在手術顯微鏡下去除耳蝸骨殼、蓋膜及部分血管紋組織,充分暴露出Corti器上的基底膜內外毛細胞。梯度乙醇脫水,臨界點干燥,噴金,定位后掃描電鏡(SEM)標本在VegaC Tescan(捷克,SEM MAG: 49X)和高分辨SEM-3010(日立)上觀察;透射電鏡樣品用EPON618平板包埋,LDB5型超薄切片機切片,醋酸鈾及硝酸鉛復染,日立680型電鏡觀察。
觀察方法:按照K?ssl和Vater觀察髯蝠的方法[15,17],從耳蝸基底到頂端的距離,將耳蝸分為SI區(sparsely innervated,SI)和CF2區(second harmonic constant-frequency component of the echolocation call,CF2)及溝回區(Hook),將基底膜分成基底、頂回和斑區(foveal)片段,進行光鏡和電鏡觀察。觀察耳蝸聽黃斑的位置,即從耳蝸基底端向頂端的20%~45%為觀察SI區位置,由46%~75%為觀察CF2區的位置,整個SI區和CF2區均為聽黃斑區(圖1),其它部位觀察用于對照。
1.4統計學方法 使用GraphPad.Prism5統計軟件,應用Newman-Keuls Multiple Comparison Test對數據進行單因素方差分析和t檢驗,比較數據的可信區間。
2 結果
2.1三種正常回聲定位蝙蝠ABR測試結果 在2~12 kHz,三種回聲定位蝙蝠的ABR反應閾均較高,在35 dB SPL以上;犬吻蝠的ABR反應最敏感,其波幅最大及調諧最敏銳頻率在20~28 kHz范圍,其反應閾在10 dB SPL左右;菊頭蝠的ABR反應最敏感和波幅最大及調諧最敏銳頻率在83~86 kHz范圍內;蹄蝠的ABR反應最敏感和波幅最大及調諧最敏銳頻率在60~62 kHz范圍內;由圖2可以看到三種蝙蝠的聽黃斑最敏銳調諧頻率位置和ABR反應閾及頻率位置。
2.2掃描電鏡觀察耳蝸聽黃斑區毛細胞形態
2.2.1中蹄蝠耳蝸聽黃斑區毛細胞形態觀察 三種回聲定位蝙蝠的耳蝸相比,蹄蝠的耳蝸最大,其次是菊頭蝠,犬吻蝠耳蝸最小,但耳蝸均呈2.5回的螺旋狀。蹄蝠耳蝸溝回即最基底部的外毛細胞(OHC)排列成三排,第二排和第三排間距較近,排列緊密,第一排與第二排間距相對較寬。三排OHC聽黃斑的最敏銳調諧頻率分別為菊頭蝠83~86 kHz;蹄蝠60~62 kHz;犬吻蝠20~28 kHz的靜纖毛束呈“V”字型,開角較大,纖毛很短約0.8 μm。內毛細胞(IHC)表皮板大而相互分離,靜纖毛根數少而纖毛較長(圖3)。第一排OHC和IHC間距較大(圖3a),SI區的三排OHC排列與溝回相似,靜纖毛依然很短;而IHC的表皮板更相互分離而獨立,但纖毛根數增加,長度減少,排列較直。第一排OHC和IHC間距較小(圖3b)。CF2區的三排OHC間距縮小,排列緊密,靜纖毛束“V”字型開角變小,靜纖毛仍然很短;IHC的靜纖毛明顯增多,長度較OHC的要長,排列成眉形(圖3c)。耳蝸頂回的三排OHC排列松散,靜纖毛較長,“V”字型開角較小;IHC的表皮板相互連接,靜纖毛長而根數最多,緊密排列成排(圖3d)。掃描電鏡觀察中蹄蝠耳蝸毛細胞體(圖4),可見頂回的OHC短小而呈球形或短柱狀(圖4a);SI區的OHC細胞體呈細頸瓶狀,特點是細胞核上部窄細,細胞核部膨大,外被鄧特氏細胞杯包裹,核下部縮小,整體呈紡錘狀,而并非哺乳動物的長柱狀形態(圖4b);CF2區OHC亦呈現和SI區相似的形狀(圖4c),但不如SI區的顯著,基底溝回的OHC細胞體更小,呈短球狀(圖4d)。

圖1 蝙蝠耳蝸電鏡觀察示意圖[15,17]
掃描電鏡下觀察的蝙蝠耳蝸SI、CF2和溝回部位(a);蝙蝠耳蝸鏡下基底膜各部位的觀察示意圖(b);蝙蝠耳蝸各部位到基底的距離和范圍示意圖(c)

圖2 三種回聲定位蝙蝠ABR反應閾各頻率分布圖
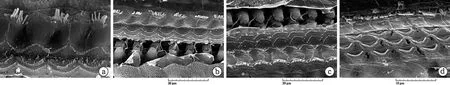
圖3 中蹄蝠耳蝸掃描電鏡觀察
耳蝸溝回、SI區、CF2區和頂回的OHC和IHC的超微結構形態。第一排OHC和IHC間距較大,OHC表皮板呈細長的月牙狀(a);SI區的第一排OHC和IHC間距較縮小(b)。CF2區的三排OHC間距和IHC的靜纖毛明顯增多(c)。耳蝸頂回的三排OHC排列(d)
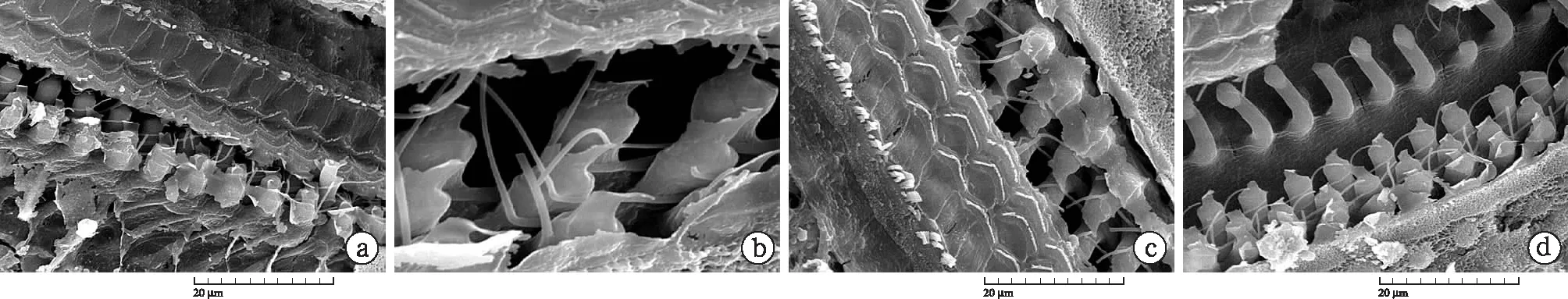
圖4 掃描電鏡觀察中蹄蝠耳蝸毛細胞胞體
可見頂回的OHC短小而呈球形或短柱狀(a);SI區的OHC細胞體呈細頸瓶狀,特點是細胞核上部窄細,細胞核部膨大,外被鄧特氏細胞杯包裹,核下部縮小,整體呈紡錘狀,而并非哺乳動物的長柱狀形態(b);CF2區OHC亦呈現和SI區相似的形狀(c),但不如SI區的顯著。基底溝回的OHC細胞體更小,呈短球狀(d)
2.2.2大蹄蝠耳蝸聽黃斑區毛細胞特征 本研究觀察的所有蝙蝠中,大蹄蝠的體型最大,耳蝸亦最大。耳蝸聽黃斑的SI區和CF2區的OHC呈最典型的紡錘狀(圖5a、b),尤其是CF2區的OHC細胞體的紡錘狀更顯著,IHC的靜纖毛較長(圖5c)。
大蹄蝠CF2區的內外毛細胞高分辨掃描電鏡下超微結構可見CF2區的三排OHC和一排IHC(圖6),IHC的靜纖毛較OHC的明顯長(圖6a),IHC的靜纖毛排列成兩排,纖毛長而根部非常細,而上部較粗,頂端更粗,外排纖毛有數根斷掉(圖6b);OHC表皮板呈細長的“V”型,三排OHC靜纖毛長度相仿,纖毛短而排列成十分整齊的三行,由內向外梯度升高,三行靜纖毛相互密切靠攏,由其頂連接和側連接相互連接在一起(圖6c、d)。
2.2.3菊頭蝠耳蝸聽黃斑區毛細胞形態觀察 與蹄蝠耳蝸相比,菊頭蝠耳蝸較小。耳蝸SI區的毛細胞呈典型的紡錘狀;而CF2區和基底溝回基本呈短球狀或短柱狀(圖7)。

圖5 大蹄蝠耳蝸聽黃斑的SI區和CF2區的OHC
呈最典型的紡錘狀,OHC2~3排的指狀突尤其長(a、b),尤其是CF2區的OHC細胞體的紡錘狀更顯著,IHC的靜纖毛較長(c)

圖6 大蹄蝠耳蝸CF2區觀察高分辨掃描電鏡
IHC的靜纖毛較OHC的明顯長(a),IHC的靜纖毛排列成兩排,纖毛長而根部非常細,而上部較粗,頂端更粗,外排纖毛有數根斷掉(b);OHC表皮板呈細長的"V"型,三排OHC靜纖毛長度相仿,纖毛短而排列成十分整齊的三行,由內向外梯度升高,三行靜纖毛相互密切靠攏,由其頂連接和側連接相互連接在一起(c、d)

圖7 菊頭蝠耳蝸各區毛細胞形態
SI區的OHC細胞體呈典型的紡錘狀;而CF2區亦呈短球狀、短柱狀。頂部OHC細胞體呈長柱狀。基底部OHC排列緊密,細胞體呈短柱體(a);耳蝸黃斑區OHC細胞體呈典型的紡錘型,靜纖毛較短(b、e);第二諧振區OHC細胞體呈短柱狀(c、f);耳蝸頂部OHC呈長柱狀(d)
2.2.4犬吻蝠、小鼠和豚鼠耳蝸各區毛細胞形態 與蹄蝠和菊頭蝠耳蝸相比,犬吻蝠的耳蝸更小。犬吻蝠和豚鼠耳蝸掃描電鏡圖見圖8。犬吻蝠耳蝸頂部OHC的電鏡圖見圖9。
回聲定位蝙蝠犬吻蝠耳蝸SI區與C57小鼠耳蝸相對應的部位對比觀察,可見回聲定位蝙蝠的SI區OHC胞體均呈紡錘狀(圖10a~c),而C57小鼠耳蝸相對應部位的OHC均呈長柱狀或試管狀(圖10d~f)。OHC形態表現出回聲定位蝙蝠與哺乳動物的明顯差異。
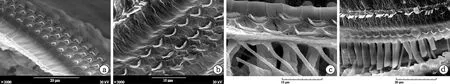
圖8 犬吻蝠、豚鼠的耳蝸掃描電鏡圖
可見在與蝙蝠聽黃斑相對應位置的OHC結構呈現出典型的哺乳類動物形態,OHC排列分散,三排OHC間距相近,靜纖毛較長(a、b犬吻蝠);細胞體形態亦呈典型哺乳動物的長柱狀,三排OHC指狀突平行(c、d豚鼠)

圖9 犬吻蝠頂部OHC電鏡圖
靜纖毛較長,表皮板呈腎型(a),SI區靜纖毛較前稍短,表皮板呈腎型(b),CF2區OHC靜纖毛短(c),以上區域三排OHC的排列較分散;而基底部靜纖毛最短,三排OHC排列緊密,OHC細胞體呈短柱狀,表皮板呈細長“V”型(d)

圖10 回聲定位蝙蝠耳蝸SI區與C57小鼠耳蝸相對應的部位對比觀察
可見回聲定位蝙蝠的SI區OHC胞體均呈紡錘狀(a~c);而C57小鼠耳蝸相對應的部位的OHC均呈長柱狀或試管狀,第三排OHC的指狀突明顯與網狀板連接(d~f)。
2.3透射電鏡觀察耳蝸聽黃斑區毛細胞形態 透射電鏡下可見三種蝙蝠的耳蝸外毛細胞體均不呈現大多數哺乳類動物耳蝸外毛細胞的圓柱狀,并且細胞體較短,OHC的細胞核在細胞中顯得尤其大。犬吻蝠外毛細胞呈典型的燒瓶狀,蹄蝠和菊頭蝠外毛細胞呈啞鈴狀,即毛細胞核部與胞體中上部膨大,而毛細胞上端變細(圖11)。內毛細胞均呈倒燒瓶狀,內外毛細胞體內細胞器均存在,但數量不多。外毛細胞底部與Deiters細胞相連,但未見到Deiters細胞杯狀包裹外毛細胞底部的現象。豚鼠和棕色田鼠耳蝸外毛細胞基本呈圓柱體樣形態。
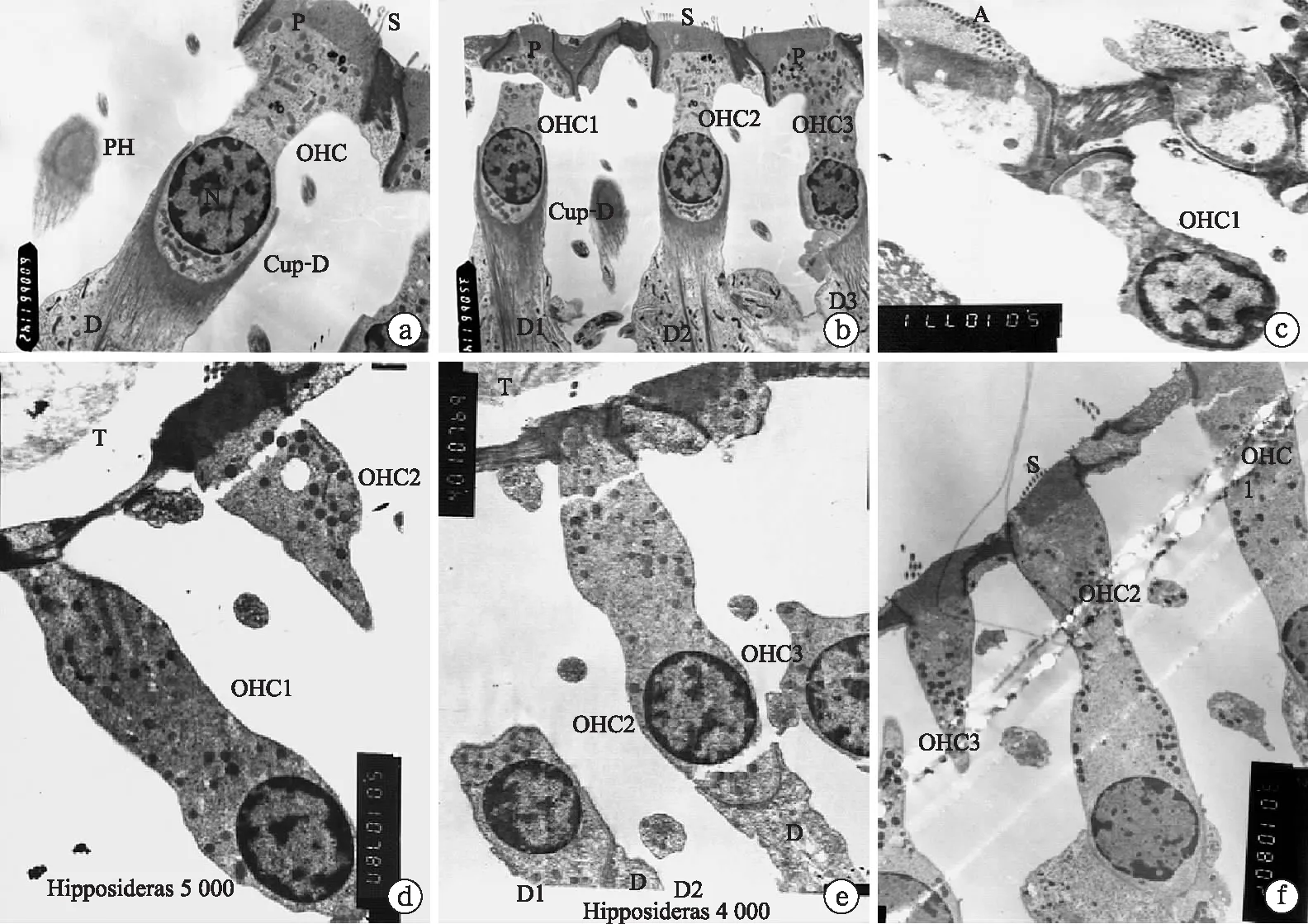
圖11 透射電鏡觀察蝙蝠耳蝸外毛細胞的形態結構
蹄蝠的耳蝸底回外毛細胞(OHC)呈燈盞形,支持細胞(Deiter)、靜纖毛(Steria bundle)、支持細胞(Deiter) 形成的包裹外毛細胞杯狀連接(Cup-Deiter)(a);蹄蝠的耳蝸底回三排外毛細胞(OHC)呈燈盞形,支持細胞(Deiter)、靜纖毛(Steria bundle)、支持細胞(Deiter) 形成的包裹外毛細胞杯狀連接(Cup-Deiter)(b);犬吻蝠耳蝸底部的OHC呈短燒瓶狀(c);菊頭蝠的OHC呈紡錘狀(d);長翼蝠OHC呈紡錘狀(e);犬吻蝠耳蝸底部的OHC呈長燒瓶狀(f)
3 討論
回聲定位蝙蝠經過長期的進化,為了敏銳感覺和調諧分析其叫聲回聲頻率的多普勒頻移(CF2),耳蝸明顯出現了有別于非回聲定位蝙蝠和哺乳類動物的特化現象,在蝙蝠耳蝸基底膜上代表區極度擴展從而得到極度表達的區域稱為"聲黃斑"[1]。根據大多數研究者的命名和該區域主要感覺回聲的生理特點[1,5,10,19~22],以及與視力的“視黃斑”相對應。本文將回聲定位蝙蝠的回聲過度表達區稱之為“聽黃斑”,國內學者有的稱之為“聽覺凹”[22,40]。目前研究證明菊頭蝠的聽黃斑最敏感的調諧頻率是83.0~84.5 kHz[7~9,23],蹄蝠是60~62 kHz[24],而犬吻蝠的聽黃斑頻率最低是21~27 kHz[4]。本研究三種蝙蝠的聽黃斑反應頻率范圍與上述研究結果基本相同,頻率范圍稍有擴大,可能與采用的ABR測試方法不同有關。
3.1回聲定位蝙蝠聽黃斑的形態特征 Bruns[11]定量研究蹄蝠屬的馬鐵菊頭蝠(Rhinolophus ferrumequinum)耳蝸形態學特化(morphological specialization)與外周聽覺系統的特殊敏銳調頻的相關性, 證明該種蝙蝠的耳蝸基底膜平均長度為16.1 mm,明顯比其它體型大小相當的哺乳類動物長,甚至超過其它發射調頻聲(frequency modulated, FM)定位的蝙蝠;沿耳蝸管有兩個顯著的突變中斷結構,對耳蝸的特化功能具有重要意義:第一個最顯著中斷出現在距基底膜最底端4.3~4.6 mm處,該處基底膜厚度由35 μm突降到10 μm,在稍低處出現急轉直下的坡度區(4.5~4.6 mm),該區的基底膜寬度最窄;第二個中斷出現在基底膜7.8 mm處,此處的基底膜寬度對應于骨螺旋板外側的變化;這些耳蝸特化結構的作用與頻率分析的機制相互對應。Bruns[23]分析馬鐵菊頭蝠的耳蝸結構,正常外毛細胞核基底部直徑2.85 μm ,頂部3.2 μm,靜息頻率(resting frequency, FR)在82.6~83.3 kHz,回聲出現在83.0~86.0 kHz,在基底膜的4.5 mm處。本研究主要觀察Bruns等研究[10,23]相同位置的基底膜,該處是聽黃斑的主要部位。
Bruns等[3]研究大蹄蝠(greater horseshoe bat)耳蝸發現其適應不同聽覺功能的三個區域:①從基底膜1.3~5.4 mm的恒頻(constant frequency)定向片段(圍繞 83 kHz) 的分析區,該區域的神經結構相似于其他哺乳類動物;②5.4~8 mm區域,頻率從40~80 kHz涵蓋了方向信號的調制部分;③從8 mm處到頂部(16 mm) 是頻率低于40 kHz區域。另外,耳蝸任何部分的外毛細胞上均無傳出纖維。同年Bruns[25]報道用掃描電鏡觀察馬鐵菊頭蝠(Rhinolophus ferrumeguinun)的耳蝸內外毛細胞和蓋膜(tectorial membrance,TM)結構,該種蝙蝠聽覺系統的敏銳調頻在83 kHz 的小頻率帶,是該動物的恒頻回聲定位信號區;基底膜0~4.5 mm區是圍繞83 kHz 的頻率響應部位,具有以下特征:①與其他哺乳類動物相比,OHC的靜纖毛較短;②第一排OHC的Z字形連續出現在TM相關的位置上;③第一排OHC與其他兩排間具有寬大的分離帶;④IHC靜纖毛兩倍長于其他哺乳類動物及菊頭蝠的其他耳蝸部位;⑤IHC受體表面小且有寬大的分離帶;⑥沒有發現TM與IHC的接觸結構。這些特征說明它適應于提升高頻的敏感性或適應特殊的纖細頻率分析。本研究在菊頭蝠耳蝸SI和CF2區觀察到OHC同樣具有上述現象,且從ABR反應幅度和閾值看,其敏銳高調頻在83~86 kHz。
Vater等[16]觀察到髯蝙蝠耳蝸外毛細胞特別短,基底回長12~15 μm ,頂回長28~30 μm ;Deiter細胞的指突尤其長,其細胞膜包裹外毛細胞底部成杯狀,他認為外毛細胞亦呈現典型的哺乳類動物耳蝸形狀,并含有電子致密物質和微管。明顯的特化表現在蹄蝠耳蝸底回下部的內毛細胞,主要是靜纖毛有兩排纖毛,每排僅有7~8根纖毛,OHC纖毛高度僅為0.8 μm,表皮板小而相互分離[26],但沒有觀察OHC胞體的形態差異。Vater等[4]對巴西犬吻蝠(Tadarida brasiliensis) 的耳蝸進行掃描電鏡觀察,結果顯示形態特征與非特化的高頻過程相關,如:①基底膜呈輻射狀,而基底膜增厚片段與蓋膜變薄相對等呈齒形匹配;②三排外毛細胞形態相似。從基底膜35%~86%處, 頻率在12~30 kHz,該區域界定為聲黃斑(acoustic fovea),它包括最大敏感頻率和敏銳調頻 (21~27 kHz) 的分布,但其頻率低于聲納信號。聲黃斑具有下列幾個形態學特征:①主要由透明物質(hyaline substance)構成的基底膜呈連續輻射狀增厚;②螺旋韌帶(spiral ligament)增加張力纖維層數目;③三排OHC的靜纖毛排列具有形態差異。在OHC主動運動表達差異上,沒有任何超微結構證明OHC細胞體的組織結構在聽黃斑區與其它耳蝸區之間存在定性差異,而僅在OHC的表皮板和靜纖毛束的排列上出現特化。而本研究發現聽黃斑區的OHC細胞體與其他區域差異甚大,聽黃斑區的OHC細胞體呈球形或燒瓶狀、紡錘形,并不是其他區域的圓柱型,犬吻蝠的最大敏感頻率和敏銳調頻亦在21~27 kHz范圍。
Reuter等[27]測定昭短尾葉鼻蝠(Carollia perspicillata)的OHC電能動性(electromotility),發現耳蝸頂部的OHC呈典型的哺乳類動物形狀,而基底部的OHC卻相當短,呈球形(baii-shaped),OHC最顯著的位移在細胞核和表皮板水平上,由低于100 Hz的刺激頻率引出的最大位移約0.3~0.8 μm,與其相同的是本研究現SI和CF2區的部分OHC呈球形。OHC的形狀增加細胞膨壓是由于細胞外液低滲[27],蹄蝠的OHC呈柱狀[15,16], 因此,可推測毛細胞第一個動力是耳蝸回影響浴滲透壓。在蝙蝠中,有多個結構調整兩種毛細胞和支持細胞,可能是其對高頻刺激有效放大至關重要的。魯氏菊頭蝠(Rhinolophus rouxi)非常短的OHC纖毛排顯示夸張的傾斜角相互傾向可能導致剛度增加[15]; 有研究發現在高頻率增加整個Corti器勁度有利于機械相互作用[16]。本研究可見SI和CF2區的OHC纖毛非常短,并且相互緊密靠攏和連接,亦支持其增加其靜纖毛束剛性的觀點。K?ssl等[18]研究氨基糖苷類損害髯蝠耳蝸毛細胞后DPOAE變化,用掃描電鏡觀察SI區和CF2區的毛細胞,在編碼第二諧波恒頻回聲定位叫聲組分(second harmonic constant-frequency component of the echolocation call,CF2)和75~100 kHz間的耳蝸區損害最大,DPOAE幅值升高。這與目前普遍認為的耳毒性損害OHC造成DPOAE幅值下降相矛盾[24]。本研究參照他們的方法對蝙蝠聽黃斑區的毛細胞進行觀察,正常蝙蝠的結果基本與其觀察的毛細胞結構一致,但他們沒有對OHC細胞體進行觀察,本研究對OHC的形態觀察填補了上述研究的空白。結合以前的文獻報道和本研究觀察結果,基本可以認為:①回聲定位蝙蝠耳蝸聽黃斑區OHC呈燒瓶狀、紡錘狀和啞鈴狀或球狀;②聽黃斑區的OHC被Diters氏細胞形成的細胞杯包裹,不利于OHC的主動運動;③聽黃斑區的OHC纖毛特別短,且具有很強的剛性,不利于纖毛束的主動擺動和振動。蝙蝠這三點OHC的特化形態證明它的聽覺機制不同于其他哺乳動物。
3.2回聲定位蝙蝠聽黃斑區毛細胞特化對耳蝸聽覺機制的影響 目前普遍認為哺乳類動物耳蝸OHC細胞體呈長柱狀,以前對回聲定位蝙蝠的研究觀察也證明蹄蝠、髯蝠及犬吻蝠的OHC細胞體為圓柱狀[15,16],也有報告蹄蝠、菊頭蝠和犬吻蝠耳蝸OHC呈燒瓶狀、紡錘狀和和啞鈴狀,明顯有別于其他哺乳類動物[18]。僅Reuter[27]觀察到昭短尾葉鼻蝠耳蝸頂部的OHC呈典型的哺乳類形狀,而基底部的OHC卻相當短,呈球形(baii-shaped)。我們認為決定毛細胞體形態的關鍵是表皮板的形狀,因為表皮板是毛細胞的頂表面形態特征。普遍認為哺乳動物的外毛細胞表皮板基本是圓形,所以OHC細胞體的橫截面與其表皮板統一呈圓形,沿其縱軸到圓形細胞核的底部,OHC細胞體呈圓柱狀;而回聲定位蝙蝠的OHC表皮板呈細長的"V"字形,沿其縱軸向下"V"字形逐漸變化為包裹細胞核圓形呈現為球形。所以,由于觀察回聲定位蝙蝠耳蝸OHC的方向和角度不同,而出現不同的細胞體形態。從本研究看垂直于OHC表皮板觀察,其細胞體呈球形(圖5a、b;圖7b);而平行于OHC表皮板,沿基底膜的放射方向觀察,OHC細胞體呈現兩頭大、中間小的啞鈴狀形態(圖4b、c和d;圖11a和b;圖12),在某種情況可以呈圓柱狀(圖7c和f);如果平行于OHC表皮板,沿基底膜的縱向方向觀察,OHC的細胞體形態呈頭小而向細胞核變膨隆的燒瓶狀(圖11c、圖12)。總之,回聲定位蝙蝠耳蝸OHC的細胞核均呈圓形,因表皮板的特化形態向細胞核的縱向變化而呈現不同的形狀(圖12),與哺乳動物的圓形表皮板形成的圓柱狀細胞體呈鮮明對照。
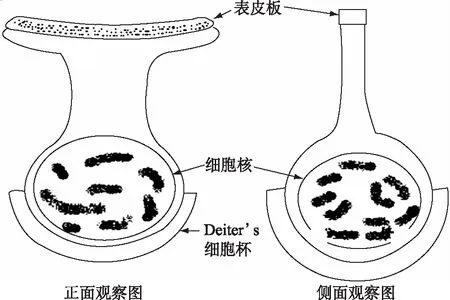
圖12 回聲定位蝙蝠聽黃斑區外毛細胞不同方向觀察形態模式圖
Wada等[26]觀察豚鼠耳蝸OHC發現馬達蛋白(protein motor)在細胞頂部和基底部無分布,而在細胞中部細胞側膜均勻分布,OHC的運動主要在細胞中部。Dallos等(1991)[28]觀察到OHC具有統一直徑的細長圓柱形,電刺激產生的OHC運動在細胞縱向范圍,但不涉及表皮板和細胞核及突觸區。Zheng等[29]亦認為OHC是具有恒定直徑、長度不同的圓柱體,在豚鼠同樣觀察到OHC細胞體呈長圓柱形[30~33],在回聲定位蝙蝠也觀察到OHC細胞體是圓柱形[4,15],可能與他們觀察角度不同有關。回聲定位蝙蝠OHC的這種形態特化,對其主動運動機制不利,而對降低基底膜的勁度有利。根據OHC細胞體與Deiters細胞體的密切結合,以及尤其長的Deiters指狀突與網狀板的結合這兩個特點,推測OHC可順應TM的諧振,從而促進基底膜共振行波的前行傳導,此點尚需以后的研究證實。
蝙蝠這種在CF2頻率范圍內非常狹窄的頻率調諧的共同特點是:①耳蝸外毛細胞在SI區沒有像一般理論認為的通過OHC的電能動性完成耳蝸的放大作用。所有對蝙蝠的研究均未證明OHC對SI區和CF2頻率共振器發揮主要作用;研究證明蝙蝠的OHC起阻尼作用,可改變基底膜的阻抗狀態;②與傳統的耳蝸聽覺機制認為的行波逆向傳播造成耳聲發射相反,蝙蝠的SI區的TM和BM共振器與OHC結合,泵發功能進入鄰近的CF2區,發生了標準波的正向傳播,導致耳聲發射延遲,并且SI區TM和BM共振器導致耳蝸前庭階和鼓階液體壓力改變。Ren等[34]用掃描激光干涉儀檢測沙土鼠聲反射頻率BM振動的縱向形式,發現耳蝸基底有一個向前的行波(forward traveling wave),但未發現反向的逆向行波(backward-traveling wave)出現在聲反射頻率。這些結果與目前流行理論相矛盾,證明耳聲發射是通過耳蝸液體的壓縮波,而不是沿BM傳導的反向行波[35],并且DP產生位點有一個從基底側移向頂側的放大位置[36], 通過對耳蝸OAE延遲的測量分析,顯示耳蝸內總的聲反射延遲相等或略小于向前的延遲(forward delay),說明是耳蝸液體壓力改變導致的壓縮波[37]。耳聲發射與基底膜振動的相位關系顯示DPOAE從其在耳蝸內產生部位到外耳道的傳導方式與傳統的逆向行波不完全相同,DPOAE前行波在耳蝸內分布的范圍比按照理論計算的大得多。 通過測量和比較BM在兩個點振動的相位角發現,在耳聲發射頻率上的BM行波向前而不是逆向傳播[34]。實驗證明耳聲發射是反向傳導的耳蝸液體壓縮波(compression waves)[38]。按照任田英[39]及上述研究[34,37,38],如果耳聲發射經耳蝸液體壓縮波逆向傳出,那么該機制在聲音在耳蝸前行傳導中的作用是什么?運用蝙蝠聽覺斑的頻率分析現象,可以回答該問題,像蝙蝠耳蝸中前行波是為了對最佳頻率的極大擴展和對多普勒頻移回聲(Doppler-shifted echoes)的過度表達一樣,人類或非回聲定位的哺乳動物可能亦存在對最佳頻率臨近的低頻率選擇擴展和過度表達需要,而且,最新的研究表明聽覺凹的范圍與蝙蝠多普勒頻移補償效應相關,即CF蝙蝠可能存在兩大類抑制和興奮型神經元通過拮抗性作用調節多普勒補償效應[40]。對這些聽力學基本問題的重要推論,尚待大量的實驗證據支持和證明。現有的耳蝸行波理論無法解釋的實驗結果,加上對特化耳蝸聽覺生理的研究,必將促進聽覺新理論的產生和發展,將對耳蝸機制和臨床聽力疾病的診斷和治療具有重要的意義和廣闊的應用前景。
(本研究在我校環境與疾病相關基因教育部重點實驗室完成。電鏡觀察得到213研究所安老師和張芳同志的支持,高分辨掃描電鏡得到西安理工大學張老師的支持。美國任田英教授閱讀本文并提出修改意見。在此,一并表示感謝!)
4 參考文獻
1 Ulanovsky N, Moss CF. What the bat's voice tells the bat's brain[J].PNAS, 2008,105:8 491.
2 Suga N, Simnons JA, Jen PHS. Peripheral specialization for fine analysism of Doppler-shifted echoes in the auditory system of the 'CF-FM' bat Pteronotus parnellii[J]. J Exp Biol, 1975,63:161.
3 Bruns V, Schmieszek E.Cochlear innervation in the greater horseshoe bat: Demonstration of an acoustic fovea[J]. Hear Res,1980,3:27.
4 Vater M, Siefer W.The cochlea of Tadarida brasiliensis: Specialized functional organization in a generalized bat[J].Hear Res,1995,91:178.
5 Neuweiler G. Evolutionary aspects of bat echolocation[J]. J Comp Physiol A, 2003,189:245.
6 Rübsamen R, Sch?fer M. Audiovocal interactions during development? Vocalisation in deafened young horseshoe bats vs. audition in vocalisation-impaired bats[J]. J Comp Physiol A,1990,167:771.
7 Russell IJ,K?ssl M. Micromechanical responses to tones in the auditory fovea of the greater mustached bat's cochlea[J]. J Neurophysiol, 1999,82:676.
8 Metzner W, Zhang SY, Somotherman M. Doppler-shift compensation behavior in horseshoe bat revisited: Auditory feedback controls both a decrease and an increase in call frequency[J]. The Journal of Experimental Biology,2002,205:1 607.
9 Russell IJ, Drexl M, Foeller E,et al. Synchronization of a nonlinear oscillator: Processing the of component of the echo-response signal in the cochlea of the mustached bat[J]. J Neurosci,2003,23:9 508.
10 Kim SY, Allen R, Rowan D. The simulation of bat-oriented auditory processing using the experimental data of echolocating signals[J]. Acoustic,2008:5235.
11 Bruns V. Peripheral auditory tuning for fine frequency analysis by the CF-FM bat,rhinolophus ferrumequinum Ⅰ.Mechanical specializations of the cochlea[J]. J Comp PhysioI,1976,106:77.
12 Vater M,K?ssl M.Further studies on the mechanics of the cochlear partition in the mustached bat Ⅰ.Ultrastructural observations on the tectorial membrane and its attachments[J].Hearing Research,1996,94:63.
13 K?sll M.A tectorial membrane fovea in the cochlea of the mustached bat[J]. Naturwissenschaften,1996a,83:89.
14 K?ssl M,Vater M. Further studies on the mechanics of the cochlear partition in the mustached bat Ⅱ.Asecond cochlear frequency map deriver from acoustic distortion praducts[J].Hearing Research,1996,94:78.
15 K?ssl M. Sound emission from cochlear filters and foveae- does the auditory sense organ make sense[J]. Naturwissenschaften,1997,84:9.
16 Vater M, Lenoir M,Pujol R.Ultrastructure of the horseshoe bat's organ of Corti,Ⅱ.Transmission electron microscopy[J]. J Comp Neurol,1992,318:380.
17 Vater M, Lenoir M. Ultrastructure of the horseshoe bat's organ of Corti,Ⅰ.Scanning electron microcopy[J].J Comp Neurol,1992,318:367.
18 K?ssl M, Vater M. Consequences of outer hair cell damage for otoacoustic emissions and audio-vocal feedback in the mustached bat[J].JARO, 2000,1:300.
19 閆利英,李勝利,李白芽,等.蝙蝠耳蝸Corti器的電子顯微鏡觀察[J].中華耳科學雜志,2007,5:202.
20 趙謙,李勝利 ,閆利英,等.蹄蝠聽性腦干誘發電位特點分析[J].中華耳科學雜志,2009,7:60.
21 王婉瑩,邰發道. 中國蝙蝠聽覺和回聲定位研究進展[J].陜西師范大學學報(自然科學版),2006,34:121.
22 羅峰,李安安,吳飛健,等.菲菊頭蝠的下丘神經元基本聲發聲特性[J].動物學報,2006,27:202.
23 Bruns V. Peripheral auditory tuning for fine frequency analysis by the F-FM bat, rhinolophus ferrumequinum.II. Frequency mapping in the cochlea[J]. J Comp Physio I,1976,106:87.
24 Cover E. Neurobiological specializations in echolocating bats[J]. Anat Res,2005,287A:1 103.
25 Bruns V, Goldbach M. Hair cells and tectorial membrance in the cochlea of the greater Horseshoe bat[J].Anat. Embryol,1980,161:51.
26 Wada H, Usukwa H, Takerchi S. Distribution of protein motors along the lateral wall of the outer hair cell[J]. Hearing Research,2001,162:10.
27 Reuter G,K?ssl M, Hemmert SW,et al.Electromotility of outer hair cells from the cochlea of the echolocating bat,carollia perspicillata[J].J Comp Physiol A , 1994, 175:449.
28 Dallos P, Evans BN, Hallworth R. Nature of the motor element in electrokinetic shape changes of cochlear outer hair cells[J]. Nature, 1991,350:155.
29 Zheng J, Shen WX, David Z,et al. Prestin is the motor protein of cochlear outer hair cells[J]. Nature,2000,405:149.
30 Chertoff ME,Brownell WE. Characterization of cochlear outer hair cell turgor[J]. Am J Physiol Cell Physiol,1994,266:C467.
31 Nakagawa T, Oghalai JS, Saggau P. Photometric recording of transmembrane potential in outer hair cells[J]. Journal of Neural Engineering, 2006,3:79.
32 Frolenkov GI. Regulation of electromotility in the cochlear outer hair cell[J]. J Physiol, 2006,576:43.
33 Zhiwei Li, Anvari B, Takashima M,et al. Membrane tether formation from outer hair cells with optical tweezcrs[J]. Biophysical Journal, 2002,82:1 386.
34 Ren TY. Reverse propagation of sound in the gerbil cochlea[J]. Nature Neuroscience, 2004,7:333.
35 He WX, Ren TY. Backward propagation of otoacoustic emissions[J]. Journal of Otology, 2006,1:40.
36 He WX, Fridberger A, Porsov E,et al. Reverse wave propagation in the cochlea[J]. PNAS, 2008,105:2 729.
37 Ren TY, He WX, Scott M,et al. Group delay of acoustic emissions in the ear[J]. J Neurophysiol, 2006, 96:2 785.
38 Ren TY, Nuttal AL. Cochlear compression: An implication of the Allen-Fahey experiment(L)[J]. J Acoust Soc AM, 2006,119:1 940.
39 任田英.聲波在耳蝸內的逆行傳導機制[J].西安交通大學學報(醫學版),2009,30:261.
40 王緒中,胡開良,韋力,等.大蹄蝠多普勒正負補償效應的聲波特征與比較[J].動物學研究,2010,31:663.

