結腸癌手術對腸道菌群微生態的影響
郭世奎, 王昆華, 龔昆梅, 肖 樂, 包維民, 雷 毅, 師 義
結腸癌手術是腹部外科最常施行的術式之一,了解結腸癌患者術前腸道菌群狀況和腸道準備及手術創傷對腸道菌群的影響,對指導臨床治療具有重要意義。本研究應用實時熒光定量PCR技術對結腸癌患者手術前后糞便菌群中的擬桿菌屬、梭桿菌屬、梭菌屬、脆弱擬桿菌、壞死梭桿菌、肉毒梭菌和艱難梭菌進行定量分析,比較結腸癌患者手術前后腸道菌群的差異,揭示結腸癌手術處理對腸道相關菌群微生態的影響,為臨床治療提供理論依據。
1 資料與方法
1.1 臨床資料
2008年10月至2010年10月我科共收治結腸癌患者60例,男38例,女22例;年齡(65.0±16.4)歲,所有患者均于結腸鏡下取材行病理檢查證實為結腸癌,其中右半結腸癌21例,左半結腸癌39例,術前均無腸梗阻、腸穿孔及腸炎,無嚴重全身性疾病等并發癥或伴發病,均未行放化療。所有患者術前1周停用抗生素,術前1天口服復方聚乙二醇電解質散進行腸道準備。手術方式為結腸癌根治術。分別于術前3天和術后停用抗生素7日并恢復飲食后留取標本。
1.2 引物的設計與合成
梭菌屬參照Skanseng等的報道[1],梭桿菌屬參照Kato等的報道[2],肉毒梭菌參照Fach等的報道[3],壞死梭桿菌參照Jensen等的報道[4],艱難梭菌參照Denève等的報道[5]。擬桿菌屬根據其cfxA基因,脆弱擬桿菌根據其cfiA基因系列設計引物。這7對引物用BLAST進行在線核實其特異性后,由上海生工生物工程技術服務有限公司合成,引物系列見表1。

表1 細菌的PCR擴增引物系列
1.3 試劑與儀器
試劑為細菌基因組DNA提取試劑盒(離心柱型),普通DNA產物純化試劑盒(離心柱型),Real Master Mix(SYBR Green I),瓊脂糖,DNA提取液,DNA分子標準Marker,TaqDNA多聚酶。儀器為Hfsafe-1200TE全排型生物安全柜,超凈工作臺,低溫高速離心機,純水器,移液器,核酸蛋白檢測儀Biophotmeter,溫度梯度PCR擴增儀,定量Light Cycler PCR儀。
1.4 糞便細菌DNA的提取
分別于術前3天和術后停用抗生素7日并恢復飲食后取新鮮糞便,用天平稱取中段,每份500 mg,收集在標本袋中,置于冰上,取回實驗室后-4℃冰箱保存,時間不超過1 h。預處理后,按細菌基因組DNA提取試劑盒說明,提取糞便細菌DNA,-20℃保存備用。
1.5 常規PCR反應
反應體系25 μL:10×Buffer 2.5 μL,MgCl22.5 μL,dNTP 1 μL,上、下游引物各1 μL,Taq酶(2.5U/μL) 0.4 μL,模板DNA 2.0 μL,ddH2O 15 μL。95 ℃,預變性5 min,95 ℃變性20 s,擬桿菌屬57 ℃、梭桿菌屬58 ℃、梭菌屬59 ℃、脆弱類桿菌60 ℃、壞死梭桿菌60 ℃、肉毒梭菌61 ℃、艱難梭菌61 ℃退火30 s,72 ℃延伸1 min,循環40次,72 ℃后延伸5 min,-4 ℃保存。取PCR反應產物6 μL與溴酚藍2.5 μL混勻上樣,將2.0% 瓊脂糖凝膠放入1×TAE緩沖液中進行電泳,電壓60 V,時間90 min,電泳結束后用凝膠成像分析系統攝像。
1.6 實時熒光定量PCR反應
將待測糞便樣品中提取的DNA分別進行7種細菌的SYBR Green I 實時熒光定量PCR反應,反應體系:Real Master Mix:9 μL,上、下游引物各1 μL,模板DNA 2.0 μL,ddH2O 7 μL,反應體積為20 μL,最后加石蠟油 8 μL封帽。反應條件:95 ℃,預變性2 min,循環1次;定量程序:95 ℃變性20 s,擬桿菌屬57 ℃、梭桿菌屬58 ℃、梭菌屬59 ℃、脆弱類桿菌60 ℃、壞死梭桿菌60 ℃、肉毒梭菌61 ℃、艱難梭菌61 ℃退火10 s,68 ℃ 延伸30 s,循環40次;74 ℃,30 s,循環1次,每次實驗同時設標準品校正和ddH2O代替DNA模板作為陰性對照,反應完畢后根據溶解曲線分析PCR產物的特異性,并由Light Cycler PCR儀分析定量結果。
1.7 標準曲線的制作
取糞便基因組DNA用擬桿菌屬,梭桿菌屬,梭菌屬,脆弱擬桿菌,壞死梭桿菌,肉毒梭菌,艱難梭菌引物進行特異性擴增,將出現目的條帶的擴增產物按普通DNA產物純化試劑盒說明進行純化,純化產物用核酸蛋白檢測儀Biophotmeter測定濃度,并將其換算為各標準品1 μL的拷貝數,即等于6.02×1023×濃度(g/mL)/分子量(g/mol),其中分子量(g/mol)=擴增片段長度×660,(擬桿菌屬3.95×1014,梭桿菌屬5.16×1014,梭菌屬2.02×1014,脆弱擬桿菌3.76×1014,壞死梭桿菌1.9×1014,肉毒梭菌3.77×1014,艱難梭菌3.62×1014)用于制作標準曲線。將各純化產物做10倍系列稀釋,使之成為(1×108~1×104)copies/mL,作為標準品,進行SYBR Green I 實時熒光定量PCR反應。根據讀取的熒光數據,由系統軟件自動分析循環閾值(Cycle threshold, Ct),并生成標準曲線。
1.8 統計學分析
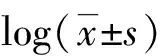
2 結果
2.1 引物特異性檢測
用2%瓊脂糖凝膠電泳分析常規PCR產物,以Marker為標準。可見常規PCR產物均顯示特異性條帶,與預期的DNA片段長度相吻合(見圖1)。
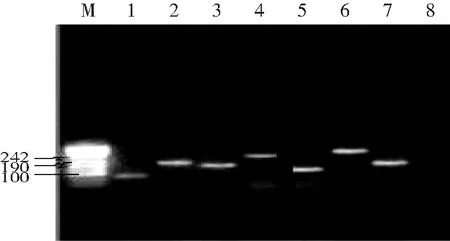
圖1 PCR產物凝膠電泳圖
2.2 擴增曲線
不同拷貝數的模板循環數與熒光強度的關系圖見圖2(以梭菌屬為例),從圖中可以看出梭菌屬不同拷貝數的模板隨循環數的增加,熒光強度逐漸增強,在經過一段指數擴增期后曲線趨于平行,即出現“平臺效應”,其定量分析在指數擴增期進行。其他幾種細菌也同上。
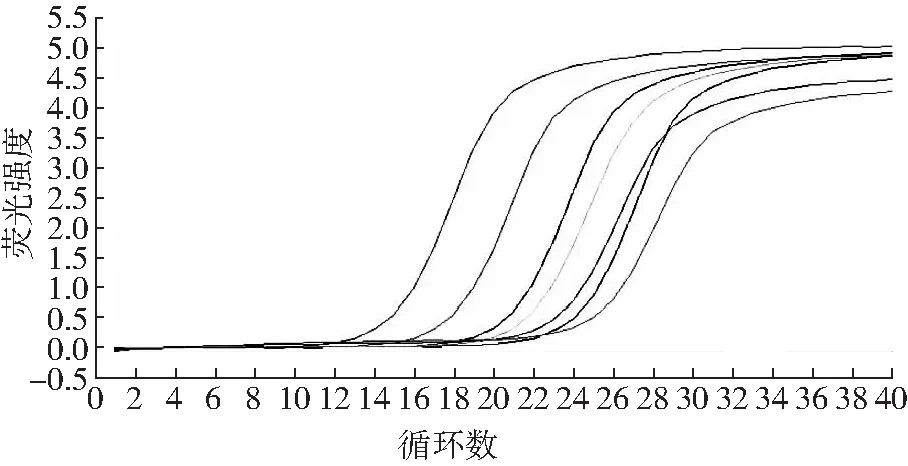
圖2 7份術前標本梭菌屬PCR擴增曲線圖(顯示熒光強度與循環數的關系)
2.3 標準曲線
以對數轉換后的拷貝數為橫坐標,以定量PCR反應過程中達到熒光閾值的初始循環數為縱坐標得到各細菌的標準曲線(見圖3),為待測樣品的定量提供了參照標準。
2.4 溶解曲線
通過對溶解曲線的分析,進一步驗證引物的特異性。7種細菌的溶解曲線均為單峰,說明擴增產物單一,以梭菌屬為例,與SYBR Green Ⅰ熒光染料結合的為目的DNA片段,見圖4。
2.5 PCR擴增產物純化獲得DNA測序結果
測序所得系列與梭菌屬基因系列完全一致。說明擴增產物是梭菌屬,引物特異性高(見圖5)。
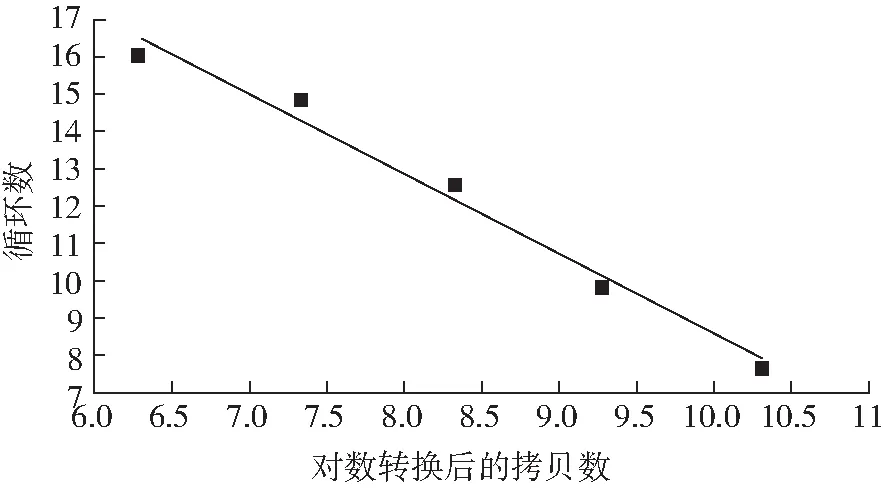
圖3 術前標本梭菌屬的標準曲線圖(取104、105、106、107、108制做標準曲線)
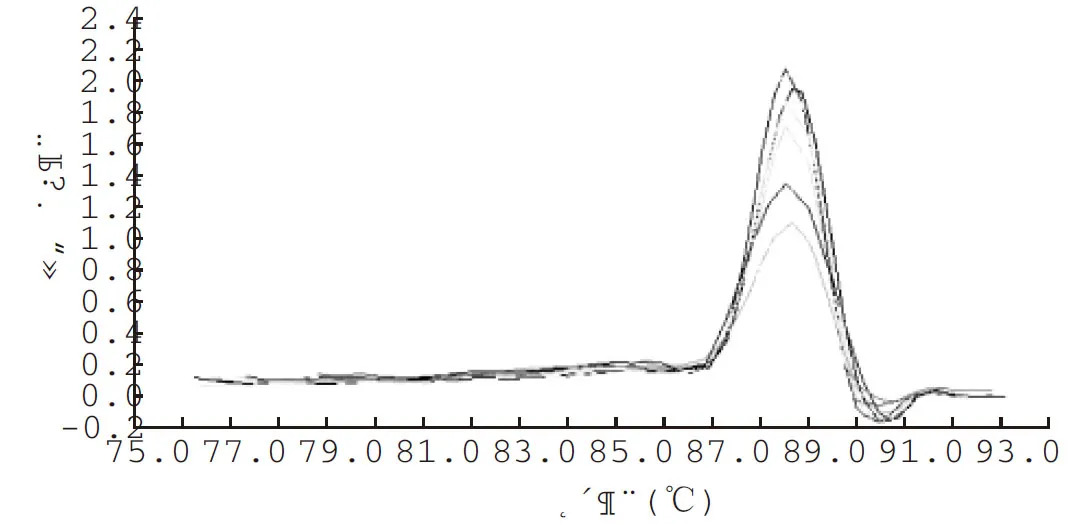
圖4 7份術前標本梭菌屬的溶解曲線,顯示產物TM值為88.01℃~89.05℃時引物的特異性好
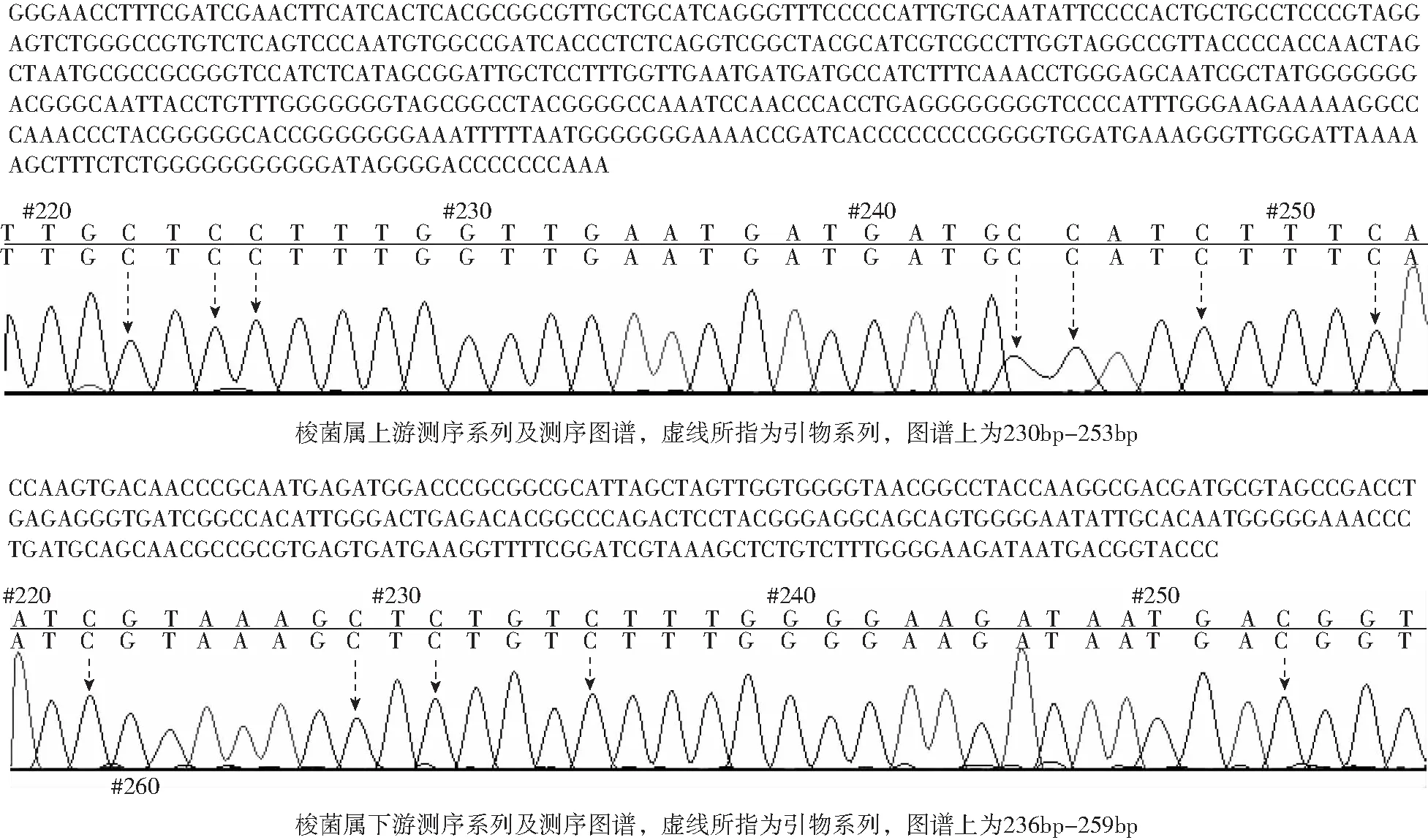
圖5 梭菌屬擴增產物純化獲得DNA測序結果
2.6 糞便的細菌定量結果
每份糞便標本所含的7種細菌的拷貝數可通過Ct值與標準品的標準曲線比較得到。結腸癌患者術后糞便中的擬桿菌屬、梭桿菌屬及梭菌屬及脆弱擬桿菌、壞死梭桿菌、肉毒梭菌及艱難梭菌數量均較術前明顯減少,見表2。

表2 糞便標本細菌定量的結果
注:結腸癌(n=60)手術前、后的比較,用配對t檢驗,檢測7種細菌差異均有統計學意義(P<0.05)
3 討論
結腸癌是人類常見的惡性腫瘤,人類消化道內約有1014個活細菌,占正常成人糞便重量的60%[6],由30個屬400~500種細菌組成[7]。腸道中細菌的組成、數量及活性,在維持人體健康中起重要作用[8]。本研究通過對結腸癌患者手術前后腸道中的擬桿菌屬、梭桿菌屬、梭菌屬、脆弱擬桿菌、壞死梭桿菌、肉毒梭菌及艱難梭菌進行定量分析,以了解手術前后結腸癌患者糞便菌群的主要變化。結果顯示,結腸癌患者糞便中擬桿菌屬、梭桿菌屬、梭菌屬、脆弱擬桿菌、壞死梭桿菌、肉毒梭菌及艱難梭菌的數量在手術后均有明顯減少,與手術前比較差異有統計學意義(P<0.05)。有研究顯示結腸癌患者腸道菌群出現微生態量的變化可能與結腸癌的復發、發展有關,但機制不明[9],并且腸道菌群改變時,腸道細菌及其代謝產物作用于基因易感性宿主,使之產生免疫應答,三者在腸癌的開始和持續發展中起到了重要的協同作用[10]。本研究與Tannock[11]的研究一致,與我們前期研究[12]亦一致。因此,根據所確立的患者具體的腸道菌群量的變化,為結腸癌的預防及診治提供了新視角,并通過檢測腸道菌群改變,進行篩查,確定結腸癌高危人群,行飲食干預及相關檢查,達到早期診斷,早期治療的目的。
本研究對于揭示手術處理對腸道菌群的影響,為結腸癌患者術后臨床營養支持和相關處理的選擇,尋找結腸癌術后最佳治療方案,以及個體化治療提供了理論依據和指導意義。
總之,本研究應用實時熒光定量PCR技術,實現了對擬桿菌屬、梭桿菌屬、梭菌屬、脆弱擬桿菌、壞死梭桿菌、肉毒梭菌及艱難梭菌等難培養的腸道細菌進行定量分析,發現結腸癌患者術后上述細菌明顯減少,提示結腸癌手術處理對腸道菌群有一定的影響,為圍手術期的腸道菌群調理及術后營養支持提供了理論依據[13]。同時,應用實時熒光定量PCR技術為結腸癌患者腸道菌群組成,動態變化及相關的研究提供了一種有效檢測手段,為臨床診治結腸癌患者術后腸道菌群失調提供新的視角。
參考文獻:
[1]Skanseng B,Kaldhusdal M,Rudi K. Comparison of chicken gut colonisation by the pathogens Campylobacter jejuni and Clostridium perfringens by real-time quantitative PCR[J]. Molecular and Cellular Probes, 2006, 20(5): 269-279.
[2]Kato H, Yoshida A, Awano S, et al. Quantitative detection of volatile sulfur compound-producing microorganisms in oral specimens using real-time PCR[J]. Oral Dis, 2005, 11 (S1): 67-71.
[3]Fach P, Micheau P, Mazuet C, et al. Development of real-time PCR tests for detecting botulinum neurotoxins A, B, E, F producing Clostridium botulinum, Clostridium baratii and Clostridium butyricum[J]. J Appl Microbiol, 2009, 107(2): 465-473.
[5]Denève C, Deloménie C, Barc MC, et al. Antibiotics involved in Clostridium difficile-associated disease increase colonization factor gene expression[J]. J Med Microbiol, 2008, 57(Pt6): 732-738.
[6]Sghir A,Gramet G,Suau A,et a1.Quantification of bacterial groups within human fecal flora by oligonucleotide probe hybridization[J]. Appl Environ Microbiol, 2000, 66(5): 2263-2266.
[7]吳承堂,譚建美. 大腸癌術后腸道菌群變化的臨床研究[J]. 中華普通外科雜志,2004,l9(6): 334-336.
[8]Ravva SV, Stanker LH. Real-time quantitative PCR detection of Mycobacterium avium subsp. paratuberculosis and differentiation from other mycobacteria using SYBR Green and TaqMan assays[J]. J Microbiol Methods, 2005, 63(3): 305-317.
[9]Rafter J, Bennett M, Caderni G, et a1. Dietary synbiotics reduce cancer risk factors in polypectomized and colon cancer patients[J].Am J Clin Nutr, 2007, 85(2): 488-496.
[10]Rescigno M. The Pathogenic Role of Intestinal Flora in IBD and Colon Cancer[J]. Current Drug Targets, 2008, 9(5): 395-403.
[11]Tannock GW. Molecular methods for exploring the intestinal ecosystem[J]. Br J Nutr, 2002, 87( suppl 2): S199-201.
[12]郭世奎,龔昆梅,包維民,等. SYBR Green I實時熒光定量PCR法分析結直腸癌患者腸道菌群變化[J]. 中國普外基礎與臨床,2010, 17(5):463-468.
[13]郭世奎,包維民,龔昆梅,等. 手術處理對結直腸癌患者腸道菌群變化的臨床研究[J]. 結直腸肛門外科雜志,2010,16(4):201-206.

