16α,17α-環氧黃體酮C11β-羥基化微生物的選育
吳定偉 王麗婭 陳小龍 萬建峰
(1浙江仙琚制藥股份有限公司,浙江 仙居 317300;2浙江工業大學生物與環境工程學院,浙江 杭州 310014;3浙江經貿職業技術學院應用工程系,浙江 杭州 310018)
甾體類化合物都具有環戊烷并多氫菲結構,常見的如甾體激素黃體酮、睪酮,以及內源性物質膽固醇[1]。人們對甾體化合物的研究已經開展數十年,發現其對糖代謝、脂肪代謝、蛋白質合成、礦物質合成以及性功能和神經調節等都具有重要的生理功能,目前已經有幾十種上市的甾體藥物,其治療領域包括抗炎、抗過敏、降壓、避孕、增強抵抗力和抗腫瘤等[2-3]。
在上市的甾體藥物中,糖皮質激素類藥物臨床應用最為廣泛,是最為重要的甾體類藥物。它們具有強大的抗炎活性,適用于各種炎癥,過敏性疾病和休克等危重疾病,其結構中11-β羥基是化合物產生抗炎活性的關鍵藥效片段。由于甾體結構的特點,采用化學方法進行11-β羥基化反應費時、費力,且很難保證11位羥基的β構型。而采用微生物轉化法卻能選擇性的在甾體的11位引入羥基,迄今為止,已經相繼發現具有甾體羥化作用的細菌、放線菌、真菌、霉菌等。其中國內大多數甾體生產企業采用藍色犁頭霉進行11-羥化反應,但是仍存在選擇性較差,易產生11-α羥化產物以及其他位置羥化產物,收率在45%左右[4-6]。另外也有文獻報道采用新月彎孢霉、黑根霉等菌種進行微生物轉化,收率也僅有一定幅度的提高,達到50%左右。因此,有必要進一步對多個菌種進行篩選和培育,力求獲得高效11β-羥基化沃氏氧化物的微生物菌株。本論文采用紫外誘變、低能氮離子注入誘變和鈷-60誘變這3種國內外常用方法對菌種施行多樣化的選育操作[7-10]。
1 材料與方法
1.1 材料
1.1.1 菌種
雅致小克銀漢霉Cunningnamella elegans(編號40250),購自北京微生物菌種保藏中心,其他菌種均來自浙江仙琚制藥股份有限公司。
1.1.2 基礎培養基
葡萄糖3%,玉米漿3.5%,(NH4)2SO40.5%,酵母粉0.25%,玉米油0.1%。
1.1.3 主要設備和試劑
高效液相色譜儀,日本島津公司生產的LC-10A。鈷-60誘變在浙江省農科院進行。低能氮離子注入誘變在浙江工業大學進行。沃氏氧化物、11β-羥基-16α,17α-環氧孕酮和11α-羥基-16α,17α-環氧孕酮霉菌氧化物由浙江仙琚制藥股份有限公司提供。高效液相色譜用甲醇和乙腈為色譜級,其他試劑均為分析純。
1.2 分析方法
1.2.1 菌懸液的pH測定及菌體重量測定
將矯正好的pH電極放入被測菌懸液中,等讀數穩定后讀取顯示器上的數字即為該菌液的pH值。將搖床培養48h后的菌懸液抽濾,稱量菌體重量,記為W濕,然后將其放入烘箱里烘至恒重,取出稱量記為W干。
1.2.2 轉化底物和產物檢測
采用HPLC法分析轉化底物和產物。色譜條件:C18反相色譜柱,流動相:乙腈:水=60:40,檢測波長:245nm,流速:1.5mL/min,進樣量:10μL。
1.3 實驗方法
1.3.1 土豆培養基和基礎培養基的配制
斜面培養基:PDA培養基。基礎培養基:葡萄糖3%、玉米漿3%、(NH4)2SO40.5%、酵母粉0.25%,FeSO40.01%和玉米油0.1%,培養基經121℃滅菌20min,備用。
1.3.2 菌種活化
菌種轉接到PDA斜面,在28℃下培養3d。
1.3.3 底物投料
稱取6g沃氏氧化物,3.6g β-環糊精及少量吐溫80,溶于60mL的水中,在加熱條件下充分攪拌。用移液管吸取5mL的底物溶液加入已經培養22h的搖瓶中,繼續培養48h進行羥化反應。
1.3.4 發酵液的預處理將發酵轉化后得到的發酵液混合物先測其pH值,然后過濾去除上清液,取0.1g濕菌絲體,其余稱量濕重W濕,然后放入烘箱里80℃下干燥并稱其重W干。在0.1g濕菌絲體中用5mL的乙酸乙酯在密封條件下萃取30min。離心后取萃取液1mL于EP管中,用吹風機吹干,再加入1mL的分析純甲醇,震蕩溶解5min,冰箱保存待檢測。
1.3.5 誘變方法
1.3.5.1 紫外誘變
將200μL菌懸液(或加入底物)接入培養皿,啟動磁力攪拌器,使用20W功率紫外燈管,照射距離為15cm。實驗誘變時間分別設定為30s和60s,處理過程在暗室操作。處理完畢后,將盛菌懸液的器皿用密封紙盒包起來培養,最后放入25℃恒溫培養箱內培養2~3d,期間觀察菌體長勢,然后再進行分離篩選。
1.3.5.2 低能氮離子注入誘變
吸取200μL的孢子液涂到無菌玻璃平皿上,同時用一個平皿進行真空處理對照,另一個平皿做外環境對照。用涂棒涂勻,放在無菌操作臺上吹干后,再置于離子束裝置靶室,分別用20keV的氮離子(N+)照射處理,劑量為90s、120s、150s(離子束單位為×2.6×1013ions/cm2·s),選取大劑量240s和300s做參照。
1.3.5.3 鈷-60誘變
選定5個照射的劑量:1000,1200,1400,1600和1800keV進行Co-60誘變,將誘變的菌懸液稀釋成5個梯度,稀釋后的菌懸液注入25個培養皿中,使用土豆培養基,最后放入恒溫箱內培養。
2 結果與討論
2.1不同微生物菌株轉化能力的比較

表1 不同微生物菌株轉化能力的比較
從表1中可以發現S 418黑根霉發酵產物中不含有11β-沃氏物,而11α-沃氏物的含量很高,結果與文獻數據相符,驗證了S 418黑根霉能提高產物11α位點的轉化率,11β位點基本不發生反應。新月彎孢霉X1和X2的發酵產物中都不含有11β-沃氏物,這與國外的研究成果不相符,通過觀察活化的菌種發現其形態和顏色與文獻中的描述不相同(重復活化情況仍相同),懷疑菌種可能已經退化或者染菌,后期實驗放棄使用。藍色犁頭霉D1、D2、D5的底物轉化率偏低,同時產物中不含有11β-沃氏物,藍色犁頭霉和銀漢霉的發酵產物與其他5種菌相比含11β-沃氏物但含量偏低。
2.2 紫外誘變育種

表2 紫外誘變藍色犁頭霉
表2顯示轉化率沒有明顯的提高,致死率基本都達到了90%以上,可能是照射時間不夠,只有2個菌株的產率高于初始數據,正變率為16.7%,產量提升僅為15%。
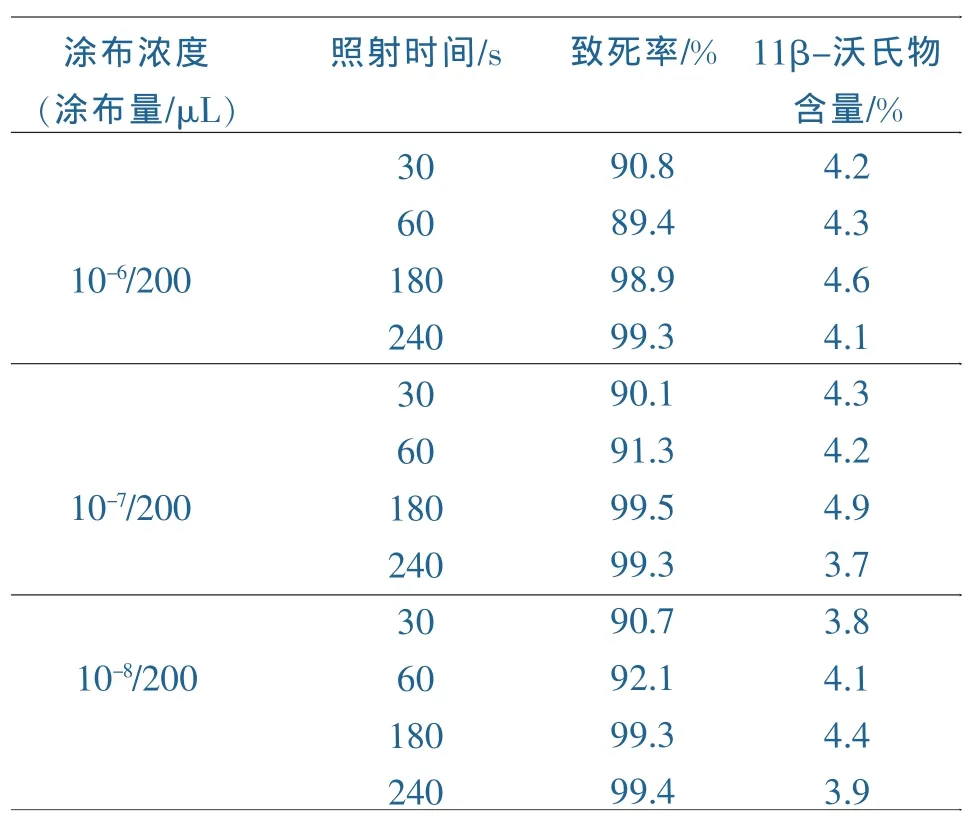
表3 紫外誘變銀漢霉
而表3中顯示轉化率有一定波動幅度,一些產率提高了20%,在大劑量240s均發現產率出現了下降,采用相同方式再進行一次操作得出類似的結果。表明在大劑量誘變的情況下,正突變頻率并沒有增加,正變率僅為8.7%,同時產率浮動較大。通過多次的誘變發現,銀漢霉的誘變菌株相比藍色犁頭霉誘變株產率提升較大,但是11β-沃氏物含量仍然停留在5%左右,與文獻中40%~45%的轉化率有很大差距。如果進一步增加照射時間有又會對菌種造成損害,同時也無法保證產率能獲得質的提升。
2.3 低能氮離子注入誘變育種
從表4可看出,在20keV的能量、90s~150s的劑量范圍內,銀漢霉的致死率并沒有一直隨著照射劑量的增加而上升,而是隨著氮離子(N+)照射劑量的加大先增大后降低,同期實驗獲得的結果相同,這是因為用離子束照射處理微生物可能產生先降后升再降的"馬鞍型"存活曲線。從表中可以看出,菌種誘變結果大部分為正常范圍或正變,產率提高了20%~40%,正變率達15.6%。通過加大劑量又會導致菌體無法生長,選擇在低劑量的范圍比較合適,在20keV的能量下,劑量90s和120s時的正變率最高,最高含量達到5.8%。

表4 低能氮離子注入誘變銀漢霉
2.4 鈷-60誘變育種

表5 鈷-60誘變銀漢霉
從表5中看出,菌種誘變結果大部分為正常范圍或負變,正變率依舊為0。隨著照射劑量的增加產率并沒有明顯的變化,同時獲得的單菌落數量偏少。考慮Co-60誘變是一種破壞性較強的誘變過程,在照射時對銀漢霉菌體造成了不可恢復的影響。
4 結論
以保藏菌株土曲霉藍色梨頭霉(Absidia coerulea)40302和雅致小克銀漢霉(Cunni ngnamella elegans)40250為出發菌株,經等離子注入、紫外線、Co-60等方法對菌種進行篩選。通過比對4種實驗方法發現,化學誘變方法與Co-60誘變導致菌體發生負突變的幾率較大,經紫外誘變處理后的結果基本處于正常范圍,等離子注入誘變的正突變率最高。經等離子注入誘變處理篩選后,條件為照射劑量20keV,照射時間90s,獲得一株性能穩定的銀漢霉突變株,28℃搖瓶發酵22h,48h后投料,C11β-羥基-16α,17α-環氧孕酮的轉化率達到5.8%,相比最初的轉化率提高了30%。說明采用等離子注入誘變方法是有效的。
[1]Wu J P,Pan B X,Yuan F.Intraarticular Injection with Diprospan in Treating the Rheumatoid Arthritis[J].Clin Med Engin,2010,17(2):113-114.
[2]Lotti T,Buqqiani G,Troiano M,et al.Targeted and combination treatments for vitiligo Comparative evaluation of different currentmodalities in 458 subjects[J].Dermatol Ther,2008,21(1):20-26.
[3]Arthan D,SvastiJ,Kittakoop P,etal.Antiviral isoflavonodisulfate and steroidal glycosides from the fruits of Solanum turvum[J].Phytochemistry,2002,59:459-63.
[4]張天智,楊炯,楊順楷,等.微生物轉化在甾體激素工業生產中的應用[J].工業微生物,1987,17(1):26-33.
[5]曾本秀,陳樹群,陳伯林.提高甾體微生物11β-羥基化的酶活性[J].中國醫藥工業雜志,1993,24(12):529-532.
[6]林新國,周才賦.梨頭霉菌生產11β-羥基化化合物RS-21醋酸酯的研究[J].化學反應工程工藝,1995,11(2):213-216.
[7]黃淑惠,徐詩偉,法幼華.用新月彎飽霉11β-羚基化16a-甲基化合物RS-21-醋酸酯[J].微生物學報,1989,29(1):68-71.
[8]Chen K,Tong W Y,Wei D Z,et al.The 11βhydroxylation of 16,17α-epoxy progesterone and the purification of the 11β-hydroxylase from Absidia coerulea IBL02[J].East China University of Science and Technology,2004,1:46-78.
[9]王敏,路福平,蔣岳,等.新月彎飽霉原生質體的形成與11β-羥基化反應[J].微生物學雜志,2000,20(3):36-37.
[10]杜連祥,王敏,王賡,等.轉化RSA為氫化可的松的新月彎抱霉篩選[J].微生物學通報,2001,28(1):44-48.

