異型流感病毒感染小鼠肺細(xì)胞因子水平變化
郭志華,牛術(shù)孟,金 紅
(中國(guó)醫(yī)科大學(xué)基礎(chǔ)醫(yī)學(xué)院病原生物學(xué)教研室,遼寧沈陽(yáng) 110001)
流行性感冒(簡(jiǎn)稱流感)病毒是一種能引起急性呼吸道疾病的病毒,流感傳播快、潛伏期短、發(fā)病率高,引起人和動(dòng)物高的發(fā)病率和病死率[1],尤其是2009年發(fā)生的甲型H1N1流感再次引起全球關(guān)注[2-3]。目前,流感尚無(wú)特效治療方法,安全有效的疫苗是降低流感發(fā)病率和病死率,減少大規(guī)模流行的最重要的方法之一[4]。所有目前使用疫苗的共同特點(diǎn)之一是直接誘導(dǎo)針對(duì)病毒膜蛋白血凝素(hemagglutinin,HA)產(chǎn)生中和抗體,達(dá)到預(yù)防同型流感病毒的目的。雖然這些疫苗的應(yīng)用對(duì)人群起到保護(hù)作用,但是由于HA經(jīng)常發(fā)生抗原變異,此類疫苗不能防御變異株感染。到目前為止尚無(wú)有效的抗異型流感病毒感染疫苗。有研究人員已開始考慮通過(guò)提高適應(yīng)性細(xì)胞免疫應(yīng)答的方法,達(dá)到預(yù)防異型流感病毒感染的目的,但首先應(yīng)弄清其防御機(jī)制,對(duì)此目前尚無(wú)統(tǒng)一結(jié)論。本研究首先用一種流感病毒疫苗免疫小鼠,然后分別感染同型、異型流感病毒,研究異型病毒感染前后小鼠肺組織內(nèi)IFN-γ、 IL-2、 IL-4、 IL-10細(xì)胞因子水平變化,研究機(jī)體對(duì)異型流感病毒感染交叉免疫保護(hù)作用的機(jī)制,為制備能夠抵御不同型別流感病毒感染的疫苗奠定基礎(chǔ)。
1 材料與方法
1.1 材料
1.1.1 動(dòng)物 6~8周齡SPF級(jí)BALB/c小鼠,雌性,由中國(guó)醫(yī)科大學(xué)實(shí)驗(yàn)動(dòng)物部提供。
1.1.2 病毒 A/FM/47(H1N1)流感病毒株,由中國(guó)醫(yī)科大學(xué)病原生物學(xué)實(shí)驗(yàn)室提供,用前進(jìn)行病毒滴定。
1.1.3 主要試劑 水合氯醛、PBS(中國(guó)醫(yī)科大學(xué)病原生物學(xué)教研室提供);H5N1流感病毒疫苗(哈爾濱維科生物技術(shù)開發(fā)公司),重組鼠 IL-2(Pepro-Tech);細(xì)胞因子Elisa試劑盒(武漢博士德生物工程有限公司,凱基生物科技發(fā)展有限公司)。
1.1.4 主要儀器 CO2培養(yǎng)箱(香港力康發(fā)展有限公司,型號(hào)HF90);酶標(biāo)儀(Inte rMed NJ-2100)。
1.2 方法
1.2.1 感染病毒滴度測(cè)定 將H1N1病毒儲(chǔ)存液用PBS溶液進(jìn)行10倍等比稀釋(10-1~10-10),把各稀釋液分別接種于9日齡雞胚尿囊腔中,每個(gè)稀釋度需要4枚雞胚,37℃5%CO2培養(yǎng)箱培養(yǎng)2~3 d,每天檢查雞胚生長(zhǎng)情況,24 h內(nèi)死亡的雞胚,認(rèn)為是非特異死亡應(yīng)棄去。根據(jù)Reed-Muench方法,計(jì)算雞胚半數(shù)感染量(50%egg infectious dose,E ID50),E ID50為104.8。
1.2.2 動(dòng)物分組 取上述小鼠50只,隨機(jī)分為實(shí)驗(yàn)組和對(duì)照組,實(shí)驗(yàn)1組(異型免疫組):用H5N1免疫,H1N1感染;實(shí)驗(yàn)2組(異型免疫加強(qiáng)組):用H5N1免疫, IL-2加強(qiáng)免疫,H1N1感染;對(duì)照1組(同型免疫組):用H1N1免疫,H1N1感染;對(duì)照2組(病毒感染對(duì)照組):用PBS緩沖液免疫,H1N1感染;對(duì)照3組(空白對(duì)照組):正常飼養(yǎng),不做任何處置。各組標(biāo)記后分別稱重,正常飲水食物喂養(yǎng),每日觀察記錄小鼠的活動(dòng)狀態(tài)及臨床表現(xiàn)、稱量體重。
1.2.3 免疫動(dòng)物 將各組小鼠用水合氯醛輕度麻醉,選用H5N1、H1N1疫苗或PBS液按上述分組免疫動(dòng)物,疫苗接種按說(shuō)明書進(jìn)行,每只小鼠鼻腔接種50μL。首次免疫3周后加強(qiáng)免疫1次,方法劑量同上,加強(qiáng)免疫的同時(shí)根據(jù)文獻(xiàn)[5]及試劑說(shuō)明書,實(shí)驗(yàn)2組小鼠分別經(jīng)腹腔注射活性為5×107U/mg重組鼠 IL-2 1 mL,濃度為160 U/mL。
1.2.4 感染動(dòng)物 加強(qiáng)免疫2周后,各組小鼠用水合氯醛輕度麻醉,按上述分組每只小鼠經(jīng)鼻腔感染E ID50為104.8的H1N1流感病毒100μL,正常飲食飲水飼養(yǎng),感染病毒后每天準(zhǔn)確稱量小鼠體重,觀察飲食飲水及精神狀態(tài)。
1.2.5 存活率和肺指數(shù) 小鼠感染流感病毒后觀察其存活情況,記錄每組死亡數(shù),計(jì)算各組存活率(感染后各組小鼠存活數(shù)目/感染前各組小鼠總數(shù)×100%);無(wú)菌解剖取小鼠全肺稱重,并計(jì)算肺指數(shù)(肺臟濕重/小鼠體重×100%)。
1.2.6 細(xì)胞因子測(cè)定 分別于感染前、感染7 d后無(wú)菌解剖取小鼠全肺(每組3只),按常規(guī)方法制作肺組織勻漿,4℃離心機(jī),3 000 r/min,離心10 min,取上清分裝,做好標(biāo)記,-20℃保存待測(cè)。EL ISA試劑盒測(cè)定感染前后細(xì)胞因子 IL-2、IL-4、 IL-10、IFN-γ含量,具體操作按試劑盒說(shuō)明書進(jìn)行,酶標(biāo)儀測(cè)OD450值,保存結(jié)果,計(jì)算細(xì)胞因子含量(pg/mL)。
1.2.7 統(tǒng)計(jì)學(xué)方法處理 采用SPSS 17.0軟件進(jìn)行統(tǒng)計(jì)分析,各組數(shù)據(jù)以均數(shù)±標(biāo)準(zhǔn)差(ˉχ±S)表示,用t檢驗(yàn)進(jìn)行兩兩比較,以P<0.05為差異具有統(tǒng)計(jì)學(xué)意義。
2 結(jié)果與分析
2.1 一般情況及肺指數(shù)
如圖1、圖2所示,實(shí)驗(yàn)1組(異型免疫組)感染H1N1病毒后存活率為30%~50%,體重較感染前下降,至第7天降低17.34%;實(shí)驗(yàn)2組(異型免疫加強(qiáng)組)感染病毒6 d后存活率為85.71%,至第7天體重下降15.16%;2組小鼠體溫降低,食欲欠佳,精神狀態(tài)差;對(duì)照1組(同型免疫組)全部存活,體重基本無(wú)變化;對(duì)照2組(病毒感染對(duì)照組)小鼠感染病毒1 d后全部死亡。肺指數(shù)值越大,表示肺重量增加,肺炎性病變程度嚴(yán)重;實(shí)驗(yàn)1組(異型免疫組)肺指數(shù)最大為3.29%,實(shí)驗(yàn)2組(異型免疫加強(qiáng)組)次之為2.53%,其余各組均差異不大(圖3)。結(jié)果表明,經(jīng)同型疫苗免疫的小鼠能抵抗同型流感病毒的感染,產(chǎn)生完全保護(hù)作用;對(duì)異型流感病毒感染可產(chǎn)生一定的交叉免疫保護(hù)作用,免疫增強(qiáng)劑可能起到增強(qiáng)疫苗效果的作用。
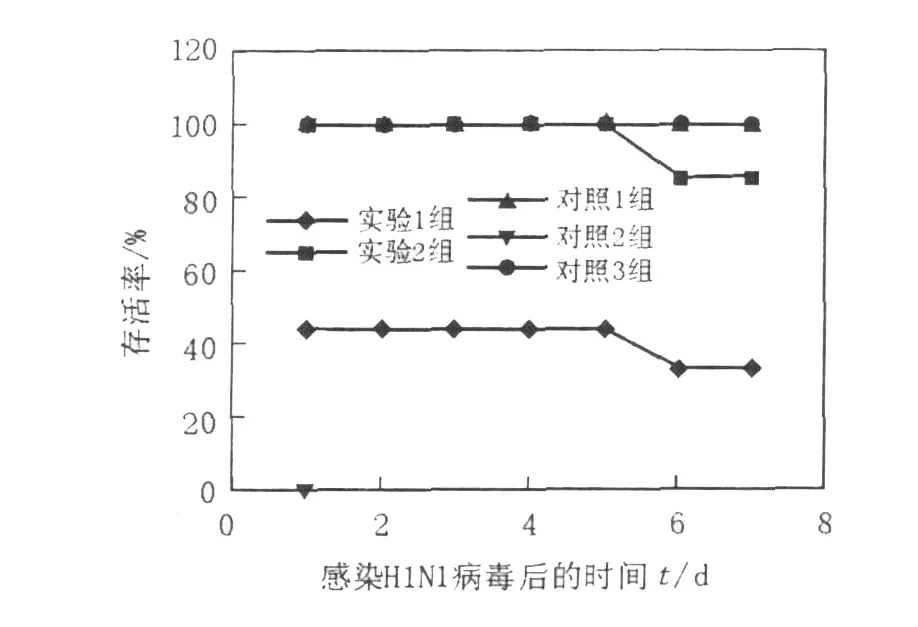
圖1 小鼠感染流感病毒后的存活率Fig.1 Survival rates of the mice after influenza virus challenge
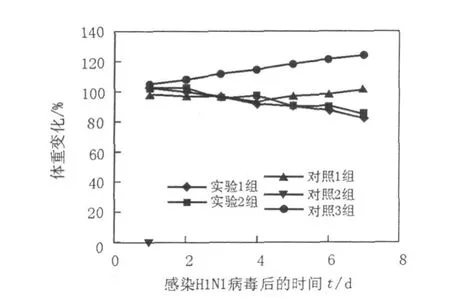
圖2 小鼠感染流感病毒后的體重變化Fig.2 Bodyweight of the mice after influenza virus challenge
2.2 Elisa試劑盒檢測(cè)細(xì)胞因子
細(xì)胞因子IFN-γ、 IL-2、 IL-4、 IL-10含量測(cè)定結(jié)果如下(圖4~7,表1、表2)。實(shí)驗(yàn)1組(異型免疫組)和實(shí)驗(yàn)2組(異型免疫加強(qiáng)組)感染病毒后細(xì)胞因子IFN-γ、 IL-10含量明顯高于感染前(P<0.05);感染病毒后實(shí)驗(yàn)1組(異型免疫組)IFN-γ、 IL-10含量高于對(duì)照1組(同型免疫組)(P<0.05),差異有統(tǒng)計(jì)學(xué)意義。
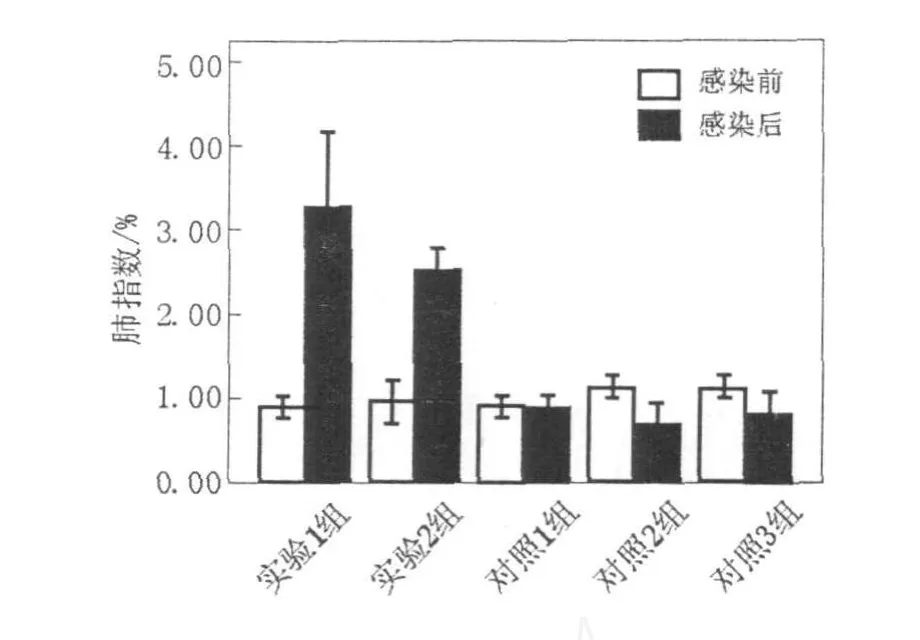
圖3 小鼠感染流感病毒前后肺指數(shù)Fig.3 The lung index of the mice before and after influenza virus challenge
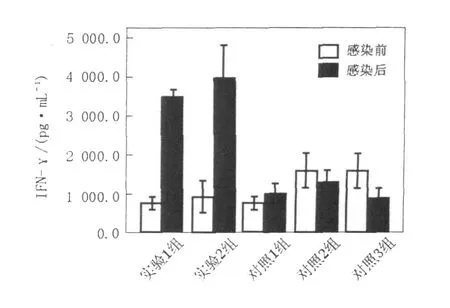
圖4 EL ISA測(cè)定細(xì)胞因子IFN-γ的濃度值(pg/mL)Fig.4 The concentration of cytokines IFN-γassayed by EL ISA(pg/mL)
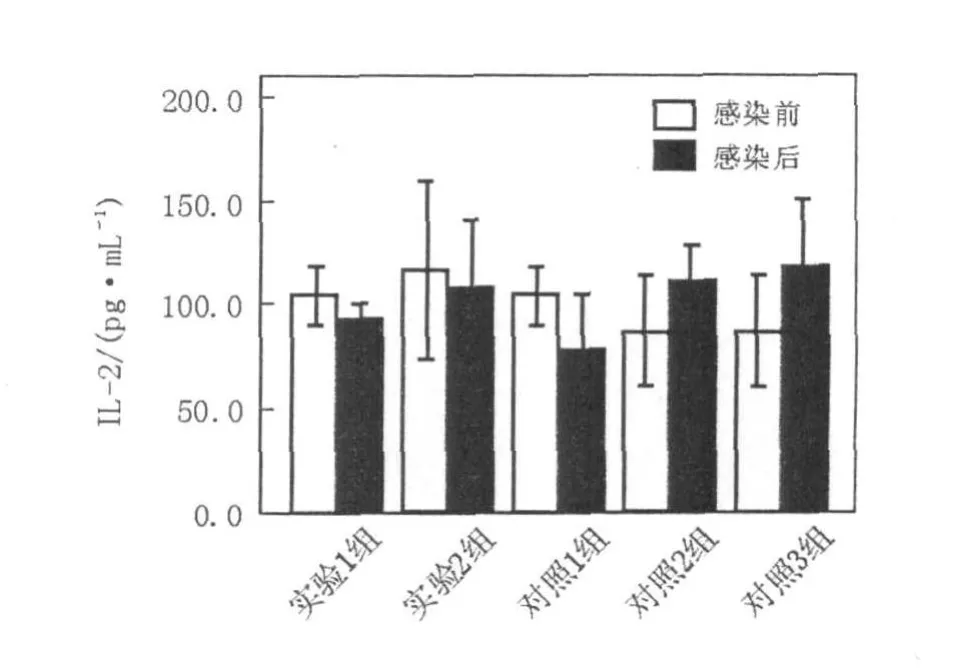
圖5 EL ISA測(cè)定細(xì)胞因子I L-2的濃度值(pg/mL)Fig.5 The concentration of cytokines IL-2 assayed by EL ISA(pg/mL)

圖6 EL ISA測(cè)定細(xì)胞因子 IL-4的濃度值(pg/mL)Fig.6 The concentration of cytokines IL-4 assayed by EL ISA(pg/mL)
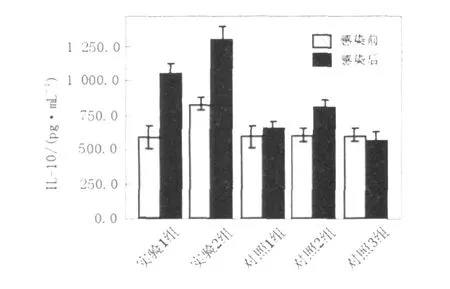
圖7 EL ISA測(cè)定細(xì)胞因子 IL-10的濃度值(pg/mL)Fig.7 The concentration of cytokines IL-10 assayed by EL ISA(pg/mL)
3 討 論
流感病毒特異性抗體,往往由流感病毒表面蛋白HA抗原刺激產(chǎn)生,特異性強(qiáng),不能中和異型流感病毒;通過(guò)提高細(xì)胞免疫的方法,達(dá)到預(yù)防異型流感病毒感染的目的,已開始受到研究者廣泛關(guān)注。目前認(rèn)為抗流感病毒細(xì)胞免疫應(yīng)答反應(yīng),是以流感病毒共有蛋白NP為主要抗原[6]。Boon等[7]認(rèn)為細(xì)胞毒性T細(xì)胞(Cytotoxic T lymphocyte,CTL)反應(yīng)在抗異型流感病毒感染中起重要作用。而Nguyen等[8]認(rèn)為記憶性B淋巴細(xì)胞與流感病毒異型間交叉保護(hù)免疫反應(yīng)密切相關(guān)。Droebner等[9]則認(rèn)為CD4+淋巴細(xì)胞介導(dǎo)了這種交叉免疫作用。亦有學(xué)者[10]通過(guò)一些手段提高宿主抵抗異型流感病毒的能力。但目前有限的報(bào)道尚無(wú)統(tǒng)一結(jié)論。研究適應(yīng)性細(xì)胞免疫應(yīng)答反應(yīng)在抗異型流感病毒感染方面的主要機(jī)制,是開發(fā)以細(xì)胞免疫機(jī)制為基礎(chǔ)的抵抗異型流感病毒感染疫苗的前提,此類疫苗可以為機(jī)體提供交叉免疫保護(hù)。
感染流感病毒后,可刺激機(jī)體產(chǎn)生多種細(xì)胞因子,小鼠CD4+輔助性T淋巴細(xì)胞(helper T cell,Th細(xì)胞)可分為Th1和Th2型細(xì)胞。Th1細(xì)胞主要分泌IFN-γ、 IL-2等細(xì)胞因子,這些細(xì)胞因子多介導(dǎo)細(xì)胞免疫;Th2細(xì)胞主要分泌 IL-4、 IL-10等細(xì)胞因子,這些細(xì)胞因子則介導(dǎo)體液免疫。
本研究首先用流感病毒疫苗免疫小鼠,然后分別感染同型、異型流感病毒,從感染病毒后小鼠的一般情況及肺指數(shù)看,實(shí)驗(yàn)1組(異型免疫組)小鼠用H5N1疫苗免疫,H1N1病毒感染6 d后存活率為33.33%,第7天體重下降17.34%,肺指數(shù)為3.29%,細(xì)胞因子IFN-γ、 IL-10含量感染病毒后明顯高于感染前(P<0.05),差異有統(tǒng)計(jì)學(xué)意義。實(shí)驗(yàn)2組(異型免疫加強(qiáng)組)小鼠用H5N1疫苗免疫,同時(shí)使用免疫增強(qiáng)劑 IL-2后感染H1N1病毒6 d后存活率為85.71%,至第7天體重下降15.16%,肺指數(shù)為2.53%,細(xì)胞因子IFN-γ、I
L-10含量感染病毒后明顯高于感染前(P<0.05),差異有統(tǒng)計(jì)學(xué)意義。對(duì)照1組(同型免疫組)小鼠用H1N1疫苗免疫,H1N1病毒感染后全部存活。結(jié)果表明,如果小鼠感染與疫苗同一型別的流感病毒,則可得到完全保護(hù);而如果感染與疫苗不同型流感病毒,感染小鼠部分生存,說(shuō)明異型流感病毒間存在部分交叉免疫。另一結(jié)論為,應(yīng)用免疫增強(qiáng)劑的應(yīng)用,可以提高這種交叉免疫作用。免疫增強(qiáng)劑 IL-2是通過(guò)怎樣的機(jī)制對(duì)小鼠起到交叉保護(hù)作用,須進(jìn)一步研究確定。關(guān)于各種細(xì)胞因子的檢測(cè)結(jié)果,尤為突出的是異型免疫組和異型免疫加強(qiáng)組病毒感染后細(xì)胞因子IFN-γ含量明顯高于感染前,說(shuō)明此細(xì)胞因子可能在流感病毒異型間交叉保護(hù)免疫反應(yīng)中起重要作用。在小鼠感染模型中發(fā)現(xiàn),CD4+和CD8+T細(xì)胞在控制流感病毒感染中的作用至關(guān)重要[11]。IFN-γ屬于Th1類細(xì)胞因子,主要參與細(xì)胞免疫反應(yīng)。記憶性CD8+T細(xì)胞以表達(dá)IFN-γ為主[12],Seo等[13]證實(shí)記憶性CD8+T細(xì)胞是高致病性流感病毒交叉免疫保護(hù)作用的關(guān)鍵因素,而這種交叉免疫保護(hù)作用與肺組織中表達(dá)IFN-γ的記憶性CD8+T細(xì)胞的含量有關(guān)。在異型流感病毒感染后IFN-γ水平升高的確切機(jī)制有待深入研究。本研究還發(fā)現(xiàn)感染異型病毒后小鼠肺組織中IL-10含量亦升高, IL-10雖然屬于Th2類細(xì)胞因子,但可介導(dǎo)炎性反應(yīng),研究表明[14], IL-10作為一種重要的抗炎性細(xì)胞因子,能廣泛抑制促炎介質(zhì)生成,防止促炎反應(yīng)失控。
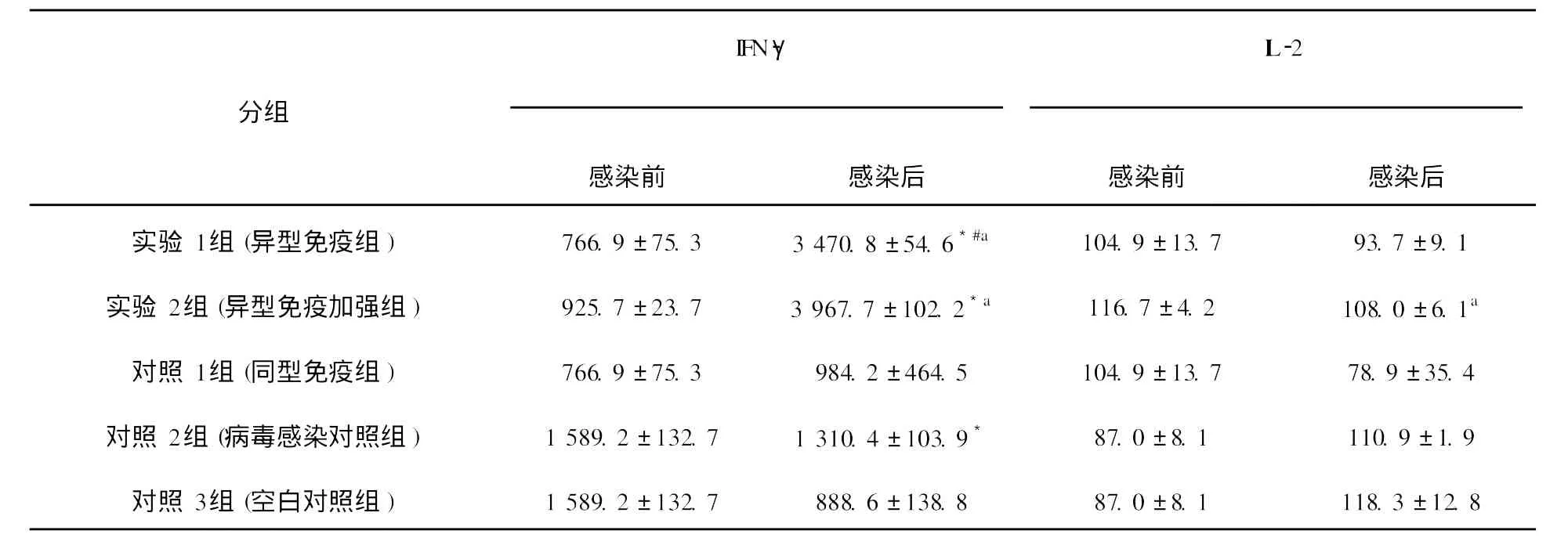
表1 EL ISA測(cè)定細(xì)胞因子IFN-γ、I L-2的濃度值(ˉχ±S,pg/mL)Table 1 The concentration of cytokines IFN-γand IL-2 assayed by EL ISA(mean±s,pg/mL)
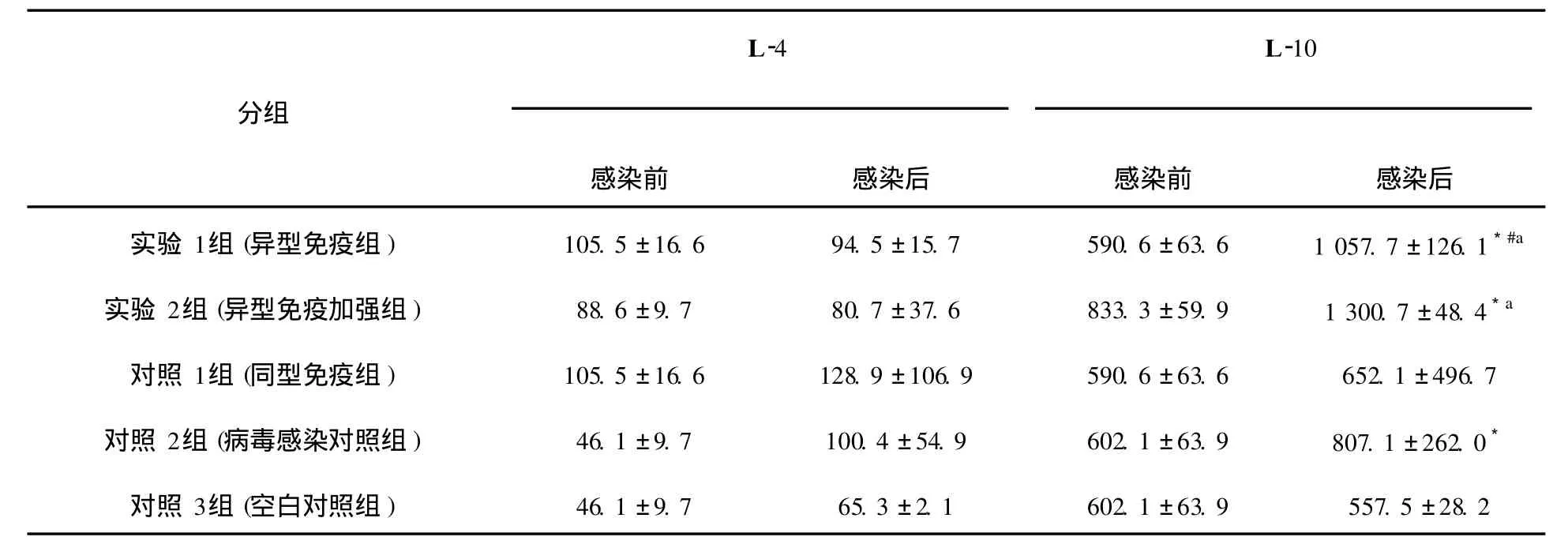
表2 EL ISA測(cè)定細(xì)胞因子I L-4、I L-10的濃度值(ˉχ±S,pg/mL)Table 2 The concentration of cytokines IL-4 and I L-10 assayed by EL ISA(mean±s,pg/mL)
[1] Hsieh YC,Wu TZ,Liu DP,et al.Influenza pandemics:past,present and future[J].J Formos Med Assoc,2006,105(1):1-6.
[2] FlahaultA,Vergu E,Boelle PY.Potential for a global dynamic of influenzaA(H1N1)[J].BMC InfectDis,2009,9(1):129.
[3] Sorianov,Gonzalez-Lahoz J.The challenge of the new H1N1 influenza A[J].Med Clin(Barc),2009,133(18):708-709.
[4] De JongMD,Tran TR,Tmong HK,et a1.Oseltamivir resistance during treatment of influenza A(H1N1)infection[J].N EllgI J Med,2005,353(25):2667-2672.
[5] 姚春艷,姜麗娜,等.腹腔注射 IL-2對(duì)小鼠單核吞噬細(xì)胞吞噬功能的影響[J].山西醫(yī)科大學(xué)學(xué)報(bào),2007,38(3):202-203.
[6] Tamura SI,Tanimoto T,Kurata T.Mechanisms of broad crossprotection provided by influenza virus infection and their application to vaccines[J].InfectDis,2005,58:195-207.
[7] Boon AC,de Mutsert G,van Baarle D,et al.Recognition of hemo-and heterosubtypic variants of influenza A viruses by human CD8+T lymphocytes[J]. Immunol,2004,172(4):2453-2460.
[8] Nguyen HH,Ginkel FW,Vu HL,et al.Heterosubtypic immunity to influenza A virus infection requires B cells but not CD8+cytotoxic T lymphocytes[J].J Infect Dis,2001,183(3):368-376.
[9] Droebner K,Haasbach E,Fuchs C,et al.Antibodies and CD4+-cells mediate cross-protection against H5N1 influenza virus infection in mice after vaccination with a low pathogenic H5N2 strain[J].Vaccine,2008,26(52):6965-6974.
[10] Ichinohe T,AinaiA,Nakamura T,et al.Induction of cross-protective immunity against influenza A virus H5N1 by an intranasal vaccine with extracts of mushroom mycelia[J].Med Virol,2010,82(1):128-137.
[11] Epstein SL,Lo CY,Misplon JA,et al.Mechanis m of protective immunity against influenza virus infection in mice without antibodies[J].I mmunol,1998,160(1):322-327.
[12] Lowin B,HahneM,Mattmann C,et al.Cytolytic T-cell cytotoxicity ismediated through perforin and Fas lytic pathways[J].Nature,1994,370:650-652.
[13] Seo SH,PeirisM,Webster RG.Protective cross-reactive cellular immunitytolethalA/Goose/Guangdong/1/96-like H5N1influenza virus is correlated with the proportion of pulmonary CD8+T cells expressing gamma interferon[J].JV I,2002,76(10):4886-4890.
[14] SeitzMLP,Dewald B,Towbln H,et al. IL-10 differentially regulates cytokine inhibitor and chemokine release from bloodmononuclear cells and fibroblasts[J].EJI,1995,25(4):1129-1132.

