利用局部模型估算物性數(shù)據(jù)
劉存玉
淄博職業(yè)學(xué)院 淄博 255013
有時(shí)有必要設(shè)計(jì)一個(gè)局部模型來(lái)計(jì)算在一個(gè)有限的(通常是狹窄的)溫度、壓力和組成范圍內(nèi)的物性數(shù)據(jù)。建立局部模型的目的有兩個(gè):①簡(jiǎn)便;②在相對(duì)較窄的溫度和壓力范圍內(nèi)具有較高的準(zhǔn)確度,其中簡(jiǎn)便是第一位的。例如,控制臺(tái)板上的電子計(jì)算器可能只能進(jìn)行加減乘除運(yùn)算,而無(wú)對(duì)數(shù)、三角之類的計(jì)算功能。如果模型公式比較復(fù)雜,那么在操作現(xiàn)場(chǎng)計(jì)算可能就不方便。當(dāng)然,如果手頭的計(jì)算工具具有數(shù)據(jù)儲(chǔ)存和高級(jí)復(fù)雜的運(yùn)算功能,那也就很可能無(wú)需使用局部模型公式。然而,也不能為了簡(jiǎn)便就忽視公式的準(zhǔn)確性,畢竟不準(zhǔn)確的模型是無(wú)用的。
所謂局部是指模型建立所對(duì)應(yīng)的操作條件。局部條件往往不是隨意設(shè)定的,而是決定于所處的工藝、設(shè)備狀況以及其他實(shí)際情況。模型的建立要限定在設(shè)定的局部條件內(nèi)。
局部模型說(shuō)到底其實(shí)就是以一定的數(shù)據(jù)為基礎(chǔ)的近似關(guān)系式。這些數(shù)據(jù)可能來(lái)自于物性手冊(cè)[4]、模擬程序或其他軟件、實(shí)驗(yàn)數(shù)據(jù)、工廠數(shù)據(jù)或其他途徑。
建立局部模型,首先要有可靠的理論依據(jù),再設(shè)定模型應(yīng)該具有怎樣的簡(jiǎn)單程度,然后利用數(shù)學(xué)的和物理的近似關(guān)系式進(jìn)行簡(jiǎn)化計(jì)算,直到取得較為理想的結(jié)果。
有時(shí)候憑直覺就可以得到一個(gè)好的局部模型,特別是將數(shù)據(jù)作圖可能會(huì)揭示出需要的函數(shù)關(guān)系。如果數(shù)據(jù)看上去具有線性關(guān)系,那么就嘗試用一個(gè)線性函數(shù),而不管理論上有何種關(guān)系。
設(shè)計(jì)人員必須對(duì)建立的局部模型的局限性心中有數(shù),不要將其外推。如果需要的精確度大于當(dāng)初設(shè)計(jì)局部模型時(shí)設(shè)定的準(zhǔn)確度,則不要用其進(jìn)行計(jì)算。
1 氣體密度模型
氣體流量的控制在很多情況下決定于氣體的密度。對(duì)某些計(jì)算而言,使用理想氣體定律就足夠了。然而,對(duì)非理想狀態(tài),利用包含壓縮因子的公式計(jì)算可得到更好的結(jié)果。氣體的密度可以用式(1)計(jì)算:
ρ=MP/(ZRT)
(1)
式中,ρ為密度,kg/m3;M為摩爾質(zhì)量,kg/kmol;P為壓力,kPa;Z為壓縮因子,無(wú)因次;R為氣體常數(shù),8.314 m3·kPa/(kmol·K);T為溫度,K。
現(xiàn)在就以維里方程建立壓縮因子的局部模型。
維里方程是一個(gè)具有堅(jiān)實(shí)動(dòng)力學(xué)理論基礎(chǔ)的狀態(tài)方程[1]。它可寫成式(2)的形式:
(2)
式中,B、C和D為維里系數(shù)。
對(duì)低壓氣體,通常截取公式中的第一、二項(xiàng)就足夠了:
(3)
式中,B為第二維里系數(shù),它是溫度的函數(shù),而與壓力無(wú)關(guān)。
對(duì)純物質(zhì),有作者推導(dǎo)出一個(gè)相對(duì)簡(jiǎn)單的求解第二維里系數(shù)的關(guān)聯(lián)式:
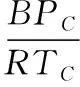
(4)
(5)
(6)
式中,ω為離心因數(shù);下標(biāo)C代表臨界點(diǎn);下標(biāo)R代表對(duì)比條件(TR=T/TC)。
將式(5)、式(6)代入式(4)得:
(7)
對(duì)一定的物質(zhì),式(7)中的TC、PC和ω都是常數(shù),因此可將式(7)改寫為更一般的表達(dá)式:
(8)
式中,常數(shù)An(n=1,2,3,…)為相關(guān)常數(shù)的組合,可以根據(jù)具體條件計(jì)算出來(lái)。
將式(8)代入式(3),就得到壓縮因子的第一個(gè)局部模型:
(9)
實(shí)際上,從這一點(diǎn)就開始簡(jiǎn)化了。由于是在有限范圍內(nèi)使用,所以可以進(jìn)行近似處理。
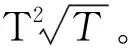
(10)
由此得:
T2.6≈T2.5≈aT2+bT3
(11)
把這些近似式代入式(9),得到第二個(gè)局部模型關(guān)系式:
(12)
注意在導(dǎo)出的該表達(dá)式中沒有四次項(xiàng)。可以進(jìn)一步將其作為溫度倒數(shù)的指數(shù)數(shù)列加以表述,就如式(13)所示:
(13)
在滿足要求的準(zhǔn)確度的情況下,為避免不必要的復(fù)雜,限制公式中包含的項(xiàng)數(shù)為好。當(dāng)然,在更寬的溫度和壓力范圍內(nèi),很可能就需要更多的數(shù)列項(xiàng)數(shù)。
簡(jiǎn)單加和數(shù)列公式的優(yōu)點(diǎn)在于它沒有使代數(shù)運(yùn)算復(fù)雜化的分?jǐn)?shù)指數(shù),缺點(diǎn)是因簡(jiǎn)化而不夠嚴(yán)密。例如在式(13)增加沒有理論基礎(chǔ)的第4項(xiàng),必須通過(guò)對(duì)一些數(shù)據(jù)進(jìn)行回歸來(lái)計(jì)算校正系數(shù)Ai。
盡管該數(shù)列模型在寬的溫度和壓力范圍內(nèi)的準(zhǔn)確度不很高,但是這里要找的也不過(guò)是在相對(duì)較窄狀態(tài)條件下具有合理準(zhǔn)確度的模型,下面通過(guò)實(shí)例來(lái)說(shuō)明。
表1的數(shù)據(jù)取自一套甲烷物性數(shù)據(jù)表[2],這是建立模型的基礎(chǔ)數(shù)據(jù)。利用表1數(shù)據(jù)建立一個(gè)在有限溫度和壓力范圍內(nèi)甲烷的壓縮因子模型。
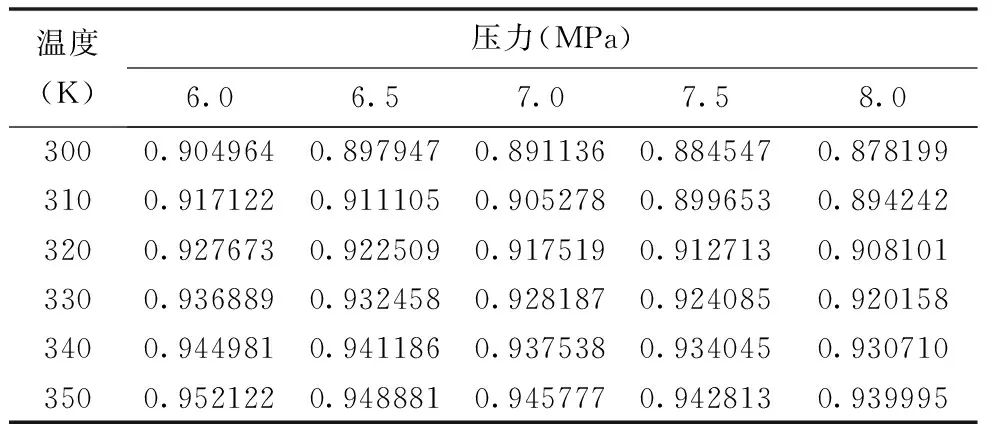
表1 甲烷壓縮因子表
1.1 解法一
(1)利用更嚴(yán)格的模型式(9),得到式(14):
(14)
和表1數(shù)據(jù)核對(duì),由該公式計(jì)算出的數(shù)據(jù)誤差為:AE=0.01%,AAE=0.13%,MaxE=0.28%,可見符合程度較好。考慮到溫度范圍是隨意選取的,因此該局部模型計(jì)算數(shù)據(jù)和表1中數(shù)據(jù)的一致性較理想。當(dāng)然,這并不代表所有情況都有這樣的準(zhǔn)確度。
(2)AE為平均誤差,其定義為:
式中,v(i)為建立模型所采用的數(shù)據(jù)值;e(i)則是在相同條件下利用建立的模型計(jì)算出的對(duì)應(yīng)值(即估算值);NP為取值點(diǎn)的個(gè)數(shù)。可見,AE可正可負(fù)。
(3)AAE為絕對(duì)平均誤差,其定義為:
顯然,AAE只能為正。若AE小而AAE相對(duì)較大,則說(shuō)明在建立模型所采用的數(shù)值和對(duì)應(yīng)的估算值之間存在系統(tǒng)偏差。
(4)MaxE是最大誤差,取下式中的最大值,它表示模型與建立模型所使用數(shù)據(jù)間的最大偏差:
1.2 解法二
以式(13)為計(jì)算基礎(chǔ)進(jìn)行檢驗(yàn)。利用給定的壓縮因子數(shù)據(jù),對(duì)該式進(jìn)行5項(xiàng)指數(shù)數(shù)列擴(kuò)展而得的回歸數(shù)據(jù)見表2。

表2 平均絕對(duì)誤差一覽表
表2中AAE數(shù)值清楚地表明,數(shù)列項(xiàng)超過(guò)兩項(xiàng)就對(duì)局部模型的準(zhǔn)確度幾乎沒有什么貢獻(xiàn)。因此,最后所得到的局部模型為式(15):
(15)
式中,P為壓力,MPa;T為溫度,K。
對(duì)此模型,AE=0.02%,AAE=0.13%,MaxE=0.31%,表明和前述更嚴(yán)格的(也更復(fù)雜的)模型相當(dāng)。
查驗(yàn)式(15)的準(zhǔn)確度,用其估算35℃,6.28MPa下的壓縮因子,結(jié)果見式(16):
(16)
該結(jié)果與由表1雙線性內(nèi)插法所得數(shù)據(jù)之間的誤差值為0.2%。
注意,上述模型的建立是假定過(guò)程無(wú)相變發(fā)生,否則不能使用。
2 氣體的焓
對(duì)焓建立局部模型需要以理想氣體焓變公式為基礎(chǔ)來(lái)進(jìn)行一些新的推理。式(17)為理想氣體焓變的確切表達(dá)式。
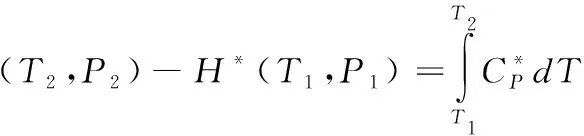
(17)
式中,H為焓;上標(biāo)*代表理想氣體狀態(tài);CP為等壓熱容。
眾所周知,理想氣體的焓與壓力無(wú)關(guān)。一般可將理想氣體的熱容表示為溫度的多項(xiàng)式。因此,焓的一個(gè)合乎邏輯的局部模型可以用式(18)表達(dá):
H=a+bT+cT2+dT3+……
(18)
通常,一個(gè)包含三次方的多項(xiàng)式可適用于很寬的溫度范圍。四次方多項(xiàng)式可用于0~1000K的范圍。只要壓力變化不大,這樣的模型就已足夠準(zhǔn)確。
壓力對(duì)理想氣體的焓有影響,建立模型時(shí)可將這一點(diǎn)考慮進(jìn)去。例如,利用Peng-Robinson(PR)狀態(tài)方程[3]來(lái)計(jì)算組成為表3的酸性氣體混合物的焓,見表4。
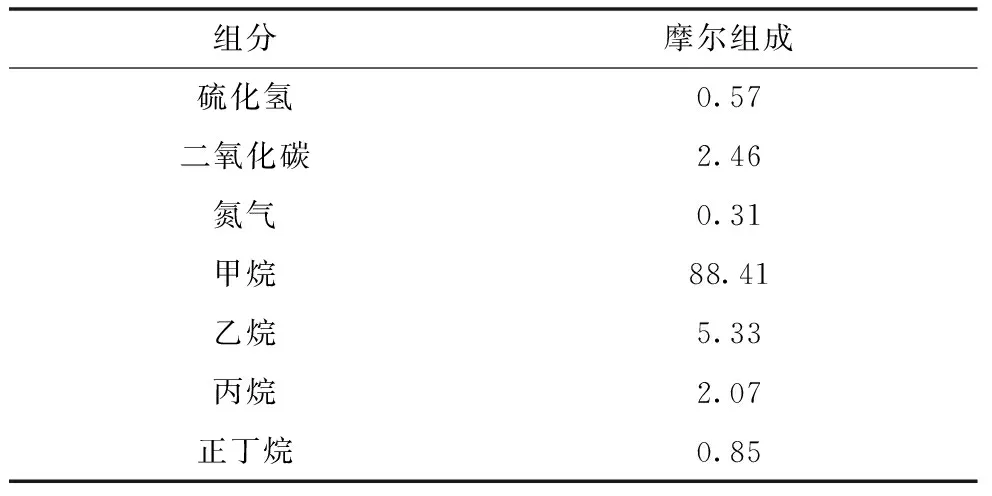
表3 某種酸性氣體混合物的組成 (%)
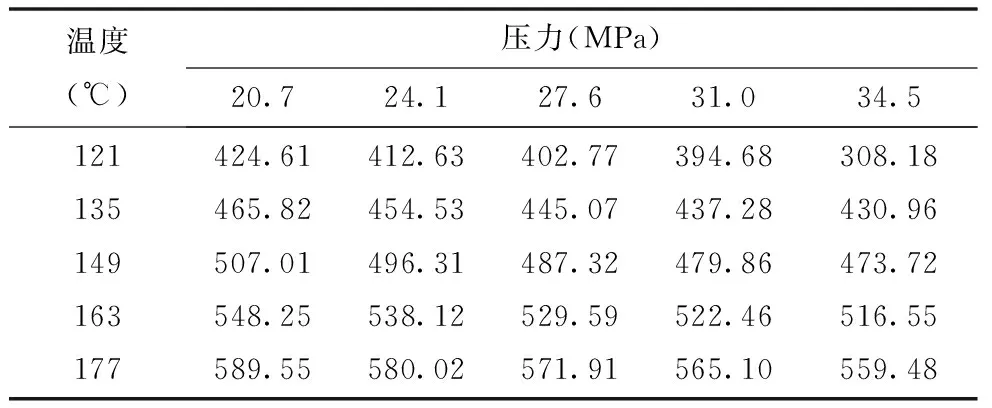
表4 某酸性氣體混合物的焓 (kJ/kg)
現(xiàn)分步建立模型。如果焓是溫度的線性函數(shù),與壓力無(wú)關(guān),那么可推出近似式(19):
H=37.02+3.04t
(19)
式中,H為焓,kJ/kg;t為溫度,℃。
該模型的誤差為:AE=-0.08%,AAE=2.15%,MaxE=4.70%。而式(20)為二次項(xiàng)模型:
H=38.25+3.02t+5.85×10-5t2
(20)
其誤差分別為:AE=-0.13%,AAE=2.16%,MaxE=4.66%。
對(duì)上述線性模型和二次模型而言,單純從其AE值較小來(lái)判斷,兩個(gè)模型均具有不錯(cuò)的相符度。然而,其相對(duì)較大的AAE值顯示,在模型和數(shù)據(jù)之間存在系統(tǒng)誤差。
最后,在模型中加入一個(gè)壓力項(xiàng)P(單位為MPa),得到方程式(21):
H=38.25+3.02t+5.85×10-5t2+1721.3/P
(21)
該模型的誤差為:AE=-0.00%,AAE=0.16%,MaxE=0.50%。同前面兩個(gè)壓力無(wú)關(guān)的模型相比,該式有了非常顯著的改進(jìn),因?yàn)閺谋?可清楚看出焓與壓力有關(guān)。
3 氣體的粘度
根據(jù)動(dòng)力學(xué)理論,理想氣體的粘度與溫度的平方根成正比,而與壓力無(wú)關(guān)。
(22)
這是建立關(guān)聯(lián)式的良好基礎(chǔ)。一般地使用平方根函數(shù)很可能是最好的,但是,就其應(yīng)用場(chǎng)合和簡(jiǎn)單計(jì)算工具而言,有必要尋求一個(gè)線性溫度函數(shù)。
式(10)表示將溫度的平方根表示為線性函數(shù)的近似關(guān)系式。因此,局部模型就簡(jiǎn)單地變?yōu)椋?/p>
μ=δ+λT
(23)
以低壓下的氫氣為例,其粘度見表5。
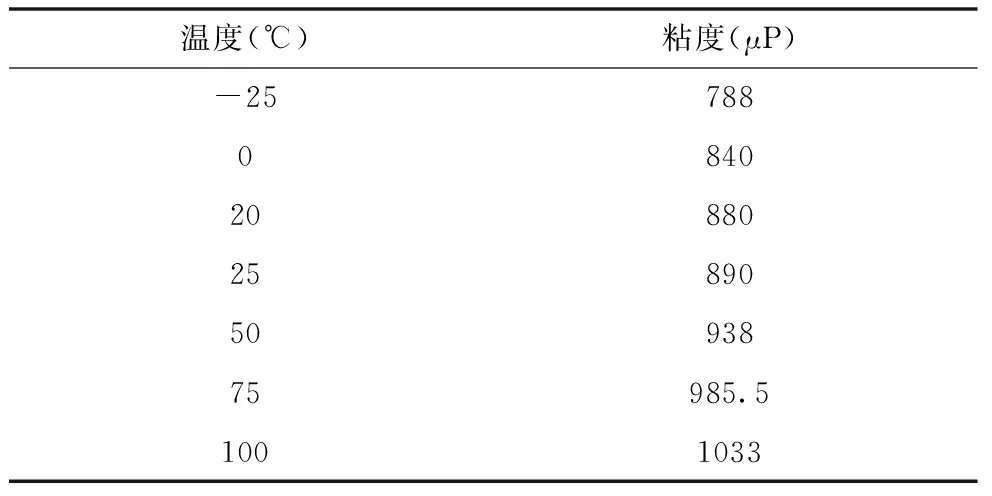
表5 低壓下氫氣粘度
像很多低壓氣體一樣,氫氣粘度是隨溫度的升高而增加的。
若按線性關(guān)系構(gòu)建模型,可得到函數(shù)關(guān)系見式(24):
μ=306.5+1.95T
(24)
式中,μ為粘度,cP;T為溫度,K。
該線性模型的AE=0.00%,AAE=0.15%,MaxE=0.34%。誤差相當(dāng)小,所以線性模型在大多數(shù)情況下使用是合適的。
如前所述,理想氣體的粘度與壓力無(wú)關(guān)。然而,真實(shí)氣體的粘度卻隨壓力的增加而增加。這一現(xiàn)象可用式(25)表示。
μ=f(T)+AP
(25)
當(dāng)設(shè)計(jì)包含壓力的氣體粘度模型時(shí),最簡(jiǎn)單的方法是先將數(shù)據(jù)作圖,直觀上看對(duì)壓力的依賴性。因篇幅關(guān)系,在此不舉實(shí)例。
4 液體的粘度
對(duì)液體粘度,還沒有基于什么基本原理的比較好的理論。但我們都知道,液體粘度是隨溫度的升高而降低的,用式(26)來(lái)表示:
lnμ=A+BT
(26)
該式含有對(duì)數(shù),這對(duì)局部模型來(lái)說(shuō)是不希望有的。為避免對(duì)數(shù)的存在,將該式變化為式(27)的指數(shù)形式:
(27)
對(duì)該式采用近似關(guān)系見式(28):
(28)
把式(27)改寫為式(29):
(29)
這是溫度倒數(shù)的指數(shù)數(shù)列。因此,局部模型就可壓縮為式(30):
(30)
為簡(jiǎn)化起見,將常數(shù)命名為Ci。項(xiàng)數(shù)的多少影響局部模型的準(zhǔn)確性。僅留一項(xiàng)(即假定粘度是個(gè)常數(shù))近似程度不好。一般情況下,保留三項(xiàng)可能就足夠。如果壓力范圍不太寬,那么一般可忽略壓力的影響。然而,增加壓力,液體粘度也趨于增加。作為第一次近似,可假定粘度與壓力成正比。因此,一個(gè)類似于式(25)的模型就可由式(31)來(lái)表示:
(31)
以建立計(jì)算液態(tài)二氧化碳粘度的局部模型為例,一定溫度和壓力范圍內(nèi)液態(tài)二氧化碳的粘度見表6。
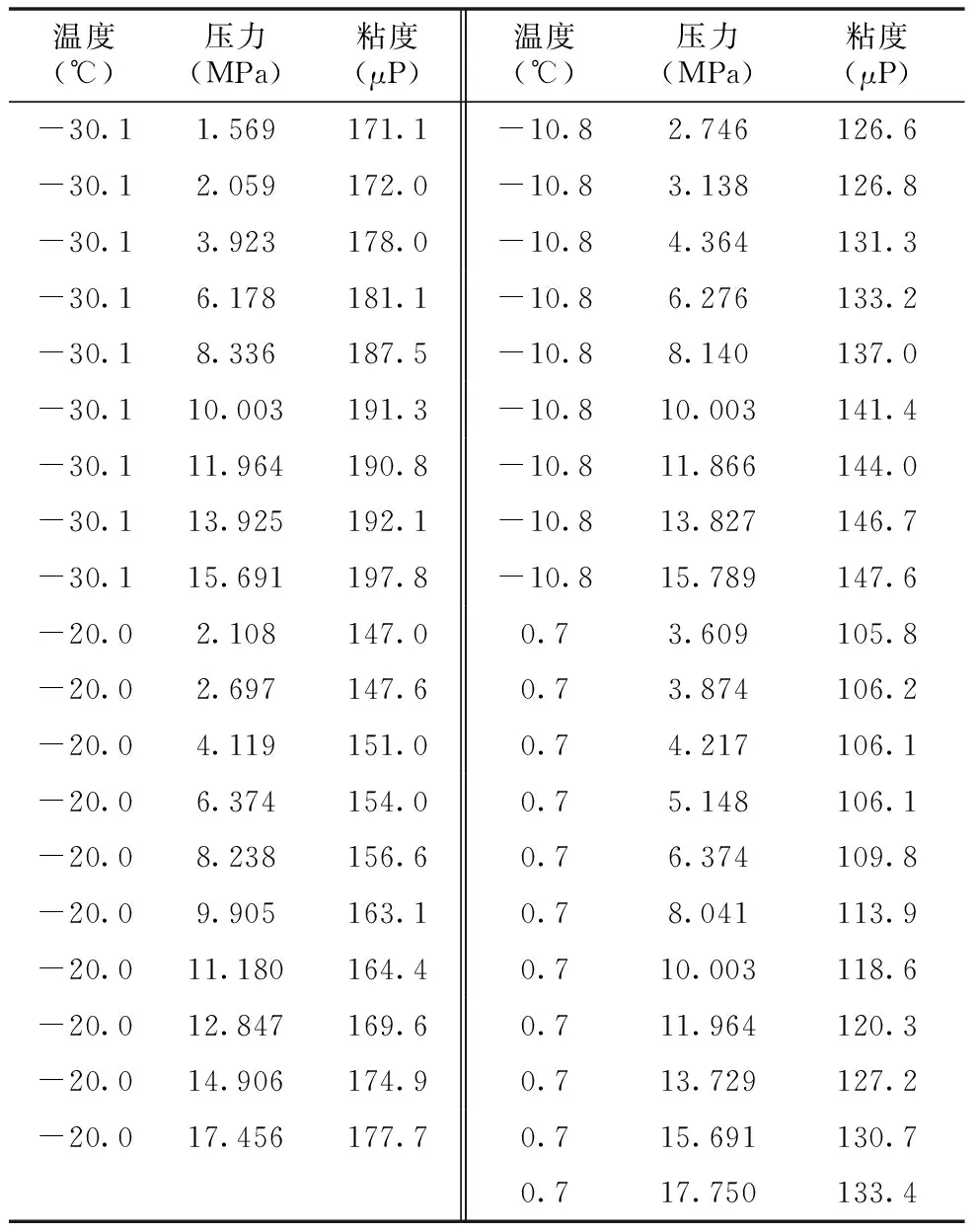
表6 液態(tài)二氧化碳的粘度
如果將表中數(shù)據(jù)作圖,可以看出溫度不變時(shí),當(dāng)壓力增加,粘度也增加,而且?guī)缀躏@示出線性關(guān)系。并且線性關(guān)系似乎與溫度無(wú)關(guān),就是說(shuō),對(duì)所有等溫線,其斜率近乎相同。
利用這些信息以及上面的近似關(guān)系式(31),就可以建立起局部模型式(32):
μ=-458.8+(1.524×105)/T+1.951P
(32)
式中,μ為粘度,μP;T為溫度,K;P為壓力,MPa。
該模型對(duì)數(shù)據(jù)具有良好的相符程度:AE=-0.06%,AAE=0.92%,MaxE=3.60%。
5 需要注意的事項(xiàng)
(1)正因?yàn)榫植磕P秃?jiǎn)單,所以就不應(yīng)超出限定的條件范圍使用。得出的模型是針對(duì)單相體系的,不要企圖將對(duì)氣體推出的模型通過(guò)關(guān)聯(lián)來(lái)估算液體的性質(zhì),反之亦然。
(2)要避開臨界點(diǎn)附近的區(qū)域,因?yàn)樵谂R界點(diǎn)區(qū)域的物性變化很快。即便是嚴(yán)格的模型,在臨界點(diǎn)附近區(qū)域使用也難得到良好的結(jié)果。
參 考 文 獻(xiàn)
1 Van Ness, H.C.et al, Classical Thermodynamics of Nonelectrolyte Solutions with Applications to Phase Equilibria [M].McGraw-Hill, New York, 1982.
2 Wagner, W.and de Reuck K. M., Methane. International Thermodynamic Tables of the Fluid State-13 [M].Blackwell Science, Oxford, UK, 1996.
3 Peng, D. Y.and Robinson, D.B.A New Two-constant Equation of State [J]. Ind. Eng. Chem. Fund., 15, 1976.
4 王松漢主編. 石油化工設(shè)計(jì)手冊(cè)[M].北京: 化學(xué)工業(yè)出版社,2004.

