AcSDKP對體外培養條件下人骨髓間充質干細胞增殖周期的影響
戴 國,李 燁,彭 彬,徐 倩,汪保和
(湖南師范大學生命科學學院, 中國 長沙 410081)
N-乙酰基-絲氨酰-天冬氨酰-賴氨酰-脯氨酸(N-acetyl-seryl-aspartyl-lysyl-proline, AcSDKP)是細胞生長的一種生理性調控因子,是在胎牛骨髓中發現的[1].AcSDKP能阻止造血干/祖細胞進入S期,使之停留在Go期,抑制它們的增殖[2-3].進一步的研究發現,AcSDKP對非造血細胞如淋巴細胞,腎間質成纖維細胞等有生長抑制作用[4],對心肌、肺組織纖維化也有一定的抵抗作用[5-6].作者所在實驗室前期的研究發現,AcSDKP能抑制體外培養條件下人和小鼠骨髓間充質干細胞(mesenchymal stem cells, MSCs)的增殖[7].本研究的主要目的是通過分離、純化和培養人骨髓MSCs,觀察AcSDKP對這種成體干細胞增殖周期的影響,為闡明該因子對MSCs的增殖調控機制提供新的論據.
1 材料和方法
1.1 主要試劑
DMEM培養基(低糖)、卡托普利、胰蛋白酶、AcSDKP、四甲基偶氮唑鹽(MTT)、碘化丙啶(PI)、5-溴脫氧尿嘧啶核苷(BrdU)為Sigma公司產品.胎牛血清(FBS)購于杭州四季青公司.淋巴細胞分離液(1.077±0.002 g/L)為上海國藥集團生化公司產品.小鼠抗人BrdU抗體購于Oncogene Science公司;生物素化羊抗小鼠IgG、DAB顯色試劑盒購于武漢博士德生物公司.培養器皿為Costar公司產品.
1.2 人骨髓單個核細胞的分離
從中南大學湘雅醫院胸外科獲取擇期手術切口中摘除的肋骨段,病人無血液系統疾患且無肋骨病變.在無菌條件下剪成約3 cm小段,用DMEM培養液沖出骨髓,依次用帶7號、6號、4號針頭的注射器將骨髓懸液吸打各3次,制成單細胞懸液.將單細胞懸液加于淋巴細胞分離液上,1 500 r/min離心10 min,收集中間層單個核細胞,用DMEM重懸所收細胞,洗2次,計數備用.
1.3 MSC的純化和傳代培養
取骨髓單個核細胞混于20%(體積分數,下同)FBS的DMEM液中,懸液含細胞5×106個/mL,種入塑料培養瓶,于35 ℃、5%CO2、飽和濕度條件下培養.3 d后更換一次培養液,相同條件下繼續培養,至細胞增殖而鋪滿瓶底約90%面積時,用胰蛋白酶消化法收集細胞,于同樣培養體系和條件下傳代培養,以擴增和純化人骨髓MSC.
1.4 BrdU摻入法
取第3代MSC,接種于內置一蓋玻片的35 mm塑料培養皿中,細胞密度為1×105個/mL.分4組進行培養,對照組加入20%FBS的DMEM,另3組在對照組基礎上添加AcSDKP,終濃度分別為1×10-9,1×10-10和1×10-11mol/L.培養5 d后加入BrdU(終濃度為30 μmol/L), 繼續培養2 h.取出蓋玻片,按試劑盒說明書依次操作如下:PBS洗3次,4%多聚甲醛固定30 min.滴加0.3%H2O2:甲醇,滅活內源性過氧化物酶.滴加5%正常兔血清封閉液,室溫20 min.甲酰胺100 ℃, 5 min變性核酸.滴加小鼠抗BrdU單抗(工作濃度1∶250),4 ℃過夜.滴加生物素化羊抗小鼠IgG(1∶100),37 ℃,20 min.加SABC(鏈酶親和素-生物素-過氧化物酶復合物),37 ℃,20 min.DAB(3,3-二氨基聯苯胺)顯色.陰性對照:同樣條件下培養的未加BrdU的 MSC.隨機計數10個高倍視野中細胞總數及BrdU陽性細胞數,計算標記指數(LI)[8].
標記指數(LI)=標記細胞數/計數細胞總數×100%.
1.5 流式細胞術
將濃度分別為1×10-10,1×10-11,1×10-12mol/L 的AcSDKP添加組與對照組培養瓶細胞培養至接種后第5天,細胞80%融合時,胰蛋白酶消化法收集細胞,以1×106個細胞密度懸浮細胞,經熒光染料碘化丙錠(PI)溶液避光染色30 min,流式細胞儀488 nm檢測,獲取DNA含量分布組方圖,確定各期細胞數.
1.6 MTT比色法
取傳代培養第3代的MSC,分5組接種于24孔塑料培養板,5×103個細胞/孔,第一組(對照組)添加20%FBS的DMEM;在對照組基礎上,第二至五組加AcSDKP(終濃度分別為1×10-12,1×10-11,1×10-10,1×10-9mol/ L),同時加入卡托普利(終質量濃度為10-6μg/L).按前述條件培養24 h后小心吸去懸液,MTT檢測,490 nm波長下讀取A值(absorbance value).重復實驗3次.
1.7 AcSDKP對MSC集落生成抑制作用可逆性的檢測
將人骨髓單個核細胞混于20%FBS的DMEM中,培養體系含細胞2×106個/mL,種入12孔塑料培養板,每孔1 mL.35 ℃、5%CO2、飽和濕度下培養.3 d后,輕輕晃動培養板,吸去各孔的培養上懸液和未貼壁的細胞,分4組(3孔/組)做第一次換液.第一、二組換入20%FBS的DMEM,第三、四組加終濃度為1×10-11mol/ L AcSDKP的20%FBS DMEM,同時加入卡托普利(終質量濃度為10-6μg/L).在相同培養條件下繼續培養3 d,吸去上懸液,用DMEM輕輕刷洗一次培養孔,按前分組第二次換液.第一組為(1)不換液的不添加AcSDKP組;第二組仍換入20%FBS的DMEM,為(2)換液前后均不添加AcSDKP組;第三組仍換入終濃度為1×10-11mol/ L AcSDKP,為(3)換液后繼續添加AcSDKP的全程作用組;第四組換入不含AcSDKP的20%的FBS的DMEM,為(4)換液撤除AcSDKP組.同樣條件下繼續培養4 d,瑞氏-吉姆薩(Wrighte-Giemsia)染色,光鏡下計數MSC集落(≥50個成纖維細胞樣細胞的細胞聚合定為一個MSC集落).
1.8 不同血清濃度條件下AcSDKP影響MSC生長的集落形成實驗
配含FBS體積分數為10%、20%、30%和40%的人MSC集落培養體系,每一濃度包含2個組,其中一組添加AcSDKP(終濃度為1×10-11mol/L);另一組不添加AcSDKP.按前所述培養后,計數MSC集落,并按下式計算各FBS濃度點AcSDKP對MSC集落生成的抑制率:
抑制率=(不加AcSDKP組集落數-AcSDKP添加組集落數)/不加AcSDKP組集落數×100%.
1.9 統計學處理
2 結果
2.1 骨髓MSC的體外生長狀況
圖1 傳代培養的第3代人骨髓MSC(Scale bar, 20 μm)
骨髓單個核細胞種于塑料培養瓶培養3 d后,在倒置顯微鏡下可見單個或少量集落生長的貼壁細胞,形態大多呈短梭形或針尖狀,有一個核位于中央,可見核仁.10~15 d后,細胞集落不斷擴大并形成融合單層,細胞形態大多呈長梭形或多角形.傳代培養中,細胞24 h內完全貼壁、伸展,重新變為長梭形,呈均勻分布,增殖迅速,培養7~10 d即達到完全融合 (圖1).黏附于貼壁細胞之上的造血細胞和其他細胞在換液的過程中逐漸減少而幾近消失.在本實驗條件下,人骨髓MSC能在體外擴增10代左右.
2.2 AcSDKP作用下人骨髓MSC的BrdU摻入試驗結果
10-11mol/L的AcSDKP添加組標記指數(LI)為(5.93±1.08)%,與對照組(10.57±1.36)%相比,差異有高度顯著意義(P< 0.01).10-9mol/L和10-10mol/L AcSDKP添加組的LI分別為(8.07±0.55)%和(6.73±0.52)%,與對照組相比,差異有統計顯著性(P<0.05).
2.3 AcSDKP作用下人骨髓MSC細胞周期的FCM分析結果
FCM檢測不同濃度AcSDKP培養條件下人骨髓MSC的DNA含量,經計算機處理,獲得細胞周期各時相細胞的百分率(見表1).AcSDKP添加組與對照組相比,G0/G1期細胞比例增加,S+G2/M期細胞比例減少,差異有顯著意義(P<0.05)(圖2).
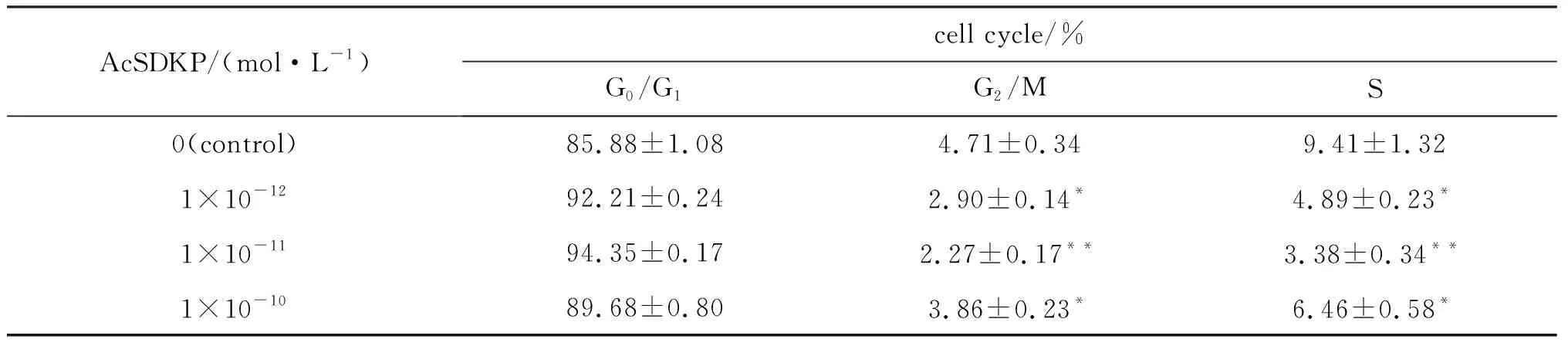
表1 不同濃度AcSDKP培養條件下人骨髓MSC的細胞周期狀態
**P<0.01 and*P<0.05, compared with control. Data were from three separate experiments.
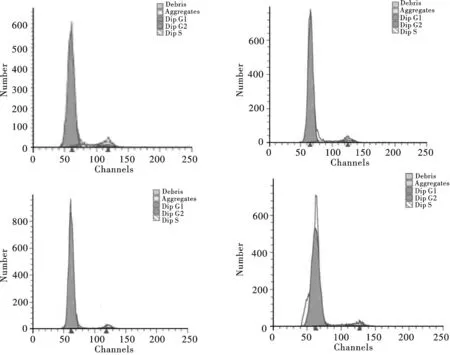
A.control;B.treated by 10-10 mol/ L AcSDKP;C.treated by 10-11 mol/L AcSDKP;D.treated by 10-12 mol/ L AcSDKP圖2 AcSDKP對人骨髓MSC細胞周期的影響
2.4 AcSDKP對人骨髓MSC生長抑制作用的可逆性
如圖3所示,不換液不加AcSDKP組、換液不加AcSDKP組、換液加 AcSDKP組和換液撤除AcSDKP組的集落生成數分別為(22.46±1.96),(22.84±1.61),(11.50±1.83),(17.51±1.05)個/106BMMNC.換液后撤除AcSDKP組的集落生成數與對照組比較有顯著差異(P<0.01),MSC生長得到了一定程度的恢復.
2.5 不同血清濃度下AcSDKP對人骨髓MSC的增殖抑制效應
如圖4顯示,在FBS為10%、20%、30%的條件下,AcSDKP添加組的集落數明顯小于對照組(P<0.05);而FBS體積分數為40%AcSDKP添加組與對照組之間集落生成數差異無顯著性意義(P>0.05).在FBS體積分數為40%AcSDKP添加組中抑制率也最低.
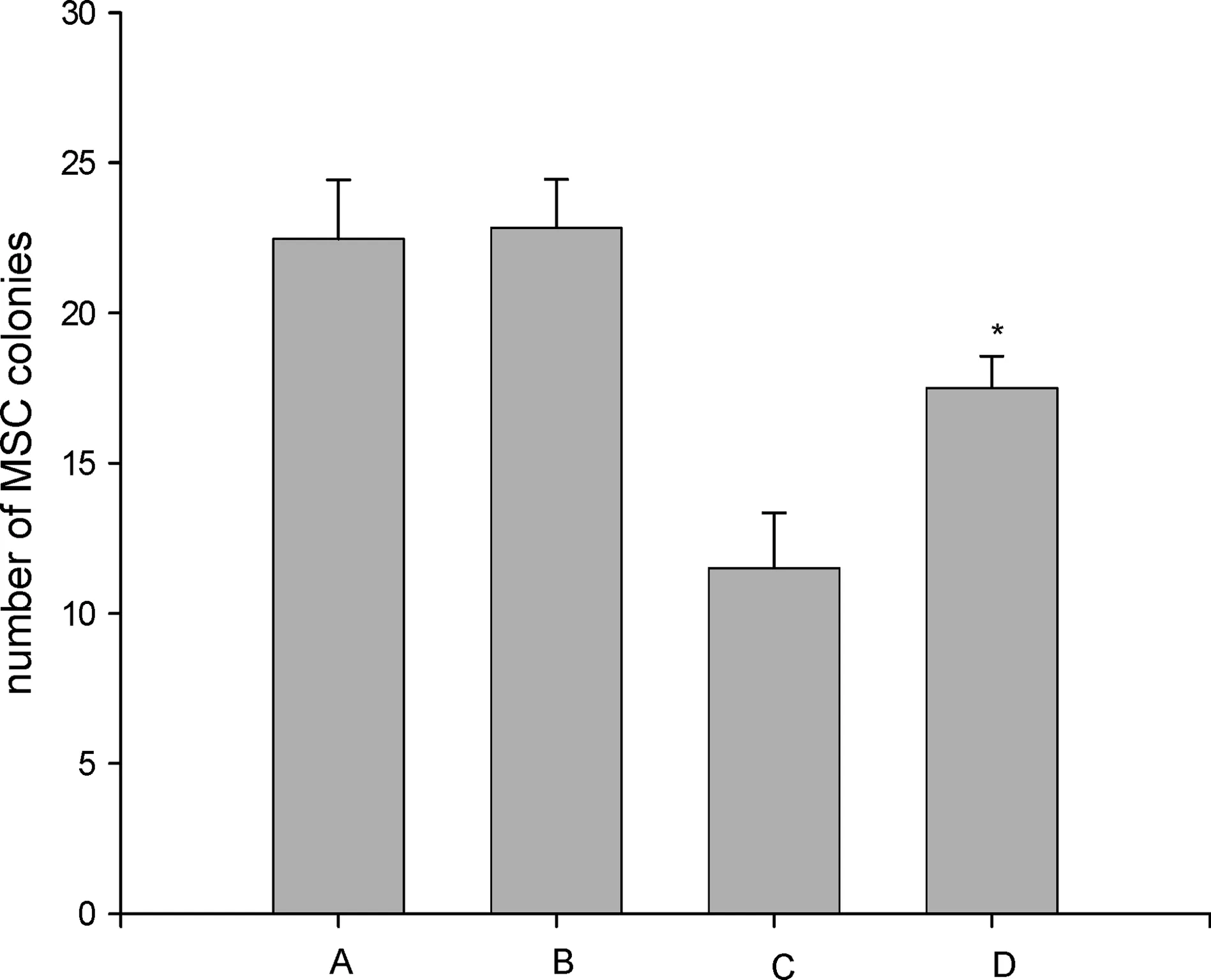
A為不換液不加AcSDKP組;B為換液不加AcSDKP組;C為換液加AcSDKP組;D為換液撤除AcSDKP組.圖3 培養體系中撤除AcSDKP后MSC生長的恢復
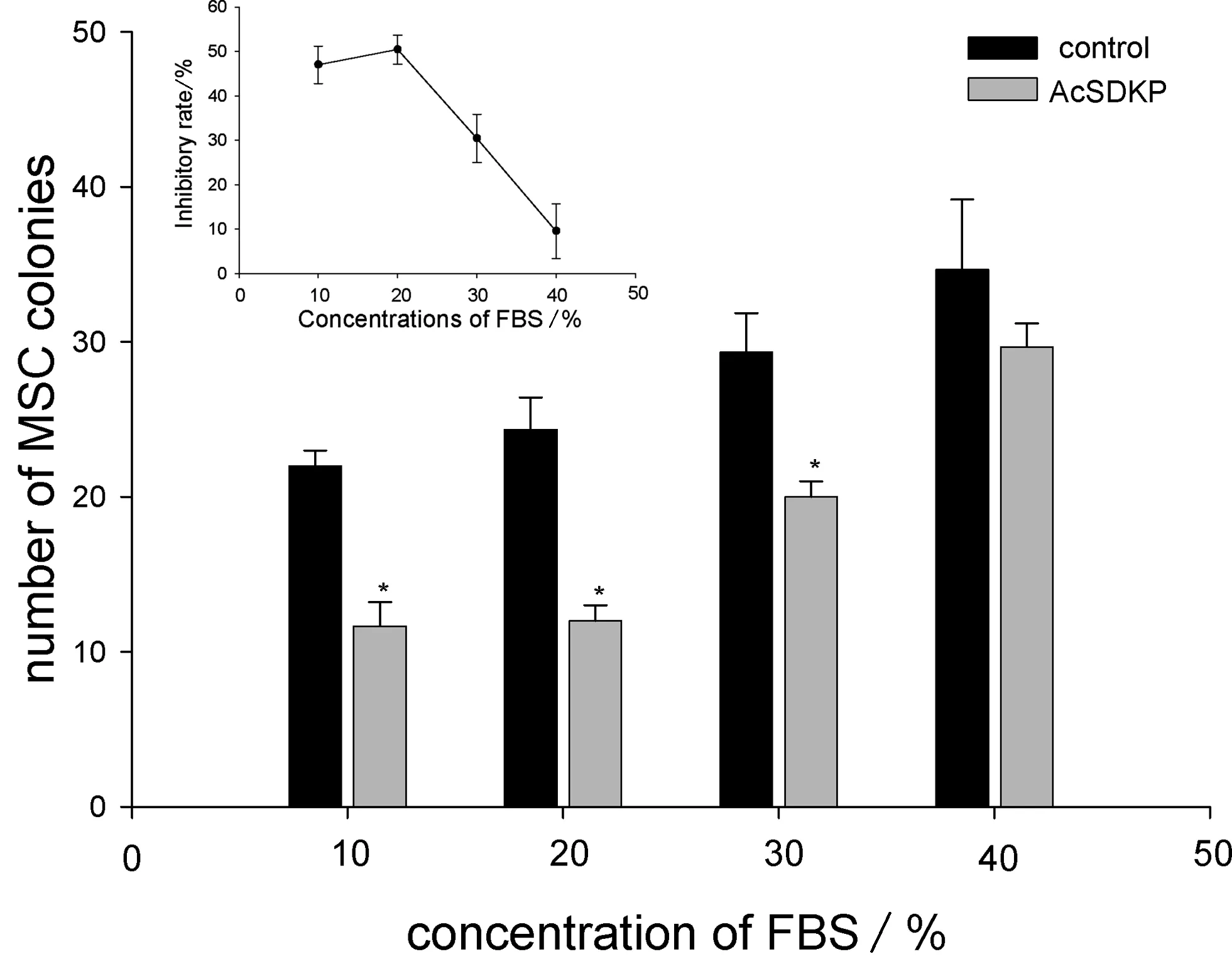
**P<0.01 and *P<0.05, compared with control. Data were from three separate experiments圖4 不同血清濃度下AcSDKP對人骨髓MSC生長的影響
2.6 AcSDKP對人骨髓MSC貼壁的影響
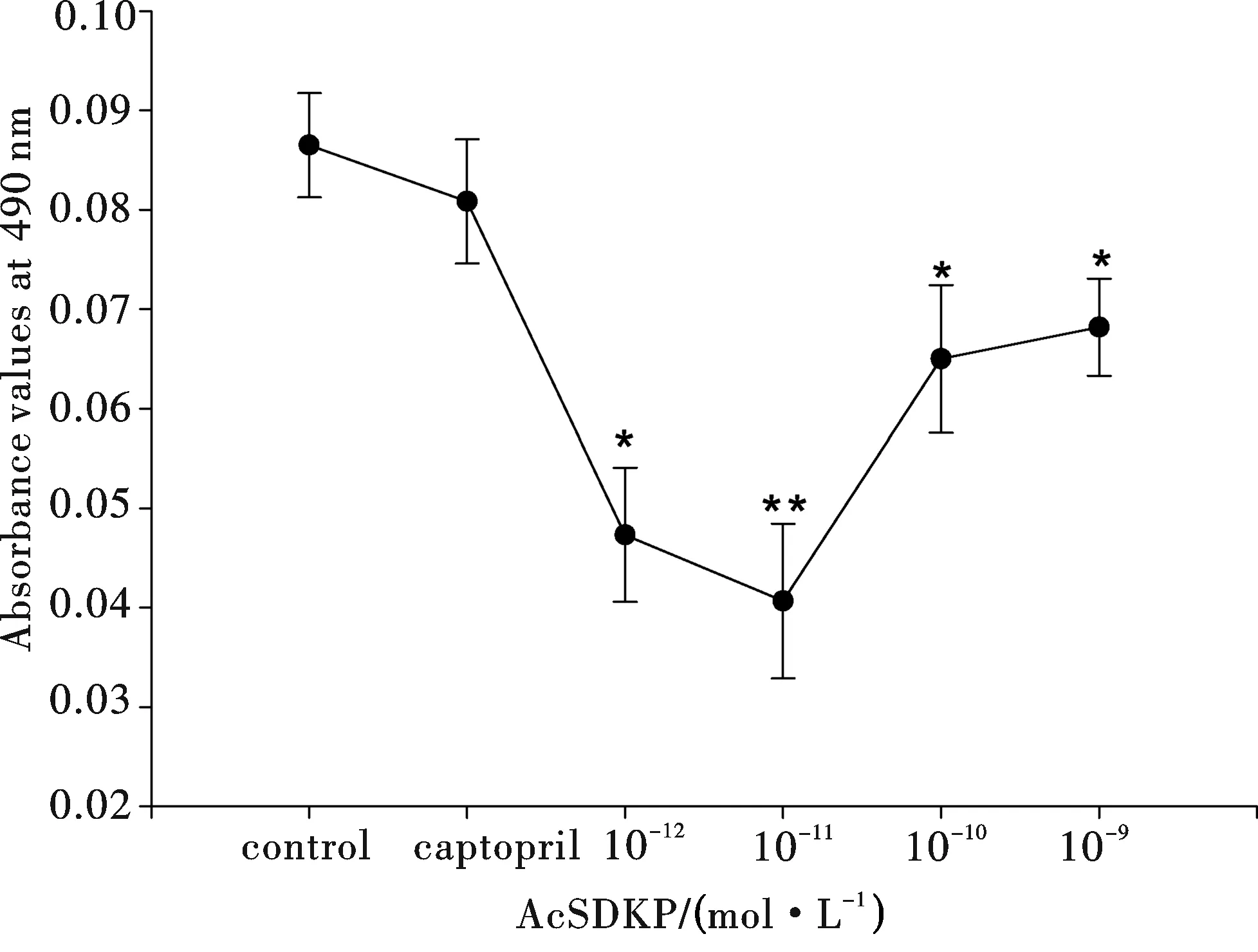
**P<0.01 and *P<0.05, compared with control. Data were from three separate experiments圖5 AcSDKP作用下人骨髓MSC傳代培養24 h后的MTT試驗吸光值
結果如圖5所示,在傳代培養的第3代人骨髓MSC培養體系中加入濃度為10-12~10-9mol/L的AcSDKP,24 h后做MTT檢測,AcSDKP各濃度組的吸光值(A值)均明顯低于對照組(P<0.01 或P<0.05),10-11mol/L濃度組的A值最低.
3 討論
干細胞的增殖受多種調控因素的影響,其中細胞因子的作用尤為重要.AcSDKP對造血干/祖細胞的增殖具有負調控作用[9-10];但對白血病細胞及HL-60細胞的增殖無明顯抑制作用[11].人們希望將AcSDKP用作抗癌治療的干細胞保護劑.我室最近的工作發現,濃度為10-12~10-9mol/L的AcSDKP能抑制小鼠和人骨髓間充質干細胞的增殖,最大效應濃度為10-11mol/L[7].但AcSDKP抑制細胞增殖的作用機制目前尚不十分清楚,在本研究中,從細胞周期、細胞貼壁等方面進行了初步探討.
BrdU摻入法是一種常用的細胞周期分析方法.傳代培養第3代的人骨髓MSC的BrdU摻入試驗結果顯示,AcSDKP為10-11~10-9mol/L 范圍內的各濃度組的S期細胞,與對照組比較顯著減少.這說明了該濃度范圍內的AcSDKP可以通過阻止人MSC進入S期.FCM檢測了不同濃度AcSDKP培養條件下人骨髓MSC各時相細胞的百分率,結果顯示AcSDKP添加組的S+G2/M期細胞的比率降低,G0/G1期細胞明顯增加,進一步表明AcSDKP能通過阻止人MSC進入S期,使其停留在G0/G1期,且最大效應濃度為10-11mol/L,與前期實驗結果一致[7].這些結果與Jackson等[3,12]的報道AcSDKP對其他細胞的抑制作用相近.另外,由于AcSDKP是血管緊張素I轉換酶(ACE)的一種生理底物,在該酶的作用下,AcSDKP降解失活.卡托普利是ACE抑制劑,預實驗表明卡托普利對人骨髓MSC的生長無明顯影響.考慮到培養體系中血清成分含有ACE,貼壁細胞也能表達ACE,因此,在培養體系中加入AcSDKP的同時,也加入卡托普利,以維持AcSDKP在體系中的濃度.
Bonnet等[12]還報道,在人骨髓長期培養中加入AcSDKP,非黏附貼壁層的造血祖細胞減少,停止加入AcSDKP后兩周,祖細胞數恢復到對照組水平.在本研究中作者也觀察到,AcSDKP在人骨髓MSC集落培養體系中作用一段時間后,通過換液撤除,MSC集落生成能夠在一定程度上得到恢復,說明AcSDKP對MSC的增殖抑制作用也是可逆的,其作用停止后,細胞恢復生長,提示停滯在G0/G1期細胞重新進入了S期.
Robinson 等[13]在AcSDKP與細胞生長刺激因子共用于培養的實驗結果提示,AcSDKP不是直接對造血干/祖細胞起作用而影響它們在S期的數量和比例,而是阻斷細胞增殖刺激因子的作用,阻止靜止狀態的細胞進入細胞周期.在本研究中,MSC增殖所需要的生長因子主要由FBS提供,作者在不同的FBS濃度的培養體系中加入了該因子,觀察MSC集落的變化.結果表明,FBS為10%、20%、30%的培養條件下,AcSDKP抑制MSC集落的生成,集落生成數顯著減少,但抑制率隨FBS的濃度升高而降低;而FBS濃度為40%時,AcSDKP對MSC集落生成無明顯影響.這些結果提示,AcSDKP阻遏細胞生長刺激因子的作用,可能是其抑制MSC集落生成的機制之一.另外,AcSDKP還可能通過對抗促貼壁因子的作用,而抑制MSC的增殖.MSC的生存和生長具有停泊依賴性,作者前期實驗發現MSC在一般情況下培養24 h會有90%以上的細胞貼壁.本實驗中,作者在培養MSC 24 h后,去除未貼壁細胞,用MTT檢測其貼壁的活力細胞數,發現添加AcSDKP組的貼壁細胞數明顯少于對照組,提示AcSDKP影響了MSC的貼壁,但這種作用是因為抑制了膠原等ECM(細胞外基質)分子及CAM(細胞黏附分子)的合成,還是對抗了血清中促貼壁因子的作用,都有待進一步的研究證實.
參考文獻:
[1] FRINDEL E,GUIGON M. Inhibition of CFU entry into cycle by a bone marrow extract[J]. Exp Hematol,1977, 5(1): 74-76.
[2] ROBINSON S, LENFANT M, WDZIECZAK-BAKALA J,etal. The molecular specificity of action of the tetrapeptide acetyl-N-Ser-Asp-Lys-Pro (AcSDKP) in the control of hematopoietic stem cell proliferation[J]. Stem Cells, 1993, 11(5): 422-427.
[3] JACKSON J D, OZEROL E, YAN Y,etal. Activity of acetyl-Ser-Asp-Lys-Pro (AcSDKP) on human hematopoietic progenitor cells in short-term and long-term bone marrow cultures[J]. J Hematother Stem Cell Res, 2000, 9(4): 489-496.
[4] IWAMOTO N, XANO H J, YOSHIOKA T,etal. Acetyl-seryl-aspartyl-lysyl-proline is a novel natural cell cycle regulator of renal cells[J]. Life Sci, 2000, 66(15): 221-226.
[5] CHEN Y W, LIU B W, ZHANG Y J,etal. Preservation of basal AcSDKP attenuates carbon tetrachloride-induced fibrosis in the rat liver[J]. J Hepatol, 2010,53(3):528-536.
[6] CASTOLDI G, DI GIOIA C R, BOMBARDI C,etal. Prevention of myocardial fibrosis by N-acetyl-seryl-aspartyl-lysyl-proline in diabetic rats[J]. Clin Sci (Lond), 2009, 118(3):211-220.
[7] 戴 國,黃 暢,李 燁,等. AcSDKP抑制體外培養條件下人骨髓間充質干細胞的增殖[J]. 生理學報,2006,58(2):110-115.
[8] NAKAMURA S, TAKEDA Y, KANNO M,etal. Application of bromodeoxyuridine (BrdU) and anti-BrdU monoclonal antibody for the in vivo analysis of proliferative characteristics of human leukemia cells in bone marrows[J]. Oncology, 1991,48(4): 285-289.
[9] PITTENGER M F, MACKAY A M, BECK S C,etal. Multilineage potential of adult human mesenchymal stem cells[J]. Science, 1999,284(5 411): 143-147.
[10] JOSHI C, ENVER T. Molecular complexities of stem cells[J]. Curr Opin Hematol, 2003, 10 (3): 220-228.
[11] CASHMAN J D, EAVES A C, EAVES C J. The tetrapeptide AcSDKP specifically blocks the cycling of primitive normal but not leukemic progenitors in long-term culture: evidence for an indirect mechanism[J]. Blood, 1994, 84(5): 1 534-1 542.
[12] BONNET D, LEMOINE F M, PONTVERT-DELUCQ S,etal. Direct and reversible inhibitory effect of the tetrapeptide acetyl-N-Ser-Asp-Lys-Pro (Seraspenide) on the growth of human CD34+ subpopulations in response to growth factors[J]. Blood, 1993, 82(11): 3 307-3 314.
[13] ROBINSON S, LENFANT M, WDZIECZAK-BAKALA J,etal. The mechanism of action of the tetrapeptide acetyl-N-Ser-Asp-Lys-Pro (AcSDKP) in the control of haematopoietic stem cell proliferation[J]. Cell Prolif, 1992,25(6): 623-632.

