KDN-04B型定氮儀測定乳粉中蛋白質含量的研究
王英爽
(綏化市質量技術監督局北林區質檢所,黑龍江 綏化 152000)
衡量食品的營養成分時,要測定蛋白質含量。蛋白質含量測定方法,目前常用的有凱氏定氮法、雙縮脲法、紫外吸收法、考馬斯亮藍法等。測定乳粉中蛋白質常用凱式定氮法,此法雖有儀器設備簡單的優點,但它卻存在著操作繁瑣、費時、蒸餾過程易發生倒吸現象等不足;利用全自動凱氏定氮儀測定食品中蛋白質雖可較好完成分析,但價格昂貴不易于推廣。本文利用KDN-04B型定氮儀經過多次實驗表明,該儀器測定情況符合國標要求,且具有操作方便,穩定,耗時短,經濟適用等優點,測定結果較為滿意。
1 實驗原理
根據凱氏定氮法原理,食品與濃硫酸和催化劑共同加熱消化,使蛋白質分解,產生的氨與硫酸結合生成硫酸銨,然后加堿蒸餾使氨游離,用硼酸溶液吸收后,再用鹽酸標準溶液滴定,根據酸的消耗量乘以蛋白質換算系數,即得蛋白質含量。KDN-04B型定氮儀是根據凱氏原理而設計的,主要有樣品的消化和蒸餾二個操作步驟組成,前半個過程由KDN-04B型消化爐來進行,后半個工作過程由蒸餾器來完成,最終根據標準酸液消耗量計算出被測樣品的蛋白質含量。
2 儀器與試劑
儀器KDN-04B型定氮儀、KDN-04B型消化爐(帶消化管)、酸式滴定管25mL、三角燒瓶250mL、量桶50 mL。
試劑硫酸鉀、硫酸銅、硫酸、硼酸溶液(20g/L)、氫氧化鈉溶液(400 g/L)、0.1mol/L 鹽酸標準溶液、混合指示劑(把1g/L溴甲酚綠乙醇溶液5份和1g/L甲基紅乙醇溶液1份混合而成)。
3 操作步驟
樣品消化:精密稱取乳粉0.4g左右(約相當于蛋白質70-80mg)于干燥的消化管中,加入0.1gCuS04、3gK2SO4、10mL 濃 H2SO4搖勻。開始時用低溫加熱,待內容物全部炭化,泡沫停止后,再升高溫度保持微沸,消化至液體呈藍綠色澄清透明后,繼續加熱0.5h,取下放冷至室溫。
堿化蒸餾:量取硼酸溶液(20g/L)50mL于三角瓶中,加入混合指示劑2-3滴。開定氮儀,蒸汽發生器內注滿水,用氫氧化鈉溶液(400g/L)沖洗管路。放好接收瓶,將消煮管旋于定氮儀上,加氫氧化鈉溶液(400g/L)50ml,加熱蒸餾,待接收液達到150mL時,停止蒸餾。
樣品滴定:以0.1mol/L鹽酸標準溶液滴定至灰色為終點。根據酸的消耗量計算蛋白質的含量。同時按上述方法做試劑空白。
4 實驗結果
含量測定重復性及精密度試驗 取蛋白質含量不同的3種樣品。每一種樣品平行測6次,測定結果見表1,結果的相對平均偏差(RSD)均小于2.0%,表明此法重復性較好,精密度較高。
加樣回收率實驗 精密稱取已知含量樣品(樣品3含蛋白質18.9%即含氮2.96%),精密加入硫酸銨適量,按含量測定方法測定,以氮含量計算回收率。結果如下。
方法顯著性比較 用國標法中定氮裝置再分別測定實驗1中三個樣品的蛋白質含量結果見表3,結果表明,測定結果無顯著性差異(P=O.95時,對應的t值<4.30,符合要求)。
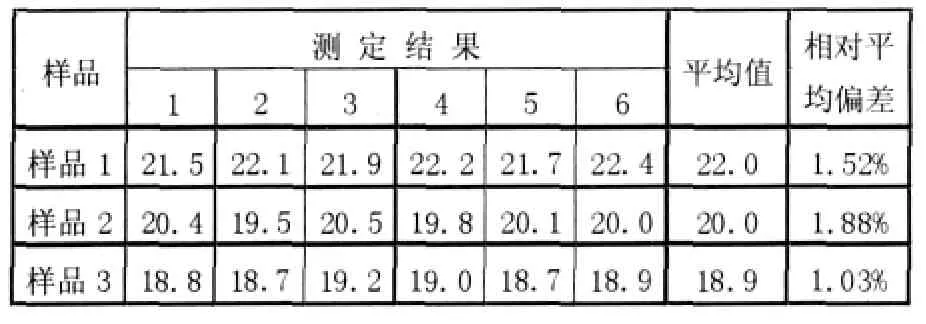
表1 重復性及精密度實驗結果
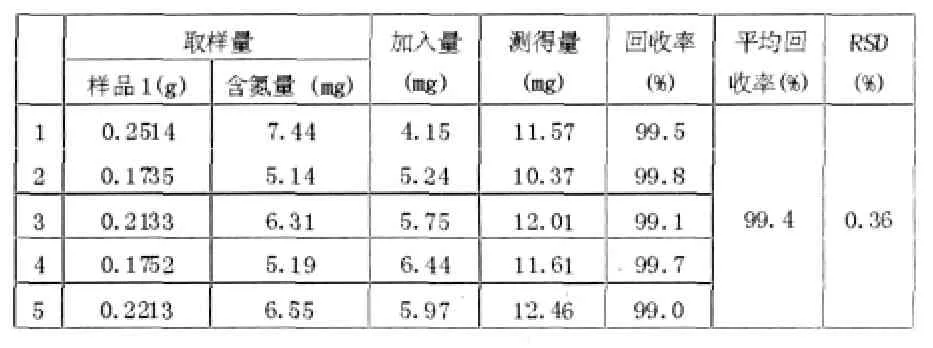
表2 回收率實驗結果
5 討論
5.1 實驗注意事項
消化時間要掌握好,時間過長會引起氨的損失;消化時間不夠,消化不完全也會導致總氮量偏低。
消化時,若樣品含糖高或含脂較多時,注意控制加熱溫度,可加入少量辛醇或液體石蠟,或硅消泡劑減少泡沫產生。
樣品放入消化管內時,不要沾附頸上,若沾附時可用少量水沖下,以免被檢樣消化不完全,結果偏低。
消化時若樣品不易消化至澄清透明,可將消化管中溶液冷卻,加入數滴過氧化氫后,再繼續加熱消化至完全。
硫酸鉀與硫酸用量的比值是消化成功的關鍵,它決定酸的沸點,也決定消化所需的時間。添加硫酸鉀可以提高溫度加快有機物分解,但硫酸鉀量過大,沸點太高,生成的硫酸氫銨就分解放出氨,使氮損失。因此當硫酸過多的被消耗或樣品中脂肪含量過高時,要增加硫酸的量。
消化時熱源的強度同迅速消化和完全氨化關系很大,在整個消化過程中,不要用強火,保持和緩的沸騰,以免附在壁上的蛋白質在無硫酸存在的情況下,使氮有損失。
將消化后的樣品管放入蒸餾室時,為避免蒸餾過程中溶液沸騰時溢出造成氨損失,在放置消化管至塑膠塞時用手輕旋一下消化管,使與膠塞接觸更加密閉。
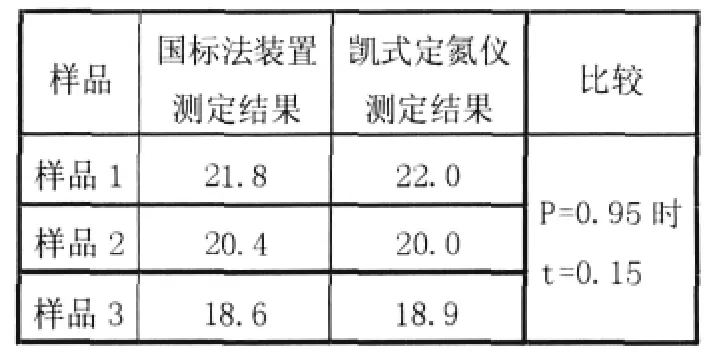
表3 顯著性比較
儀器使用前可先空蒸一段時間,以除去管道內可能殘留的氨,減少誤差。
定氮儀加堿管路使用前要用氫氧化鈉溶液沖洗,使用后要及時用蒸餾水反復沖洗,不能長期積有堿液,以免放置后管路堵塞。
5.2 結論
該方法測定乳粉中蛋白質含量,準確度及精密度均較高,與國標法裝置比較無顯著差異,且具有操作方便,穩定,耗時短,經濟適用等優點。
[1]GB/T 5413.1嬰幼兒配方食品和乳粉蛋白質的測定
[2]GB/T 5515谷物和豆類氮含量測定
[3]GB/T 5009.5食品中蛋白質的測定
[4]王東琴,國產凱氏定氮儀測定飼料中蛋白質的研究,河南農業2009.10

