重水環(huán)境下的氧化大豆蛋白傅里葉變換紅外(FT-IR)分析
黃友如華欲飛張根華費 薇閔 嫻
(常熟理工學院生物與食品工程學院1,常熟 215500)
(江南大學食品學院2,無錫 214036)
重水環(huán)境下的氧化大豆蛋白傅里葉變換紅外(FT-IR)分析
黃友如1華欲飛2張根華1費 薇1閔 嫻1
(常熟理工學院生物與食品工程學院1,常熟 215500)
(江南大學食品學院2,無錫 214036)
應用傅里葉變換紅外研究了不同亞油酸濃度下脂肪氧合酶催化誘導產(chǎn)生的大豆蛋白聚集體的結(jié)構(gòu)變化。結(jié)果表明,由LOX催化LA氧化誘導的大豆蛋白質(zhì)聚集,反映在紅外光譜中,具有兩個較為明顯的特征,一是 1 610 cm-1(RSP4和 RSP5)或 1 615 cm-1(RSP2和 RSP3)附近譜峰分量的出現(xiàn),二是酰胺 I′各譜峰分量向低波數(shù)方向位移。此結(jié)論是在對反應體系中LA濃度在 3.14×10-3~7.51×10-3mol/L范圍之間的反應樣品研究后得出的,說明反應體系中LA濃度不同,蛋白質(zhì)分子間相互作用的強度不同;由于分子間β-折疊的形成與蛋白質(zhì)分子間較強的相互作用有關(guān),這些特征譜峰的出現(xiàn)反映了因氧化性修飾而發(fā)生聚集的蛋白質(zhì)分子之間氫鍵作用的加強。
大豆蛋白 脂肪氧合酶 亞油酸 氧化性修飾 FT-I R
通過建立由脂肪氧合酶 (lipoxygenase,LOX)、亞油酸 (linoleic acid,LA)和低脂質(zhì)含量大豆蛋白(lipid-reduced soy proteins,LRSP)組成的三元模擬體系,分析研究了脂肪氧合酶催化亞油酸氧化誘導的大豆蛋白氧化性修飾機理[1],結(jié)合電子順磁共振波譜(EPR)研究了模擬體系中導致氧化性大豆蛋白聚集體形成的自由基由氧化亞油酸到大豆蛋白的遷移并確定了部分自由基的類型[2-3]。事實上,大豆蛋白聚集體的形成與蛋白質(zhì)本身結(jié)構(gòu)的變化有著密切的關(guān)系。研究清楚大豆蛋白結(jié)構(gòu)的變化,對進一步闡明大豆蛋白質(zhì)聚集體形成的分子機理,具有重要的意義。表征蛋白質(zhì)結(jié)構(gòu)變化的方法很多,其中傅里葉變換紅外 (FT-IR)、激光拉曼 (La2 ser Raman)光譜和圓二色性光譜 (CD)是進行這些研究的強有力工具,借助這些現(xiàn)代化測試儀器,可探討蛋白質(zhì)在經(jīng)過生物、物理和化學的方法處理后構(gòu)象和構(gòu)型的變化。
蛋白質(zhì)的二級結(jié)構(gòu)與其分子內(nèi)形成的不同氫鍵類型密切相關(guān),FT-IR光譜技術(shù)是研究氫鍵的強有力手段[4]。蛋白質(zhì)在紅外區(qū)有若干特征吸收帶,酰胺 I帶 (1 600~1 700 cm-1)對于研究二級結(jié)構(gòu)最有價值。與酰胺譜帶構(gòu)象敏感性有關(guān)的因素包括氫鍵和遷移偶極子間的偶聯(lián),偶極子間的偶聯(lián)使酰胺 I譜帶分裂,分裂的多少取決于相互作用的偶極子取向及距離,從而提供多肽鏈中肽單位的幾何空間排列信息。
應用傅里葉變換紅外波譜對大豆蛋白聚集體在不同狀態(tài)下的微區(qū)結(jié)構(gòu)和二級結(jié)構(gòu)進行測定分析,研究不同LA濃度下LOX誘導聚集過程中蛋白質(zhì)構(gòu)象的變化,進一步揭示大豆蛋白質(zhì)聚集體形成的分子機制。
1 材料和方法
1.1 材料和試劑
低溫脫脂豆粕:山東禹王實業(yè)有限公司植物油廠;脂肪氧合酶 (LOX I-B,70 800單位/mg)、亞油酸(色譜純,含量≥99.0%):Sigma公司;重水 (含重氫:99.8%,pD 6.8):北京化工廠;其他試劑均為分析純;FT-I R光譜儀:NicoletNexus 470 FT-I R spec2 trometer,Thermo Electron Corparation,USA。
1.2 低脂質(zhì)含量大豆蛋白的制備
[1-2]。
1.3 用于結(jié)構(gòu)分析的樣品制備
底物LA溶液和LOX酶液的配制見參考文獻[1 -2]。將 LRSP溶于去離子水中配制成 5%的大豆蛋白溶液,用 1.0 mol/L NaOH調(diào)至 pH 9.0。
模擬反應體系由LOX、LA和LRSP組成(表 1),將其反應體系放入 30℃的水浴中分別恒溫振蕩培養(yǎng) 6.0 h后取出,冰浴冷卻至 0℃后用 1.0 mol/L HCl調(diào) pH值至 4.5酸沉,離心 (5 000×g,30 min)取沉淀水洗,水洗后的蛋白沉淀分散于去離子水中并用1.0 mol/L NaOH調(diào)至pH 7.0。所得蛋白(Reacted soybean proteins,RSP)溶液分別冷凍干燥后粉碎并過80目標準篩。

表 1 模擬反應體系的組成
1.4 FT-IR光譜測定
樣品處理:將蛋白樣品分散在重水中配制成 10 mg/mL的溶液,分析前在 5℃下貯藏 48 h,以使 H/D能夠完全置換。利用 FT-IR光譜儀,采用表面衰減全反射采樣器 (ATR),在對光譜進行水汽和二氧化碳校正后,以D2O為背景掃描,在與樣品測定完全相同的環(huán)境下,室溫下敞開狀態(tài)收集 D2O譜圖作為D2O校正的參考光譜,使用儀器自備軟件 OMN IC數(shù)據(jù)處理軟件自動進行 D2O校正;再將樣品溶液均勻地鋪滿ATR采樣器附件的 ZnSe晶片上,在相同條件下進行掃描收集樣品光譜,掃描范圍 650~4 000 cm-1,掃描 256次,分辨率 4 cm-1。
紅外光譜數(shù)據(jù)處理利用儀器自備軟件 OMN IC E.S.P.對所得紅外光譜的酰胺各帶進行傅里葉去卷積處理[5-6],控制半峰寬 (FWHM)為 (18 ±0.3) cm-1,增強因子 (Enhancement factor)為 2.0。結(jié)合原始譜圖和去卷積譜得到的子峰峰位,進行相應二級結(jié)構(gòu)構(gòu)象指認。
2 結(jié)果與分析
2.1 豆蛋白酰胺 I′紅外頻率范圍及其對應的二級結(jié)構(gòu)指認
圖 1為在不同 LA濃度下反應產(chǎn)生聚集的大豆蛋白重水溶液的原始紅外圖譜。其中酰胺 I帶(1 600~1 700 cm-1,圖 1b)對于結(jié)構(gòu)分析最重要,這個帶 80%是來自于 C=O鍵上的伸縮振動,同時也和C=O旁的 C-N伸縮和 N-H彎折振動有關(guān),它對肽和蛋白質(zhì)的二級結(jié)構(gòu)的變化非常敏感[7]。在RSP1樣品的原始紅外光譜中,酰胺 I帶呈現(xiàn)為一個寬峰,最大吸收波長在 1 637 cm-1。實際上酰胺 I帶是由蛋白質(zhì)不同二級結(jié)構(gòu)的譜峰分量疊加形成的[8-9]。
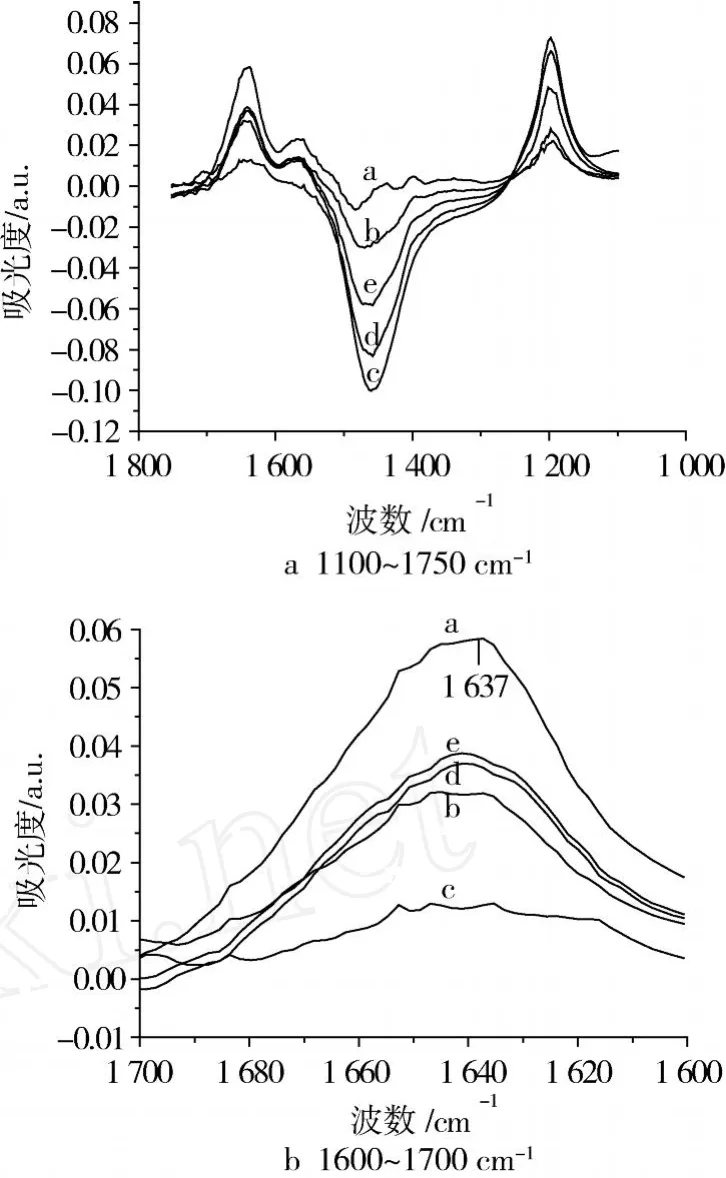
圖 1 溶于重水溶液大豆蛋白的原始紅外圖譜

圖 2 溶于重水溶液的大豆蛋白酰胺 I′的傅里葉紅外去卷積譜
圖 2a為溶于重水溶液的大豆蛋白酰胺 I′的傅里葉去卷積譜。其不同譜峰分量對應為大豆蛋白各結(jié)構(gòu)部分的振動,這些區(qū)帶是與特異的二級結(jié)構(gòu)相對應的。在蛋白質(zhì)濃度為 10 mg/mL時,大豆蛋白的酰胺 I′主要有以下幾個特征性譜峰,即 1 695 cm-1(β-折疊),1 684 cm-1(β-折疊或轉(zhuǎn)角),1 670 cm-1(β-轉(zhuǎn)角),1 661 cm-1(β-轉(zhuǎn)角),1 649 cm-1(無規(guī)卷曲 +α-螺旋),1 637和 1 615 cm-1(β-折疊),以及 1 605 cm-1附近歸屬于側(cè)鏈殘基的一個肩峰(表 2)[10-17]。從圖 2可以看出,反應后大豆蛋白的酰胺 I′已發(fā)生了很大的變動。關(guān)于 1 670~1 695 cm-1區(qū)域帶的歸屬問題,目前尚存爭議,有人將其歸屬于β-轉(zhuǎn)角,也有人認為應將其歸屬于反平行β-折疊結(jié)構(gòu)[18]。因此,高頻組分 1 684和 1 678 cm-1譜峰應引起特別的注意。這兩個譜峰分量可歸屬于β -轉(zhuǎn)角(可能是交聯(lián)在一起的β-折疊股,也就是β -折疊結(jié)構(gòu)本身的一部分),也可歸屬于反平行β-折疊結(jié)構(gòu)。在含有反平行β-折疊結(jié)構(gòu)的蛋白質(zhì)中,高頻β-折疊組分通常比β-折疊主要組分高 50~70 cm-1[19]。
在樣品 RSP2和 RSP3中,當反應體系中的 LA濃度從 3.14 mmol/L升高到 4.63 mmol/L時,位于1 695 cm-1附近的譜峰強度增加很快。與此同時,除了 RSP3樣品位于 1 615 cm-1附近的譜峰強度保持不變外,位于 1 684,1 670,1 649,1 637和 1 605 cm-1附近的其他譜峰的強度均明顯降低。位于1 615 cm-1附近的譜峰為分子間β-折疊結(jié)構(gòu)的特征組分,是由于蛋白質(zhì)分子聚集而產(chǎn)生的[20-21],說明反應后 RSP3樣品的聚集程度明顯,蛋白分子間β -折疊結(jié)構(gòu)增加。此外,在樣品 RSP3中,在 1 615~1 637 cm-1范圍出現(xiàn)了一個單個譜峰 (1 623 cm-1),且 1 691 cm-1譜峰位移至 1 689 cm-1。在前面的分析中已經(jīng)證實,在與 LOX催化產(chǎn)生的LA氧化產(chǎn)物反應后,樣品 RSP2和 RSP3業(yè)已形成聚集體[1]。尤其是 RSP3樣品,其聚集程度隨著LA濃度增加而明顯增強。這里的紅外結(jié)果表明,沒有發(fā)生聚集的大豆蛋白的紅外光譜在 1 610~1 637 cm-1范圍僅出現(xiàn)一個譜峰,而發(fā)生聚集的大豆蛋白在此范圍內(nèi)則出現(xiàn)兩個譜峰。在其它蛋白質(zhì)的紅外光譜中也觀察到1 623 cm-1附近的譜峰[22],通常將它歸屬于強烈鍵合或扭曲的β-折疊股(β-strand)結(jié)構(gòu)。也就是說,這些譜帶可能產(chǎn)生于一些短的肽段,這些肽段是一種伸展結(jié)構(gòu),但并未形成一般意義上的β-結(jié)構(gòu)。我們的解釋與此結(jié)論相一致,即 1 623 cm-1附近譜峰的產(chǎn)生是由于大豆蛋白在聚集體形成過程中而產(chǎn)生的強烈鍵合β-折疊股結(jié)構(gòu)引起的。正如前面分析的那樣,由LOX催化LA氧化誘導產(chǎn)生的聚集伴隨著蛋白質(zhì)構(gòu)象的轉(zhuǎn)變[1]。隨著反應體系 LA濃度的增加,反應后大豆蛋白紅外光譜的差異說明其蛋白質(zhì)構(gòu)象業(yè)已發(fā)生轉(zhuǎn)變。
β-折疊是由于局部的協(xié)同性氫鍵形成產(chǎn)生,在球狀蛋白質(zhì)中,氫鍵既可以在不同肽鏈或不同分子之間形成,也可以在同一肽鏈的不同肽段(β-strand)之間形成。反應后大豆蛋白紅外光譜1 610~1 637 cm-1范圍的變化,反映了氫鍵在大豆蛋白聚集體形成過程中發(fā)揮著重要的作用。

表 2 溶于重水溶液的大豆蛋白酰胺 I,II,III紅外頻率范圍及其對應的二級結(jié)構(gòu)指認
在 RSP4和 RSP5樣品中,上述所提及的所有譜峰均向較低波數(shù)方向位移。位于 1 691和 1 678 cm-1附近譜峰強度明顯增加,相反位于 1 641和1 630 cm-1附近譜峰強度則降低了。但樣品 RSP5位于 1 660 cm-1附近譜峰強度保持不變。這表明反應后樣品的β-折疊和轉(zhuǎn)角結(jié)構(gòu)增加,α-螺旋或無規(guī)卷曲結(jié)構(gòu)降低了。如前所述,包括疏水效應,氫鍵和靜電相互作用在內(nèi)的物理相互作用在蛋白質(zhì)聚集過程中,扮演著非常重要的角色。RSP4和 RSP5樣品各譜峰分量發(fā)生位移說明反應后的大豆蛋白結(jié)構(gòu)已發(fā)生改變,在隨后的聚集體形成過程中蛋白質(zhì)的構(gòu)象進行了重排。隨著反應體系LA濃度的增加,位于1 691和 1 678 cm-1附近譜峰強度的增加同時也表明此類蛋白質(zhì)聚集程度增強。
位于 1 684和 1 623 cm-1附近的兩個組分峰,一般與聚集蛋白質(zhì)分子間反平行β-折疊結(jié)構(gòu)的形成有關(guān)[23]。由此看來,在 LOX催化的高濃度 LA反應體系中的大豆蛋白似乎解折疊并發(fā)生聚集。這些數(shù)據(jù)與前面的研究結(jié)論相一致,即在高濃度LA反應體系中的大豆蛋白易于發(fā)生變性[1]。
2.2 大豆蛋白酰胺 II′紅外頻率范圍及其對應的二級結(jié)構(gòu)指認
圖 3為溶于重水溶液的大豆蛋白酰胺Ⅱ′的傅里葉去卷積譜。從圖 3中可以看出,α-螺旋位于1 520 cm-1附近,譜峰強度較弱;而位于 1 543、1 559 cm-1附近分別代表β-折疊、α-螺旋/無規(guī)卷曲結(jié)構(gòu)的譜峰均十分清晰。與對照樣品相比,樣品酰胺II′也有明顯的變化,主要表現(xiàn)在各特征譜峰向低波數(shù)方向位移且強度減弱。特別是 RSP4和 RSP5樣品各譜峰分量位移的幅度較大(可達 6~9 cm-1),各譜峰峰形也出現(xiàn)明顯差異;如位于 1 520 cm-1附近的α-螺旋譜峰,已位移至 1 513 cm-1且峰形尖銳;位于 1 543 cm-1附近代表β-折疊譜峰位移至 1 530 cm-1且峰形變寬;位于 1 572 cm-1附近代表β-折疊的譜峰位移至 1 564 cm-1,且峰形由對照樣品的肩峰凸顯為一個明顯的吸收峰。RSP4和 RSP5樣品各譜峰分量的變化,反映了反應后的蛋白質(zhì)構(gòu)象已發(fā)生了明顯的變化,表現(xiàn)為β-折疊結(jié)構(gòu)的相對增加,α-螺旋和無規(guī)卷曲等結(jié)構(gòu)的相對減少。RSP2和 RSP3樣品也出現(xiàn)類似的情況,即β-折疊結(jié)構(gòu)相對增加, α-螺旋/無規(guī)卷曲等結(jié)構(gòu)相對減少。

圖 3 溶于重水溶液的大豆蛋白酰胺Ⅱ′的傅里葉紅外去卷積譜
2.3 大豆蛋白酰胺ⅢI′紅外頻率范圍及其對應的二級結(jié)構(gòu)指認
圖 4為溶于重水溶液的大豆蛋白酰胺Ⅲ′的傅里葉去卷積譜。相比之下,大豆蛋白紅外光譜的酰胺Ⅲ′較弱,沒有酰胺Ⅰ′那么顯著。但在酰胺Ⅲ′中位于 1 236 cm-1附近代表β-折疊的譜峰分量較為清晰,與對照樣品相比,RSP2和 RSP3樣品在該區(qū)域譜峰向低波數(shù)方向位移且強度增加,說明反應后樣品的β-折疊結(jié)構(gòu)有所增加。位于 1 261、1 250 cm-1附近代表無規(guī)卷曲結(jié)構(gòu)的譜峰變寬甚至形成微小的肩峰。而位于 1 286~1 317 cm-1之間代表α-螺旋的譜峰最弱,它在反應后的樣品中形成微小的肩峰乃至消失。RSP4和 RSP5樣品也有類似的變化,不同的是各譜峰分量向低波數(shù)方向位移的數(shù)值增加,差值可達 5~9 cm-1。

圖 4 溶于重水溶液大豆蛋白酰胺Ⅲ′的傅里葉紅外去卷積譜
綜合酰胺各帶的變化,可以得出,由LOX催化LA氧化誘導的大豆蛋白質(zhì)聚集,反映在紅外光譜中,具有兩個較為明顯的特征,一是 1 610 cm-1(RSP4和RSP5)或 1 615 cm-1(RSP2和 RSP3)附近譜峰分量的出現(xiàn),二是酰胺Ⅰ′各譜峰分量向低波數(shù)方向位移。上述結(jié)論是在對反應體系中LA濃度在 3.14×10-3~7. 51×10-3mol/L范圍之間的反應樣品研究后得出的,說明反應體系中LA濃度不同,蛋白質(zhì)分子間相互作用的強度不同;由于分子間β-折疊的形成與蛋白質(zhì)分子間較強的相互作用有關(guān),這些特征譜峰的出現(xiàn)反映了聚集蛋白質(zhì)之間氫鍵作用的加強。
3 結(jié)論
應用 FTI R研究了不同亞油酸濃度下脂肪氧合酶催化誘導產(chǎn)生的大豆蛋白聚集體的構(gòu)象變化。該技術(shù)提供了大豆蛋白分子結(jié)構(gòu)的詳細信息,使得對大豆蛋白聚集體的形成有了新的理解。結(jié)果表明,當大豆蛋白與脂肪氧合酶催化的亞油酸反應時,通過氫鍵形成的分子間β-折疊結(jié)構(gòu)在蛋白質(zhì) -蛋白質(zhì)相互作用和聚集體形成中發(fā)揮著重要的作用。通過β-折疊譜帶頻率的變化與大豆蛋白不同聚集程度的比較研究,揭示了聚集蛋白質(zhì)的構(gòu)象變化與大豆蛋白的聚集程度密切相關(guān)。大豆蛋白的聚集程度不僅受亞油酸濃度的影響,而且也與反應后蛋白質(zhì)的分子定向有關(guān)。
參考文獻
[1]黃友如,華欲飛,裘愛泳.脂質(zhì)氧化誘導的大豆蛋白質(zhì)聚集機理的研究.中國糧油學報,2006,21(1):80-87
[2]黃友如,華欲飛,顧建華,等.脂肪氧合酶催化亞油酸氧化與大豆蛋白相互作用過程中自由基遷移的電子順磁共振研究(I)自由基的檢測 [J].食品科學,2008,29(3): 87-93
[3]黃友如,華欲飛,王雪峰,等.脂肪氧合酶催化亞油酸氧化與大豆蛋白相互作用過程中自由基遷移的電子順磁共振研究(II)自由基類型的確定[J].食品科學,2008,29 (4):41-45
[4]謝孟峽,劉媛.紅外光譜酰胺 III帶用于蛋白質(zhì)二級結(jié)構(gòu)的測定研究[J].高等學校化學學報,2003,24(2):226-231
[5]Iconomidou V A,ChryssikosD G,GionisV M A,et al.Sec2 ondary structure of chorion proteinsof the teleostean fishDen2 tex dentex by ATR FT-IR and FT-Raman Spectroscopy [J].Journal of StructuralBiology,2000,132:112-122
[6]Ni F,Scheraga H A.Resolution enhancement in spectroscopy bymaximum entropy Fourier self-deconvolution,with appli2 cations to Raman spectra of peptides and proteins[J].Jour2 nal of Raman Spectroscopy,1985,16:337-349
[7]BylerD M,Susi H.Examination of the secondary structure of proteins by deconvolved FTIR spectra[J].Biopolymers, 1986,25(3):469-487
[8]SurewiczW K,Mantsch H H.New insight into protein sec2 ondary structure from resolution-enhanced infrared spetra [J].Biochimica etBiophysica Acta,1988,952:115-130
[9]Hilderson H J,Ralston GB.Physicochemicalmethods in the study of biomembranes:Subcellular Biochemistry[M],New York:Plenum Press,1994:329
[10]Venyaminov S Y,Kalnin N N.Quantitative I R spectropho2 tometry of peptide compounds in water(H2O)solutions.I. Spectral parameters of amino acid residue absorption bands [J],Biopolymers,1990,30:1243-1257
[11]Venyaminov S Y,Kalnin N N.Quantitative I R spectropho2 tometry of peptide compounds in water(H2O)solutions.II. Amide absorption bands of polypeptides and fibrous proteins inα-,β-,and random coil conformations[J],Biopoly2 mers,1990,30:1259-1271
[12]Orfanidou C C,Hamodrakas S J,Chryssikos G D,et al. Spectroscopic studies of Manduca sexta and Sesamia nona2 grioides chorion protein structure[J],International Journal ofBiologicalMacromolecules,1995,17(2):93-98
[13]Griebenow K,Santos A M,Carrasquillo K G.Secondary structure of proteins in the amorphous dehydrated state probed by FTIR spectroscopy.Dehydration-induced struc2 tural changes and their prevention[J],The Internet Journal ofVibrational Spectroscopy,1999,3(1):1-34
[14]Krimm S,Bandekar J.Vibrational spectroscopy and confor2 mation of peptides,polypeptides,and proteins[J].Ad2 vances in Protein Chemistry,1986,38:181-364
[15]Singh B R,FullerM P,Schiavo G.Molecular structure of tetanus neurotoxin as revealed by Fourier transfor m infrared and circular dichroic spectroscopy[J],Biophysical Chem2 istry,1990,46:155-166
[16]Susi H,Byler D M.Protein structure by Fourier transform infrared spectroscopy:second derivative spectra[J].Bio2 chemical and Biophysical Research Communications,1983, 115:391-397
[17]SusiH,BylerD M.Resolution-enhanced Fourier transform infrared spectroscopy of enzymes[J].Methods in Enzymolo2 gy,1986,130:290-311
[18]Haris P I,Chapman D.The confor mational analysis of pep2 tides using Fourier transfor m I R spectroscopy[J],Biopoly2 mers,1995,37:251-263
[19]Jackson M,Mantsch H H.The use and misuse of FTI R spectroscopy in the deter mination of protein structure[J], Critical Reviews in Biochemistry and Molecular Biology, 1995,30(2):95-120
[20]Lefèvre T,SubiradeM.Structural and interaction properties ofβ-Lactoglobulin as studied by FTIR spectroscopy[J]. International Journal of Food Science and Technology, 1999,34(5/6):419-428
[21]Subirade M,Kelly I,Guéguen J,et al.Molecular basis of fil m formation from a soybean protein:comparison between the conformation of glycinin in aqueous solution and in films [J].International Journal of Biological Macromolecules, 1998,23:241-249
[22]Jackson M.Mantsch H H.Halogenated alcohols as solvents for proteins:FTIR spectroscopic studies[J].Biochimica et Biophysica Acta,1992,1118:139-143
[23]Clark A H,Saunderson D H P,SuggettA.Infrared and la2 ser-Raman spectroscopic studies of thermally-induced globular protein gels[J].International Journal of Peptide and Protein Research,1981,17:353-364.
FT-IR SpectroscopyAnalysis ofOxidative Soybean Proteins in D2O
Huang Youru1Hua Yufei2Zhang Genhua1FeiWei1Min Xian1
(School ofBiological Science and Food Engineering,Changshu Institute of Technology1,Changshu 215500)
(School of Food Science and Engineering,Jiangnan University2,Wuxi 214036)
The molecular structure of soybean protein aggregates for med at different linoleic acid concentration catalyzed by lipoxygenasewere examined by FT-IR.Results:The linoleic acid-induced aggregation of soybean pro2 teins is characterized by the appearance of a component located near 1 610 cm-1in samples RSP4 and RSP5,or near 1 615 cm-1in samples RSP2 and RSP3,and by another fact that all of the amide I′components shift to lowerwave numbers in the samples.Thisobservation ismade at the linoleic acid concentrations bet ween 3.14×10-3and 7.51× 10-3mol/L,suggesting that the intensity of the intermolecular interactions are different in the samples.Since the for2 mation of intermolecularβ-sheets seems to be involved in stronger interactions bet ween proteins,the appearance of the characteristic components is a result of strengthening of H-bonds between aggregated proteinsmodified by linole2 ic acid oxidation.
soybean protein,lipoxygenase,linoleic acid,oxidative modification,FT-IR
TS201.2+1;TQ645.9+9 文獻標識碼:A 文章編號:1003-0174(2010)05-0019-06
國家自然科學基金(20476040)
2009-05-27
黃友如,男,1966年出生,副教授,博士,糧食、油脂及植物蛋白工程

