高效液相色譜法快速測定醬腌菜中的姜黃素
張書芬,蘆江會,王全林,沈 堅
(寧波市產品質量監督檢驗研究院,浙江 寧波 315041)
高效液相色譜法快速測定醬腌菜中的姜黃素
張書芬,蘆江會,王全林,沈 堅
(寧波市產品質量監督檢驗研究院,浙江 寧波 315041)
為探討用高效液相色譜法快速測定醬腌菜中姜黃素的方法,對提取條件、提取方法、流動相等進行優化實驗。結果表明:采用ZORBAX SB C18(150mm×4.6mm,5 μ m)分析柱,磷酸溶液(pH2.5)-乙腈(50:50,V/V)為流動相,420nm的檢測波長可以達到理想的分離效果和滿意的檢出限;該法重復性好,定量檢出限為1.5mg/kg、線性范圍為1.5~2900.0mg/kg、加標回收率均在95%~108%之間、相對標準偏差均在0.9%~1.6%(n=5)之間。超聲提取法和保溫振蕩浸提法是提取醬腌菜中姜黃素的簡單高效的方法。
高效液相色譜法;快速測定;醬腌菜;姜黃素
姜黃素是一種優良的著色劑,是大自然中極為少見的二酮類有色物質,其染色能力大于其他天然色素和人工合成色素檸檬黃、日落黃等。國家標準(GB 2760—2007《食品添加劑使用衛生標準》[1])中規定姜黃及姜黃素允許在醬腌菜、調制乳粉、冷凍飲品、糕點、飲料、調味料等產品中使用,同時限制了相應的最大使用量,其最大允許使用限量根據食品種類的不同從0.01mg/kg到0.7mg/kg,其中姜黃的檢出量以姜黃素計。
目前我國還沒有檢測姜黃素的國家標準方法,相關文獻報道測試姜黃和姜黃素的方法有高效液相色譜法[2-3]、毛細管電泳法[4]、紫外-可見分光光度法[5]、熒光分光光度法[6]、薄層掃描法[7]、極譜催化法[8]等。其中以高效液相法最為普遍。絕大多數文獻報道的均為檢測中藥和保健品中的姜黃素的方法,其前處理只對樣品進行甲醇溶解就直接上機進行分析,沒有相應的前處理過程。2008年施冰[9]發表了食品中姜黃素的測定方法,其前處理主要是參照GB 5009.35—2003《食品中合成著色劑的測定》[10]的前處理方法,前處理非常麻煩,更適合那些復雜基質產品中姜黃素的測定的前處理。對于醬腌菜這類樣品基底不是非常復雜,色素比較容易提取的樣品來說太過繁瑣,在實際檢測工作中實用性不強。本實驗針對醬腌菜樣品,建立一種快速測定姜黃素的方法。
1 材料與方法
1.1 材料、試劑與儀器
姜黃素標樣 上海安譜公司;超純水;甲醇、乙腈(均為色譜純) 默克公司;其他試劑均為分析純。
1.2 色譜分析條件
色譜柱為SB C18(250mm×4.6mm,5μm)不銹鋼分析柱;流動相為磷酸溶液(pH2.5)-乙腈(50:50,V/V);流速:0.8mL/min;柱溫:35℃;檢測器波長:420nm;進樣量20μL。
1.3 標準溶液的配制
準確稱取姜黃素標準品,用甲醇溶解并定容至50mL,配制成姜黃素的含量為500mg/L標準貯備液,用乙醇-水(80:20,V/V)稀釋標準儲備液,配制成質量濃度為100mg/L標準使用液,4℃冰箱保存。
分別吸取1.0、2.0、5.0、10.0、20.0、50.0mL標準使用液,以乙醇-水(80:20,V/V)定容到100.0mL,配制成質量濃度1.0、2.0、5.0、10.0、20.0、50.0mg/L的標準系列溶液。
1.4 樣品處理方法與測定
稱取已經打碎均勻化處理的醬腌菜樣品2.50g,置于50.0mL離心管中,加入乙醇-水(80:20,V/V)溶液定容至25mL,在70℃水浴振蕩器上振蕩提取30min,然后取出離心管, 10000r/min離心5min,取上清液過0.45μm的混合纖維素膜,上高效液相色譜分析,標樣測試譜圖如圖1所示。
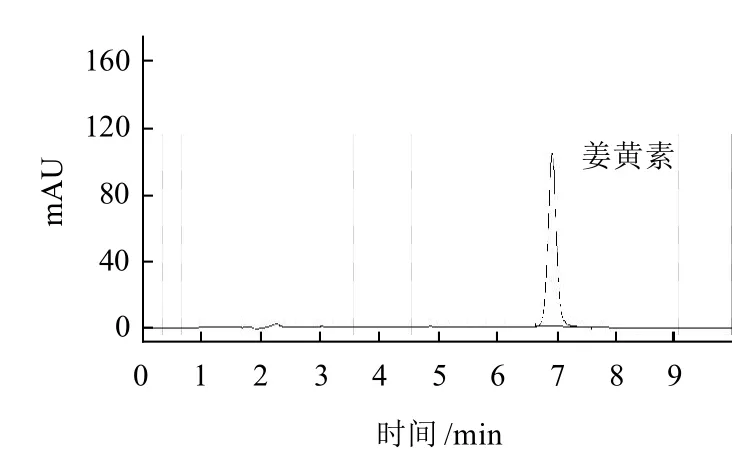
圖1 姜黃素的高效液相色譜標準譜圖Fig.1 HPLC chromatogram of curcumin standard solution
2 結果與分析
2.1 提取條件的選擇
食品中提取姜黃素的文獻報道很少,提取姜黃中姜黃素的方法有甲醇、乙醇有機溶劑提取法、堿水熱提法、酶解提取法、外場輔助提取法等[11],陳雁虹[12]等對不同條件的提取方法進行比較,結果用80%乙醇溶液溫浸提法得到的提取效率最高,這和劉碩謙[13]的研究成果基本一致,80%左右的乙醇溶液提取率最高,可能是一定量的水有助于樣品的浸泡,使提取試劑滲入到食品中,從而加速姜黃素類化合物的溶出。
本研究采用80%乙醇溶液,針對實際醬腌菜樣品,對回流法、超聲提取法、保溫振蕩浸提法、聚酰胺粉吸附法分別進行實驗。
將一定量的醬腌菜樣品均質打碎后,取出一定量樣品加標混勻,分別用不同的前處理方法進行處理,上機分析,檢測回收率,回流法采用80%乙醇溶液浸泡回流,超聲提取法采用輻射功率200W、輻射溫度60℃,保溫振蕩提取法采用70℃、200r/min,參照GB/T 5009.35—2003《食品中合成著色劑的測定》方法進行聚酰胺粉的吸附脫附處理實驗。
由于醬腌菜樣品基體比較簡單,不屬于高脂肪髙蛋白樣品,含水量一般在80%以上,比較容易提取,所以4種提取方法都能保證檢測回收率在90%以上。對除聚酰胺粉法外的3種前處理方法還進行提取時間的優化試驗(圖2),結果表明3種前處理方法經過30min提取后處理回收率均能達到9 0%以上,再延長提取時間到35min時,提取效率沒有明顯增加,因此本研究提取時間選定為30min。聚酰胺粉吸附法處理步驟繁瑣,有經驗的操作人員才能達到90%以上的回收率,而且一般需要3h以上的前處理時間,而回流提取方法要用到回流裝置,控制水電,操作也相對復雜,所以超聲提取法和保溫振蕩浸提法是提取醬腌菜中姜黃色素的簡單高效的提取方法,檢測工作者可以根據本單位的設備情況,選擇使用不同的前處理方法。本實驗采用的是保溫振蕩浸提法。

圖2 不同前處理方法的提取效率Fig.2 Effects of different pretreatments on extraction efficiency
2.2 過濾膜的選擇
由于浸泡液采用80:20乙醇-水,所以分別測試了0.45μm的纖維素膜、混合纖維素膜、聚四氟乙烯膜(PTFE)、聚偏氟乙烯膜(PVDF)和尼龍膜,其中一般的纖維素膜、尼龍膜對姜黃素有很大的吸附作用,嚴重的可以吸附50%左右。混合纖維素膜、聚四氟乙烯膜和聚偏氟乙烯膜都對處理后的樣品有較好的過濾作用,并不對目標化合物有吸附,考慮到價格因素,實驗采用混合纖維素膜作為過濾膜。
2.3 流動相的選擇
常用的測定色素的流動相有甲醇-乙酸銨體系、甲醇-乙酸鈉體系,對于姜黃素的測定,還有采用乙腈-酸性水溶液體系的報道[13],本實驗在參照文獻的基礎上嘗試用甲醇-0.02mol/L乙酸銨溶液、乙腈-磷酸溶液(pH2.5)、甲醇-磷酸溶液(pH2.5)3種體系做流動相時,姜黃的具體檢測和分離情況如圖3所示。
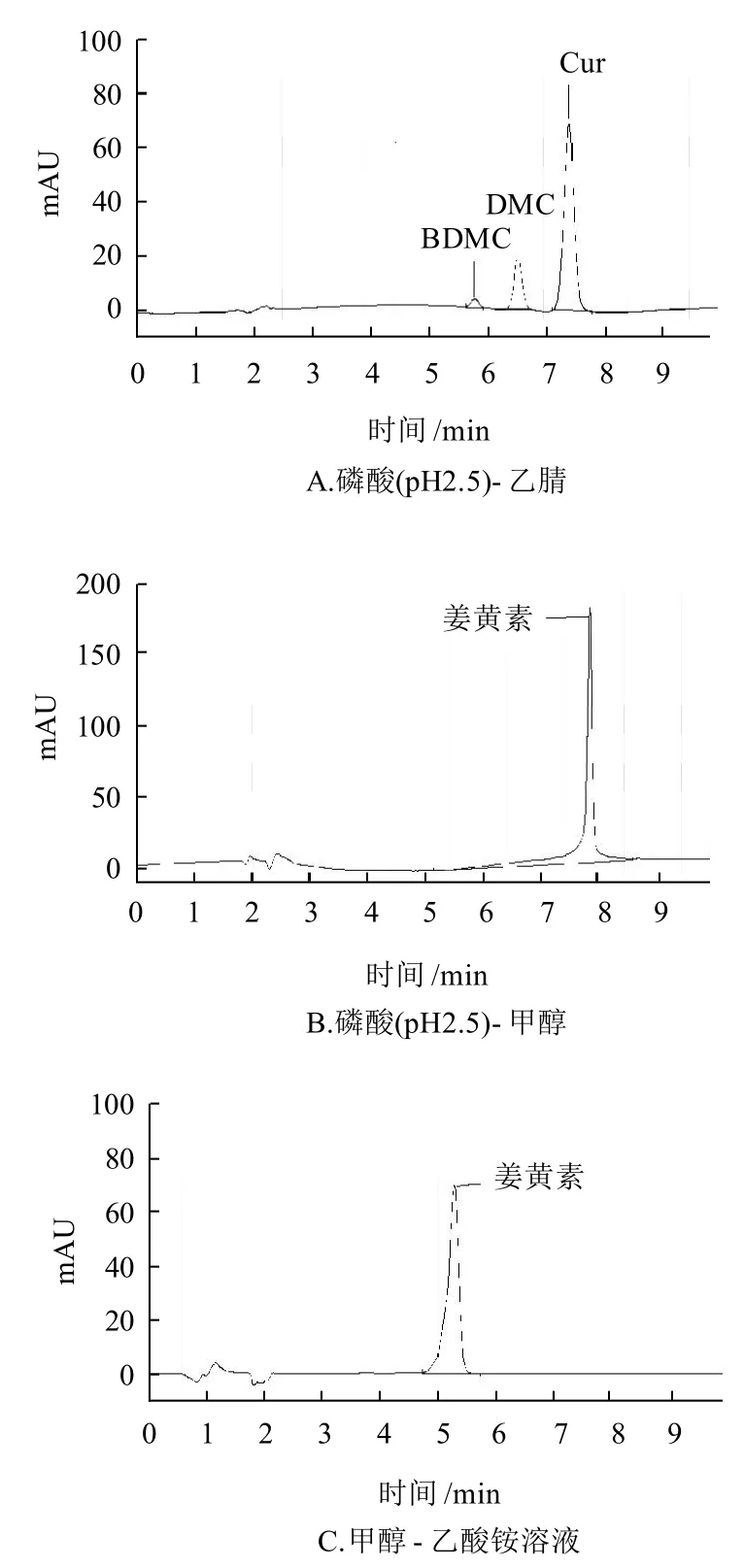
圖3 姜黃在不同流動相體系中的分離譜圖Fig.3 HPLC chromatogram of Curcuma longa L. under different mobile phase systems
姜黃的主要有效成分為姜黃素(Cur)、去甲氧基姜黃素(DMC)、去二甲氧基姜黃素(BDMC)[13],GB 2760—2007中規定,姜黃以姜黃素計。從圖3A可以看出,姜黃素峰型良好,而且能夠成功分離去甲氧基姜黃素、去二甲氧基姜黃素。對于實際樣品檢測時,一般都同時具有3個峰,可以增強定性功能;從圖3B可以看出,峰型前伸,峰里面可能包含了去甲氧基姜黃素、去二甲氧基姜黃素的組分;圖3C為甲醇-0.02mol/L乙酸銨體系下姜黃的響應譜圖,從圖3C可以看出,峰型不理想,有一個很大的前伸,峰型不對稱,而且也不能將3種組分分開,所以本實驗采用乙腈-磷酸溶液(pH2.5)體系作為檢測的流動相。
2.4 檢測波長的測定
對姜黃素標準溶液在200~600nm處進行掃描(圖4),發現其在420~430nm處有最大吸收,這和文獻報道基本一致。本實驗采用波長420nm檢測醬腌菜中的姜黃素,許多物質在該波長處均無響應,譜圖干擾比較少,增強了高效液相色譜的定性功能。
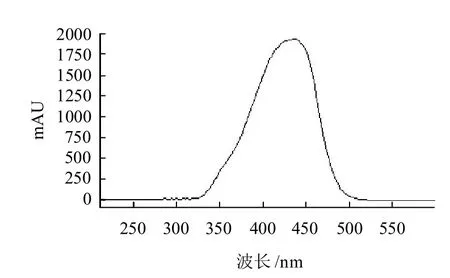
圖4 姜黃素的吸收光譜圖Fig.4 Absorption spectrum of curcumin
2.5 干擾性實驗
由于姜黃色素分子結構中含有多個雙鍵、酚羥基及羰基等,其化學反應能力較強,熱穩定性較好,不受Zn、Cu等金屬離子的影響,但有文獻報道[11]苯甲酸鈉、碳酸鈉可使姜黃色素的吸收峰有一定程度地增加,對其穩定性具有保護作用。由于目前我國生產的醬腌菜中大多數均添加了山梨酸鉀或苯甲酸鈉作為防腐劑,同時一般還添加了甜味劑和色素,故本實驗通過加標的方法考察了常見的防腐劑/甜味劑和色素對姜黃素測試造成的影響。
在醬腌菜樣品處理的測試液中添加100mg/山梨酸、苯甲酸、安賽蜜、糖精鈉、甜蜜素及10mg/L檸檬黃、日落黃、莧菜紅、胭脂紅、亮藍、靛藍6種色素,在本實驗選定的色譜條件下進行測試,結果表明,該質量濃度范圍內苯甲酸對姜黃素的測定無增強效應,其他的甜味劑和防腐劑在該條件下,在譜圖上均無響應,對姜黃素的測定和響應無干擾。
2.6 方法的線性范圍、檢出限、精密度、回收率
將儲備液配制成標準系列,在選定的條件下測定標準系列的峰面積(A)響應值,獲得姜黃素(n=6)的校準曲線回歸方程為A=110.78C-12.46,相關系數為0.99996。實驗表明,姜黃素在1.5~2900.0mg/kg范圍內與峰面積具有較好的線性關系。當信噪比(RSN)為3時,姜黃素的檢出限為1.5mg/kg。
在上述前處理和色譜條件下,分別在榨菜中添加標樣,進行不同水平的添加回收率和精密度實驗,其測試回收率在95%~108%之間,按標準方法平行測定5次,其相對標準偏差0.9%~1.6%之間,測定結果如表1所示。結果表明本法測定準確,加標回收效率高,精密度好,能夠很好地滿足于實際樣品的測定。
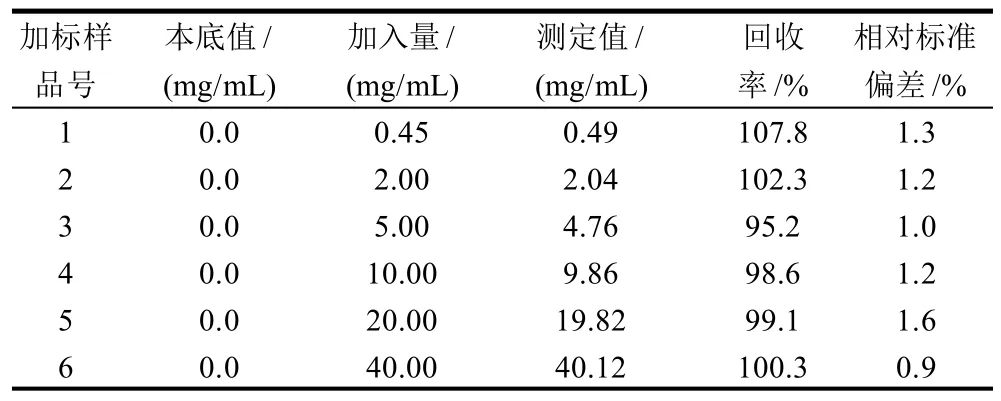
表1 快速測定醬腌菜中姜黃素方法的添加回收率和精密度(n=5)Table 1 Recovery rates and precision of rapid HPLC determination for curcumin in preserved vegetables (n=5)
3 結 論
本實驗針對醬腌菜中的姜黃素的測定,優化確定了相對簡單的前處理方法,不但前處理時間比傳統的聚酰胺粉吸附法大大縮短,而且回收率也有所高,大大的提高了檢測效率和準確度。同時本實驗通過對分離條件的優化選擇,確定了合適的分離條件,線性范圍較寬,靈敏度較高,能夠滿足食品安全監督檢測的需要。
[1] GB 2760—2007 食品添加劑使用衛生標準[S].
[2] 陳逸紅, 張芬娥, 王慧潔. HPLC測定如意金黃散中姜黃素的含量[J].中成藥, 2004, 26(12): 1075-1076.
[3] 李躍紅. 高效液相色譜法測定保健食品中姜黃素的含量[J]. 中國衛生檢驗雜志, 2006, l6(2): 204-205.
[4] 劉保啟, 胡孝忠, 王玉春, 等. 高效毛細管電泳法測定姜黃中姜黃素類化合物[J]. 分析測試學報, 2004, 23(1): 109-l11.
[5] 黃燕芬, 洪行球. 分光光度法酒定總姜黃素的含量及方法學考察[J].浙江中醫學院學報, 1999, 23(6): 24-25.
[6] 嚴建偉, 鮑慰文, 集炳圻, 等. 熒光分光光度法涸定姜黃制荊中的姜黃素[J]. 中國現代應用藥學, 1998, 15(2): 44-45.
[7] 吳桂碧. 薄層掃描法測定定姜黃中姜黃素的含量[J]. 華西藥學雜志,1995, 10(3): l72-l74.
[8] 程司, 劉智廣, 曹云新. 姜黃素的化學測定的新方法[J]. 第四軍醫大學學報, 2000, 21(2): 241-243.
[9] 施冰. 高效液相色譜法測定食品中的姜黃素[J]. 福建分析測試, 2008,17(3): 28-30.
[10] GB/T 5009.35—2003 食品中合成色素的測定[S].
[11] 張炎強, 李湘洲, 周雯雯. 姜黃色素的提取與研究進展[J]. 經濟林研究, 2006, 24(2): 74-77.
[12] 陳雁虹, 秦波, 張媛媛, 等. 姜黃素不同提取方法比較研究[J]. 中國中醫藥信息雜志, 2008, 15(7): 55-56.
[13] 劉碩謙, 劉仲華, 黃建安, 等. 反相高效液相色譜法同時測定姜黃藥材中三個組分的含量[J]. 分析化學, 2005, 33(3): 309-312.
Rapid Determination of Curcumin in Preserved Vegetables by High Performance Liquid Chromatography
ZHANG Shu-fen,LU Jiang-hui,WANG Quan-lin,SHEN Jian
(Ningbo Academy of Product Quality Supervision and Inspection, Ningbo 315041, China)
In this study, the rapid determination of curcumin in preserved vegetables by high performance liquid chromatogram(HPLC) was investigated. The extraction conditions, extraction methods and mobile phase selection were optimized. Results indicated that the optimal determination conditions were ZORBAX SB C18 (150 mm × 4.6 mm, 5 μm) as the chromatographic column, phosphorous acid solution (pH 2.5)-acetonitrile ratio of 50:50, and determination wavelength of 420 nm. Under the optimal determination conditions, ideal separation effect and satisfactory detection limit were achieved. This determination method is characteristics of good repeatability. Meanwhile, the detection limit and linear range of this method were 1.5 mg/kg and 1.5-2900.0 mg/kg, respectively. Recovery rate of this method was in the range of 95%-108% with relative standard deviation of 0.9%-1.6% (n=5).
high performance liquid chromatography (HPLC) method;rapid determination;preserved vegetables;curcumin
TS207.3
A
1002-6630(2010)24-0318-04
2009-09-15
張書芬(1977—),女,高級工程師,碩士研究生,研究方向為食品及相關產品的質量安全及檢測。E-mail:shufenzhang@hotmail.com

