剖析乙肝病毒的包膜
——乙肝表面抗原的生物學功能及其致病機制
田曉晨 聞玉梅
①講師,②中國工程院院士,復旦大學上海醫學院教育部/衛生部醫學分子病毒學重點實驗室,上海200032
剖析乙肝病毒的包膜
——乙肝表面抗原的生物學功能及其致病機制
田曉晨①聞玉梅②
①講師,②中國工程院院士,復旦大學上海醫學院教育部/衛生部醫學分子病毒學重點實驗室,上海200032
乙型肝炎病毒 表面抗原 病毒受體 致病機制
乙肝表面抗原作為病毒的包膜蛋白,在病人體內大量存在,甚至遠遠超過成熟病毒顆粒的含量。這表明表面抗原在乙肝病毒感染過程中具有特殊的作用,在乙型肝炎發病機制中扮演了重要的角色。筆者介紹了乙肝表面抗原在乙肝持續性感染致病機制方面的最新研究進展。
自1965年美國科學家Blumberg博士首次在澳大利亞土著人血清中發現“澳大利亞抗原”,并確定其為乙型肝炎的病毒標志物以來,人類與乙型肝炎病毒(hepatitis B virus,HBV)的斗爭已經持續了40余年。在這40多年里,科學家將乙肝病毒層層剖開,利用分子生物學和免疫學的手段對乙型肝炎的發病機制和臨床表現進行了廣泛的研究,在乙肝病毒的預防和治療方面都有了深入的認識和重大的突破。盡管如此,乙肝病毒感染仍然是目前最為嚴重的健康問題之一。據世界衛生組織估計,全世界累計有20億人口曾受 HBV感染,約有3.5億人口現行慢性感染,每年新增感染約500萬人。在如此龐大的感染人群中,每年有約100萬人死于包括慢性活動性肝炎(chronic active hepatitis)、肝硬化(liver cirrhosis)及原發性肝癌(primary liver cancer)等在內的各類由乙肝病毒感染引起的肝臟疾病[1-2]。中國是乙肝病毒感染的高危區,盡管乙肝疫苗的廣泛接種已經有效地控制了乙肝病毒的傳播,但是仍有非常龐大的感染群體,據估計全國有1.2億人長期攜帶乙肝病毒,其中慢性乙肝病人2000萬。乙肝病毒感染嚴重危害了人類的健康,同時也引發了一系列社會和經濟的問題,是中國現階段最為突出的公共衛生問題之一。目前,市場上已經有了包括干擾素、核苷類似物在內的一系列抗病毒藥物,但是由于耐藥性、藥物毒性以及適應癥等問題的存在,現有的治療手段仍然無法徹底地清除病毒,解除病人痛苦。因此,對于乙肝病毒的研究,尤其是病毒致病機制研究以及新型抗病毒藥物的開發仍然任重而道遠。
1 乙肝病毒的生物學特性
1.1 乙肝病毒的基因組結構
乙肝病毒屬于嗜肝DNA病毒科(hepadnaviridae),是一個帶有包膜的DNA病毒,完整的病毒顆粒大小約為42 nm,具有獨特的基因組結構和生物學特性。其基因組為松弛環型部分雙鏈DNA(relaxed circular partial double stranded DNA),具有一條全長的負鏈和一條不完全封閉的正鏈(圖1)。HBV基因組長度為3.2 kb,共編碼7個蛋白,分別為由包膜蛋白基因(preS1/preS2/S-ORF)編碼的三個表面抗原(hepatitis B surface antigen,HBsAg),大蛋白(L HBs,L)、中蛋白(MHBs,M)以及主蛋白(SHBs,S);由衣殼蛋白基因(preC/C-ORF)編碼的核心抗原(hepatitis B core antigen,HBcAg)和e抗原(hepatitis B e antigen,HBeAg);由聚合酶基因(P-ORF)編碼的帶有反轉錄酶功能的聚合酶蛋白(polymerase);以及由X基因(X-ORF)編碼的 X蛋白(hepatitis B x protein,HBx)。
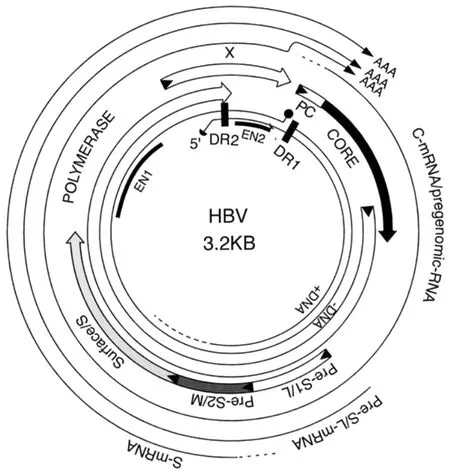
圖1 乙肝病毒基因組結構示意圖[3]
1.2 乙肝病毒復制周期
HBV在細胞內的復制過程較為復雜,最主要的特征是其基因組的復制要經過由RNA中間體到DNA的這樣一個逆轉錄過程。
成熟病毒顆粒侵入人體以后,在細胞表面未知受體的介導下進入肝臟細胞,病毒包膜與細胞膜發生融合,病毒核衣殼被釋放入細胞中。在細胞質中,病毒進一步將衣殼蛋白脫去,暴露出松弛環狀的DNA基因組,并將其轉運入細胞核。隨后,在細胞DNA聚合酶的作用下,松弛環狀的DNA基因組被修復成為共價閉合環狀DNA(covalently closed circular DNA,cccDNA),并以此作為病毒基因組復制以及轉錄的模板,轉錄出包括病毒前基因組RNA(pregenomic RNA,pgRNA)在內的一系列基因組和亞基因組產物。隨后病毒利用宿主細胞的蛋白翻譯系統將亞基因組轉錄產物翻譯為病毒的包膜蛋白、核心蛋白、e抗原、X蛋白以及聚合酶蛋白。新合成的病毒衣殼蛋白將病毒pgRNA與病毒聚合酶蛋白包裹在一起組裝成核衣殼,并在病毒核衣殼中啟動反轉錄過程,以pgRNA為模板,在病毒反轉錄酶的作用下,合成子代病毒基因組。當反轉錄過程完成后,病毒核衣殼會在細胞的內質網中包裹病毒包膜蛋白,然后通過細胞的囊泡運輸系統分泌到細胞外,產生新的病毒,開始新一輪的感染。
1.3 乙肝病毒感染的特性
研究發現HBV除了通過上述的復制周期產生成熟的病毒顆粒(Dane particle)以外,還能合成并分泌大量的亞病毒顆粒(圖2)。這些亞病毒顆粒直徑在22 nm,形狀為球形或管狀,不包含病毒基因組和衣殼蛋白,主要由病毒的包膜蛋白以及宿主細胞來源的脂質成分組成。在HBV感染病人的血清中,HBsAg亞病毒顆粒的含量遠遠超過Dane顆粒,血清濃度能達到1012/mL,是Dane顆粒的10000到1000000倍。甚至在檢測不到病毒DNA的情況下,HBsAg仍能持續大量存在。這種獨特的現象是乙肝病毒所特有的,迄今尚未在其他病毒中發現,這提示表面抗原在HBV感染過程中具有特殊的作用,在乙型肝炎發病機制中扮演了重要的角色。然而到目前為止,我們仍然不清楚如此大量且持續性的病毒包膜蛋白表達究竟有何生物學意義,對其在病毒感染和肝炎發病機制中的作用也知之甚少,而且 HBsAg的血清清除也是當前臨床治療的一個難點。
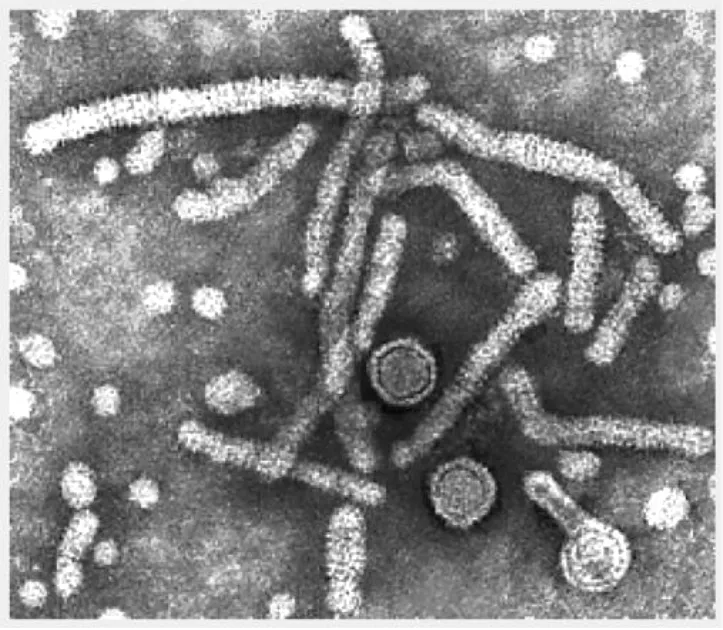
圖2 乙肝病毒顆粒的電鏡照片[4]
2 乙肝表面抗原的研究現狀
目前,在乙肝病毒領域里,最重要也最迫切需要解決的問題有以下幾個方面:第一、乙肝病毒的細胞受體究竟是什么?第二、乙肝的慢性化機制,病毒是如何逃逸機體免疫系統建立免疫耐受狀態的?第三、慢性乙肝的致病機制,持續感染的病毒是如何影響機體功能?第四、如何能夠打破免疫耐受,增強免疫應答,從而清除病毒。所有這些問題都與表面抗原有著千絲萬縷而又緊密的關系。因此對于表面抗原的研究就顯得格外重要。
盡管從病毒學、細胞生物學以及免疫學等不同角度出發,已經對 HBsAg的結構和生物學功能有了一定程度的認識,但是對于 HBsAg持續表達的機制及其對宿主細胞功能的影響,以及其在乙肝病毒致病機制中的作用,仍然缺乏全面而深入的認識。據推測,過量的 HB-sAg可能起到了結合HBV中和抗體anti-HBs的作用,從而幫助感染性病毒顆粒逃避宿主免疫系統的監控并建立持續性感染[5]。此外,有報道認為 HBsAg能模擬凋亡細胞的特征并與機體的凋亡細胞清除系統相互作用從而阻止獲得性免疫反應的發生[6]。迄今為止,尚無充分的實驗證據支持這些理論推測。HBsAg的生物學功能及其在乙肝持續性感染中發揮的作用仍需要進一步的深入研究。
筆者所在的實驗室從事乙肝病毒研究已有二十余年,尤其在乙肝慢性化機制以及表面抗原生物學功能方面做了系統的工作并取得了一定的成果。現將實驗室近年來在乙肝表面抗原方面的最新進展作一介紹。
2.1 表面抗原與細胞表面受體
從病毒顆粒的結構來看,HBV表面抗原位于病毒顆粒的最外層,是病毒與細胞相互作用的前哨,它們與細胞表面的受體結合,介導了病毒的吸附與侵入。迄今為止,肝細胞表面受體的蛋白本質研究始終是HBV研究中的難點,是難以突破的瓶頸和障礙。
近年來,越來越多的實驗證據表明乙肝表面抗原的PreS1功能域中的21-47位多肽表位才是病毒包膜蛋白與細胞表面受體吸附結合的最主要區域。研究表明有很多細胞表面蛋白能與PreS1功能域結合,并與 HBV的感染有關,比如,IgA受體、白介素6(interleukine 6,IL-6)、3-磷酸甘油醛脫氫酶(glyceraldehyde 3-phosphate dehydrogenase,GAPD)、無涎糖蛋白受體(asialoglycoprotein receptor)、Serpin家族的SCCA21蛋白、金屬蛋白酶以及一些其他的細胞表面糖蛋白都曾被認為是HBV的細胞受體。謝幼華教授也在乙肝病毒受體方面進行了系列的研究工作[7]。以 HBV的PreS功能域為靶標,用噬菌體表面隨機展示技術高通量篩選能夠特異性結合PreS區段并且具有高親和力的短肽。對篩選得到的特異性結合短肽的序列特征進行系統分析發現,這些短肽主要結合在PreS1的21-47區段,而且這些短肽序列中與結合相關的關鍵性氨基酸保守序列為-W1T2X3W4W5-。進一步以此序列為模板,搜尋具有類似一級結構特征的蛋白,發現脂蛋白脂肪酶(lipoprotein lipase,LPL)可能是一個潛在的HBV結合蛋白。這一發現提出了一個新的感染模型,HBV病毒粒子在肝外結合于血液循環中游離的LPL蛋白,由LPL作為載體向肝臟轉運,在肝細胞表面LPL結合蛋白或者其他分子的協同作用下,促進HBV在細胞上的粘附和侵入。LPL蛋白在HBV感染過程中可能發揮了“橋梁”的功能。
進一步的研究發現,鑒于PreS1的21-47區段在病毒感染過程中的重要作用,這些短肽以及HBV結合蛋白可以成為藥物干預的重要靶點。PreS1的特異性結合短肽可以在體外培養細胞系統中阻斷表面抗原與細胞的結合,從而抑制病毒的感染。在此基礎上我們可以構建基于PreS和短肽相互作用的藥物篩選體系進行小分子抑制劑篩選,并進一步在培養細胞和小鼠、樹鼩等感染模型中驗證短肽和小分子抑制劑對HBV感染靶細胞的抑制作用。這將在開發新型抗病毒藥物方面具有十分重要的價值。
雖然已經認識到病毒表面抗原是與細胞表面受體結合的最重要的部位,而且到目前為止已報道了很多可能起作用的病毒受體,但由于缺乏有效的體外感染系統,仍無法確定到底是哪一個受體起決定性作用。乙肝病毒表面抗原與細胞受體的相互作用是一個非常復雜的過程,病毒包膜蛋白上可能包含有不止一個結合位點,而細胞表面也可能存在多個受體以及輔助蛋白,在它們的共同作用下,病毒才能成功地感染細胞。
2.2 表面抗原與機體免疫應答
當乙肝病毒侵入人體,感染肝臟細胞以后,機體的免疫系統就開始發揮作用,努力清除病毒。通常情況下,免疫系統足夠強大,能戰勝病毒并將其清除,成功抵御并擊退乙肝病毒的入侵,而且免疫系統還能產生特異性針對HBV的抵抗力,包括保護性抗體(針對表面抗原的抗體)以及特異性的細胞免疫。免疫系統建立起保護我們身體健康的防線,避免我們再次感染。然而一旦機體的免疫系統由于這樣那樣的原因,無法消滅病毒,乙肝病毒就將在體內長期存在,最終發展成為慢性肝炎,持續危害我們的健康。事實上在成人中,約有10%的乙肝病毒感染者會由于無法完全清除病毒而最終發展成為持續性感染(圖3),而在兒童中,由于免疫系統尚未發育完全,這一比例更高,經歷母嬰傳播這一途徑的嬰兒感染者中,90%以上會發展成為慢性肝炎。已有的研究表明機體免疫功能低下,尤其是對乙肝表面抗原的免疫耐受是引起乙肝感染慢性化的重要原因。因此,如何打破免疫耐受狀態,增強免疫應答反應,重建有效地針對HBV的免疫功能就成為乙肝慢性化治療中一個及其重要而且長盛不衰的話題。
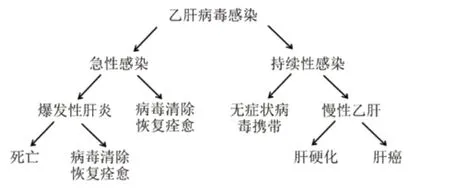
圖3 乙肝感染后肝臟疾病發展進程
國際上有包括法國巴斯德研究所在內的多個科研機構正從事相關的研究工作,中國第三軍醫大學的吳玉章教授應用分子模擬的方法設計了新型的抗原表位,并以此來刺激機體的免疫系統,以希望達到清除病毒的目的。本實驗室聞玉梅院士課題組長期從事乙肝免疫耐受機制研究,在這方面做了大量的工作。我們將重組表達的乙肝表面抗原與針對表面抗原的抗體組成免疫復合物型治療性疫苗(YIC),多年的實驗研究發現其對乙型肝炎治療有效。在轉基因鼠等動物模型中,免疫復合物可以有效的增強抗原遞呈效果,逆轉對病毒的免疫耐受性。隨后已完成的IIA和IIB臨床試驗結果表明,60 μg疫苗治療組與對照組 HBeAg的轉陰率分別為21.8 %(17/78)和 9%(7/78),兩者之間有顯著差異(P=0.03),而且60μg疫苗治療組中41.8%的患者HBV DNA下降超過2個log,其中22.4%患者 HBV DNA低于103拷貝/mL[8-9]。研究表明:抗原-抗體免疫復合物型治療性疫苗的作用機制可能為抗原與抗體作用后凝集成較大的分子顆粒,而后免疫復合物借助抗體的Fc片段與抗原提呈細胞表面的相應受體結合,從而改變了抗原的提呈與加工過程,使得表面抗原更容易被捕獲、加工、遞呈,從而刺激免疫系統產生免疫應答反應,消除免疫耐受。進一步的研究發現,抑制性的 Fcγ受體IIB介導的細胞免疫調節功能可能是治療性疫苗發揮作用的分子機制之一。
盡管免疫復合物型治療性疫苗在慢性乙肝治療方面的應用前景已經初見端倪,但是對于疫苗打破免疫耐受的具體作用機制仍然值得進一步研究。
2.3 表面抗原與乙肝致病機制
與很多病毒不同,乙肝病毒并不表現直接的細胞毒性作用,也就是說乙肝病毒感染造成的肝臟損傷并不是由病毒直接引起,乙肝病毒的復制相對比較溫和,不會直接對肝細胞造成很大的破壞。對于乙肝病毒感染的致病機制,學界一般認為,肝臟的炎癥損傷是由于機體的免疫系統持續攻擊感染病毒的肝臟組織所造成。乙肝病毒侵入并感染肝細胞后,被免疫系統識別,激活的免疫系統為了清除病毒,就會產生大量的特異性以及非特異性的免疫細胞和免疫分子,攻擊病毒以及病毒所感染的肝臟細胞。病毒感染的最終命運取決于兩者相互較量的結果。如果免疫系統力量較強,則會在與病毒的斗爭中取勝,最終清除病毒恢復健康。如果相反免疫系統由于種種原因力量不足,那么其與病毒的斗爭就會處于下風,無法清除病毒,病毒長期存在于人體內,長此以往就會發展成為慢性肝炎,而且在這種情況下,免疫系統會以一種低水平的方式持續的攻擊肝臟,從而造成一種長期的慢性的肝臟炎癥損傷。
那么,乙肝病毒究竟是通過什么樣的致病機制來引起炎癥反應的呢?筆者所在實驗室最近的研究工作揭示了由表面抗原引起的新的致病機制[10-11]。我們的研究發現,表面抗原的表達能促進一種名為親環素A(cyclophilin A,CypA)的細胞蛋白的分泌。在體外培養細胞、HBV轉基因小鼠模型以及慢性乙肝病人體內均發現表面抗原能夠特異性的促進CypA由細胞內向細胞外的分泌。進一步的研究表明表面抗原與CypA之間具有直接的蛋白-蛋白相互作用,借助這種相互作用兩者結合在一起,并通過共用的囊泡分泌途徑轉運至胞外。HBsAg促進的CypA分泌有什么樣的生物學意義呢?CypA是一個多功能的細胞蛋白,在不同的微環境中發揮不同的作用。當CypA在表面抗原作用下分泌至肝臟細胞外后,起到了趨化因子的功能,借助細胞表面受體CD147的作用下將巨噬細胞、T細胞等免疫細胞吸引至感染的細胞周圍并引起局部的炎性浸潤。如果使用CypA的抑制劑或者CD147的抗體阻斷CypA的趨化功能后,HBV感染引起的炎癥反應則明顯好轉。這一結果表明HBsAg誘導分泌的CypA在乙肝炎癥反應中起到了重要的作用。
表面抗原對機體的影響并不僅限于CypA蛋白,HBsAg的表達分泌對很多細胞正常生理功能都有顯著的影響。利用基因芯片技術和蛋白質組學的方法對表面抗原的生物學功能進行了系統的分析,發現包括糖代謝和脂類代謝、細胞的生長和凋亡、細胞骨架和細胞外基質的形成以及一些細胞內重要信號轉導通路在內的許多細胞功能都受到了不同程度的影響。HBsAg的持續性表達使得機體膽固醇合成增強、糖酵解途徑受到抑制而糖原生成作用加強。機體物質和能量代謝水平發生改變造成微環境相對不穩定,使得機體極易受外界因素干擾而發生功能的改變[12]。HBsAg引起細胞內包括GRP78在內的一系列胞內凋亡相關蛋白含量變化,從而促進肝細胞的凋亡[13]。HBsAg還能通過調控轉錄因子L EF-1影響Wnt信號通路的激活,從而在肝癌的發生發展過程中起到重要的作用[14-15]。
3 小結與展望
作為乙肝病毒的包膜蛋白,表面抗原在病毒生活周期中起到了非常關鍵的作用。在病毒的復制過程中,表面抗原影響或者干擾了宿主細胞很多重要的生理功能,與疾病的發生發展密切相關。作為最早被發現的病毒蛋白,對表面抗原的研究已經超過了40年,然而對于表面抗原的生物學功能依然知之甚少。究竟是什么細胞生理機制支持表面抗原的持續性表達和分泌?表面抗原的大量表達又會對細胞正常生理功能產生什么樣的影響?表面抗原在乙肝致病機制中究竟扮演了什么樣的角色?這些問題是表面抗原研究中最重要的課題。正是為了探索這些問題的答案,我們從基礎理論研究及轉化型研究兩個方面持續地進行著研究。我們相信在不斷分析問題、解決問題的過程中,最終將全面解析乙肝表面抗原在致病機制中的作用并將可研制出新的抗乙肝病毒與清除乙肝表面抗原的有效藥物,造福于人類。
(2010年8月11日收到)
[1]KAO J H,CHEN D S.Global control of hepatitis B virus infection[J].Lancet Infect Dis,2002,2:395-403.
[2]OCAMA P,OPIO C K,L EE W M.Hepatitis B virus infection:current status[J].Am J Med,2005,118:1413.
[3]SEEGER C,MASON W S.Hepatitis B virus biology[J].Microbiol Mol Biol Rev,2000,64:51-68.
[4]WHO.Hepatitis B[M/OL].[2010-09-08].http://www.who.int/csr/disease/hepatitis/HepatitisB_whocdscsrlyo2002_2.pdf.
[5]REHERMANN B,NASCIMBENI M.Immunology of hepatitis B virus and hepatitis C virus infection[J].Nat Rev Immunol,2005,5:215-229.
[6]VANLANDSCHOOT P,L EROU X-ROELS G.Viral apoptotic mimicry:an immune evasion strategy developed by the hepatitis B virus?[J].Trends Immunol,2003,24:144-147.
[7]DENG Q,ZHAI J W,MICHEL M L,et al.Identification and characterization of peptides that interact with hepatitis B virus via the putative receptor binding site[J].J Virol,2007,81:4244-4254.
[8]YAO X,ZHENG B,ZHOU J,et al.Therapeutic effect of hepatitis B surface antigen-antibody complex is associated with cytolytic and non-cytolytic immune responses in hepatitis B patients[J].Vaccine,2007,25:1771-1779.
[9]XU D Z,ZHAO K,GUO L M,et al.A randomized controlled phase IIb trial of antigen-antibody immunogenic complex therapeutic vaccine in chronic hepatitis B patients[J].PLoS ONE,2008,3:e2565.
[10]TIAN X,ZHAO C,ZHU H,et al.Hepatitis B virus(HBV)surface antigen interacts with and promotes cyclophilin a secretion:possible link to pathogenesis of HBV infection[J].J Virol,2010,84:3373-3381.
[11]ZHAO C,FANG C Y,TIAN X C,et al.Proteomic analysis of hepatitis B surface antigen positive transgenic mouse liver and decrease of cyclophilin A[J].J Med Virol,2007,79:1478-1484.
[12]任軍,趙超,方彩云,等.乙型肝炎表面抗原陽性轉基因小鼠肝組織基因表達譜及蛋白組學的初步研究[J].微生物與感染,2006,1:7-14.
[13]ZHAO C,ZHANG W,TIAN X,et al.Proteomic analysis of cell lines expressing small hepatitis B surface antigen revealed decreased glucose-regulated protein 78 kDa expression in association with higher susceptibility to apoptosis[J].J Med Virol,2010,82:14-22.
[14]TIAN X,ZHAO C,REN J,et al.Gene-expression profiles of a hepatitis B small surface antigen-secreting cell line reveal upregulation of lymphoid enhancer-binding factor 1[J].J Gen Virol,2007,88:2966-2976.
[15]TIAN X,LI J,MA Z M,et al.Role of hepatitis B surface antigen in the development of hepatocellular carcinoma:regulation of lymphoid enhancer-binding factor 1[J].J Exp Clin Cancer Res,2009,28:58.
(責任編輯:沈美芳)
Dissection of HBV Envelope:Recent Progress on Biological Function and Pathogenesis of Hepatitis B Surface Antigen
TIAN Xiao-chen①,WEN Yu-mei②
①Lecturer,②CAE Member,Key Laboratory of Medical Molecular Virology,Shanghai Medical College,Fudan University,Shanghai 200032,China
As the envelope protein of hepatitis B virus,surface antigen typically outnumbers the mature virions by a factor of 10000-to 1000000-fold in HBV infected patients.This unique phenomenon indicates that HBsAg plays an important role in HBV infection and pathogenesis of the disease.In this review,recent progress on pathogenic mechanisms of HBV persistent infection was discussed in detail.
HBV,HBsAg,receptor,pathogenic
10.3969/j.issn 0253-9608.2010.06.002

