人工養殖半滑舌鰨卵巢發育及其產卵類型研究
陳彩芳, 溫海深, 陳曉燕, 張葭人, 金國雄, 史 寶, 史 丹, 楊艷平, 何 峰,
李吉方
(中國海洋大學 水產學院, 山東 青島 266003)
人工養殖半滑舌鰨卵巢發育及其產卵類型研究
陳彩芳, 溫海深, 陳曉燕, 張葭人, 金國雄, 史 寶, 史 丹, 楊艷平, 何 峰,
李吉方
(中國海洋大學 水產學院, 山東 青島 266003)
研究了人工養殖半滑舌鰨(Cynoglossus semilaevis)卵巢發育組織學的季節變化及其與性成熟系數(gonadosomatic index, 簡稱GSI)和肝質量指數(hepatosomatic index, 簡稱HSI)的關系。結果表明, 半滑舌鰨成熟魚卵巢發育經歷Ⅱ期、Ⅲ期、Ⅳ期、Ⅴ期、Ⅵ期, 再到重復發育Ⅱ期; 人工養殖條件下, 3~5月份大部分魚卵巢處于Ⅱ期, 從6月份開始, 其卵母細胞內開始沉積卵黃顆粒, 9~11月份, 卵母細胞內卵黃顆粒充盈整個胞質, 基本達到生長成熟, 排卵后至翌年 2月份, 卵巢進入了退化吸收Ⅵ期或重復發育Ⅱ期; 繁殖期GSI達到最高峰; 產卵后或重復發育Ⅱ期, GSI顯著下降, 此時HSI顯著升高至全年最高峰; 半滑舌鰨在1 a中只有1個繁殖期, 進行分批產卵。
半滑舌鰨(Cynoglossus semilaevis); 卵巢; 產卵類型
半滑舌鰨(Cynoglossus semilaevis)屬于鰈形目(Pleuronectiformes), 舌鰨科(Cynoglossidae), 舌鰨屬(Cynoglossus), 為近海暖溫性底層魚類, 常年棲息在中國沿海, 不做遠距離洄游, 是比目魚中最珍貴的品種。半滑舌鰨雌性個體生長速度比雄性快2~3倍,性成熟雄魚個體體質量只有雌魚的 1/3, 其精巢質量只有成熟卵巢的 1/200~1/900, 這種現象在魚類中十分罕見; 雄魚生殖力弱, 造成自然狀況下卵子受精率不足10%[1]。目前, 有關半滑舌鰨人工繁殖與養殖技術研究報道較多[2~4]; 對半滑舌鰨性腺分化、分子標記、功能基因研究起步較晚, 但受到研究者高度重視[5~10]; 關于半滑舌鰨性腺發育研究報道較少[11,12],對卵巢發育組織學研究更為鮮見[13]。本研究以人工養殖半滑舌鰨為對象, 系統研究不同發育期卵巢組織變化, 并結合GSI和HSI進行分析, 以期豐富半滑舌鰨繁殖生理學內容, 同時為優化人工繁殖技術提供科學依據。
1 材料與方法
1.1 材料
2007年3月~2008年2月, 在煙臺萊州一養殖場每3個月(3月~5月、6月~8月、9月~11月、12月~翌年2月)采集1次, 共采集雌性半滑舌鰨40尾, 平均體長為(464.5±3.15) mm, 平均體質量為(731.28±192.72)g。實驗前測量所有魚生物學指標(表1), 采集尾靜脈血液, 分離血漿用于生理學指標測定; 解剖后取性腺和肝質量, 計算 GSI=[性腺質量/(體質量-內臟質量)]×100, HSI=[肝臟質量/(體質量-內臟質量)]×100。
1.2 方法(H.E染色)
在卵巢的前、中、后 3部分取小塊組織, 以Bouin’s 液固定 24~36 h, 系列酒精脫水, 二甲苯透明, 石蠟包埋, LEICA-RM2016切片機連續橫切, 厚度5 μm, H.E染色, 中性樹膠封片。Nickon E200型光學顯微鏡觀察及顯微攝影。
1.3 數據分析
實驗所得數據均表示為平均值±標準差(Mean±SD), 采用 SPSS 13.0統計軟件中的 Duncan’s法多重比較進行數據處理和檢驗分析, 當 P < 0.05時認為差異顯著。
2 結果
2.1 GSI和HSI的季節變化
隨著卵巢發育周年變化的進行, GSI也相應地發生變化。根據對全年數據的統計, 雌性半滑舌鰨在繁殖季節(9~11月份)出現全年最高峰, GSI均值高達6.16(n=8); 12月~翌年2月份為越冬期, GSI顯著下降(P<0.05), 均值為 3.25(n=8); 之后 GSI繼續下降,3~5月份降至全年最低點, 均值為1.54(n=16); 6~8月份, GSI呈升高趨勢, 但是無顯著性變化, 均值為1.72(n=8), 結果見圖1。

表1 雌性半滑舌鰨生物學指標Tab. 1 The biology index of female Cynoglossus semilaevis
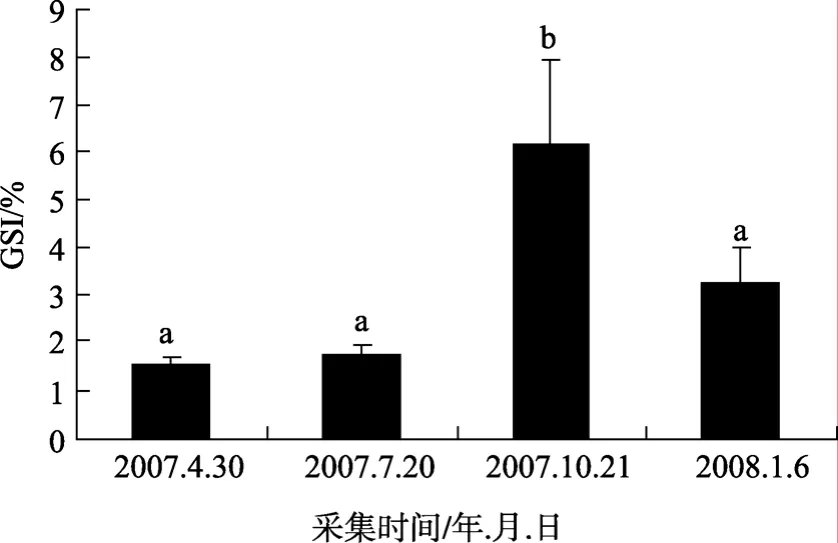
圖1 雌性半滑舌鰨GSI季節變化Fig. 1 GSI in female Cynoglossus semilaevis數據均表示為平均數±標準差, 圖中標有不同的字母(a,b)表示存在顯著性差異(P<0.05, Duncan氏多重比較)Values are expressed as mean±standard error of mean. Different letters (a, b) indicate significant difference(P<0.05, one-way ANOVA, followed by Duncan’s)
伴隨著卵巢發育的不斷進行, 不僅 GSI會相應地發生變化, HSI也會發生變化, 這與魚類的性腺發育和生長有關。根據對肝質量指數數據的統計, 雌性半滑舌鰨在繁殖季節(9~11月份)出現 1個高峰,HSI均值達0.87(n=8); 12月~翌年2月份為越冬期,HSI呈升高趨勢, 且差異顯著, 均值為1.02(n=8)(P<0.05); 之后 HSI顯著下降, 到 3~5月份, 均值為0.85(n=16)(P<0.05); 到 6~8月份, HSI繼續下降,均值為0.67(n=8)(P<0.05), 結果見圖2。
2.2 卵巢形態
半滑舌鰨卵巢一對, 位于背腹兩側的卵巢腔內,側面觀察呈現漏斗狀。Ⅱ期卵巢呈半透明狀, 肉紅色,表面可見有細小血管分布(圖 3-1), 但用肉眼尚看不清卵粒。Ⅲ期卵巢體積增大, 外觀上呈現土黃色, 透過卵巢壁, 肉眼可見豐富的毛細血管(圖 3-2)。Ⅳ期卵巢體積進一步增大, 呈淡黃色, 透過薄層卵巢壁可看到淺黃色卵粒, 卵粒不分離, 縱走血管和分枝的擴展達到高峰(圖 3-3)。Ⅴ期卵巢體積增大為全年最高, 從體外肉眼已能明顯看到假體腔膨大突出,呈松軟狀, 卵粒游離(圖 3-4), 提起親魚或輕壓腹部即有成熟卵排出。Ⅵ期卵巢體積顯著縮小, 呈黃色,透過卵巢壁可見黃色不規則物質(圖 3-5)。重復發育二期卵巢較Ⅵ期卵巢更為萎縮, 卵巢變得干癟, 呈暗淡的黃色(圖3-6)。
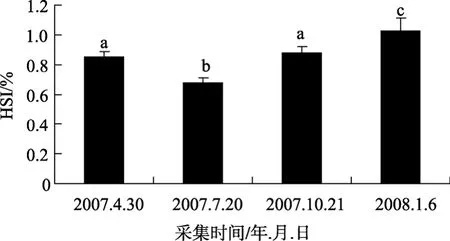
圖2 雌性半滑舌鰨HSI季節變化Fig. 2 HSI in female Cynoglossus semilaevis數據均表示為平均數±標準差, 圖中標有不同的字母(a,b,c)表示存在顯著性差異(P<0.05, Duncan氏多重比較)Values are expressed as mean±standard error of mean. Different letters (a,b,c) indicate significant difference(P<0.05, one-way ANOVA, followed by Duncan’s)
2.3 卵巢發育組織學分期
根據國內外魚類發育分期方法[18], 結合鲆鰈魚類性腺發育特點, 采用本研究室關于牙鲆卵巢分期方法[14], 將半滑舌鰨卵巢發育分為Ⅱ期~Ⅵ期。
2.3.1 Ⅱ期卵巢
2007年3月~5月所采雌魚性腺發育基本處于Ⅱ期, 從組織學切片上可以看見, 這個時期的卵巢主要以2時相卵母細胞為主體(圖4-1)。此時2時相卵母細胞核大圓形, 核仁沿核膜內緣分布, 其胞質呈強嗜堿性反應, 胞徑 49.3~147.9 μm, 核徑 29.58~78.88 μm, 核胞徑比介于 0.5~0.8(圖 4-2)。

圖3 半滑舌鰨卵巢形態Fig. 3 Morphology of Cynoglossus semilaevis ovaries3-1.Ⅱ期卵巢外觀;3-2.III期卵巢外觀;3-3.IV期卵巢外觀;3-4.Ⅴ期卵巢外觀;3-5.Ⅵ期卵巢外觀;3-6.重復Ⅱ期期卵巢外觀3-1. morphological structure of ovary in the stageⅡ; 3-2. morphological structure of ovary in the stage Ⅲ; 3-3. morphological structure of ovary in the stage Ⅳ; 3-4. morphological structure of ovary in the stageⅤ; 3-5. morphological structure of ovary in the stageⅥ; 3-6. morphological structure of the convalescence of ovary in the stageⅡ
2.3.2 Ⅲ期卵巢
2007年6~8月所采雌魚性腺發育基本處于Ⅲ期,這個時期卵巢以 3時相卵母細胞為主, 胞徑197.2~246.5 μm, 核徑 108.46~128.18 μm, 核胞徑比0.55~0.6(圖 4-3), 在近卵母細胞膜的細胞質內出現1-2 層液泡, 隨后逐漸向核中央擴大, 同時在較大的卵母細胞卵膜邊緣出現卵黃沉積。開始時, 層次少而顆粒細, 后來逐漸長大, 由卵膜邊緣向核周分布(圖4-4)。此外, 卵巢也含有少量 2時相的卵母細胞(圖4-3,4)。
2.3.3 Ⅳ期卵巢
2007年9~11月所采雌魚中有性腺發育處于Ⅳ期,此時以 4時相卵母細胞為主, 胞質中沉積大量卵黃顆粒, 卵黃顆粒分為大小兩種顆粒, 被HE染成紫紅色(圖 4-5)。卵核偏位和卵黃顆粒充滿卵黃囊是卵母細胞生長成熟的標志, 此卵母細胞胞徑246.5~305.66 μm, 核徑 49.3~69.02 μm, 核胞徑比0.19~0.23(圖 4-6)。此時濾泡細胞層、放射膜更加明顯(圖4-7),其他還有2時相的卵母細胞和3時相卵母細胞(圖 4-6)。
2.3.4 Ⅴ期卵巢
與Ⅳ期卵巢相似, Ⅴ期卵巢的采樣時間也處于2007年9~11月。這個時期卵巢以5時相卵母細胞占主導地位, 胞徑 315.52~394.4 μm, 細胞質中充滿粗大的卵黃顆粒, 在成熟過程中有相互融合現象, 且核崩解消失(圖 4-8, 4-9)。此時, 還有 2時相卵母細胞、3時相卵母細胞和4時相卵母細胞(圖4-8)。
2.3.5 Ⅵ期卵巢
2007年12月~翌年2月份所采雌魚有退化期的卵巢, 即Ⅵ期卵巢, 卵巢組織中有排空的濾泡細胞, 成為產后黃體(圖4-10); 未排出的過熟卵粒放射膜增厚, 卵黃顆粒融合成塊狀(圖4-11)逐漸被分解和吸收。
2.3.6 重復發育Ⅱ期卵巢
同Ⅵ期卵巢采樣時間相同, 這個時間段所采雌魚性腺發育也有進入重復發育二期。由Ⅴ期卵巢產卵后或者經由Ⅵ期卵巢自由退化的魚, 卵巢呈萎癟的囊狀, 表面血管充血, 以后轉變為Ⅱ期卵巢(圖 4-6,圖4-12)。此時卵巢還是以2時相卵母細胞為主, 還有未吸收完全的濾泡細胞空泡和液化成塊狀的卵黃顆粒(圖 4-12)。
2.4 繁殖期與產卵類型
半滑舌鰨的卵巢周年發育變化表明: 從 3月份開始到5月份, 卵巢基本處于發育Ⅱ期, 進入卵母細胞生長期的小生長階段。經過 3個月的培育進入 6月份到8月份, 卵母細胞體積增大, 胞質內卵黃顆粒開始出現并沉積, 且由于濾泡細胞分泌活動的加劇,在卵細胞膜和濾泡細胞之間出現了一薄層非細胞結構的放射膜, 此時卵巢進入了III期。至9月份到11月份繁殖季節, 卵巢基本處于Ⅳ期和Ⅴ期, 卵母細胞內卵黃顆粒大量沉積并充盈整個胞質, 且胞核開始偏位或完全崩解消失, 此時兩層濾泡細胞、放射膜更加明顯。繁殖季節過后進入了越冬期, 此時的卵巢處于退化吸收Ⅵ期或重復發育Ⅱ期。排卵后卵巢內可見大量的產后黃體, 卵黃顆粒融合成塊狀,放射膜顯著增厚, 此時Ⅱ時相卵母細胞占主導。同時, 由圖1可以看出, GSI在1 a中只出現一個峰值,說明半滑舌鰨雌魚為每年有 1個繁殖期; 且組織切片的觀察結果也顯示, 在同一個視野中同時存在 3時相和 4時相卵母細胞, 說明半滑舌鰨雌魚為分批產卵類型。
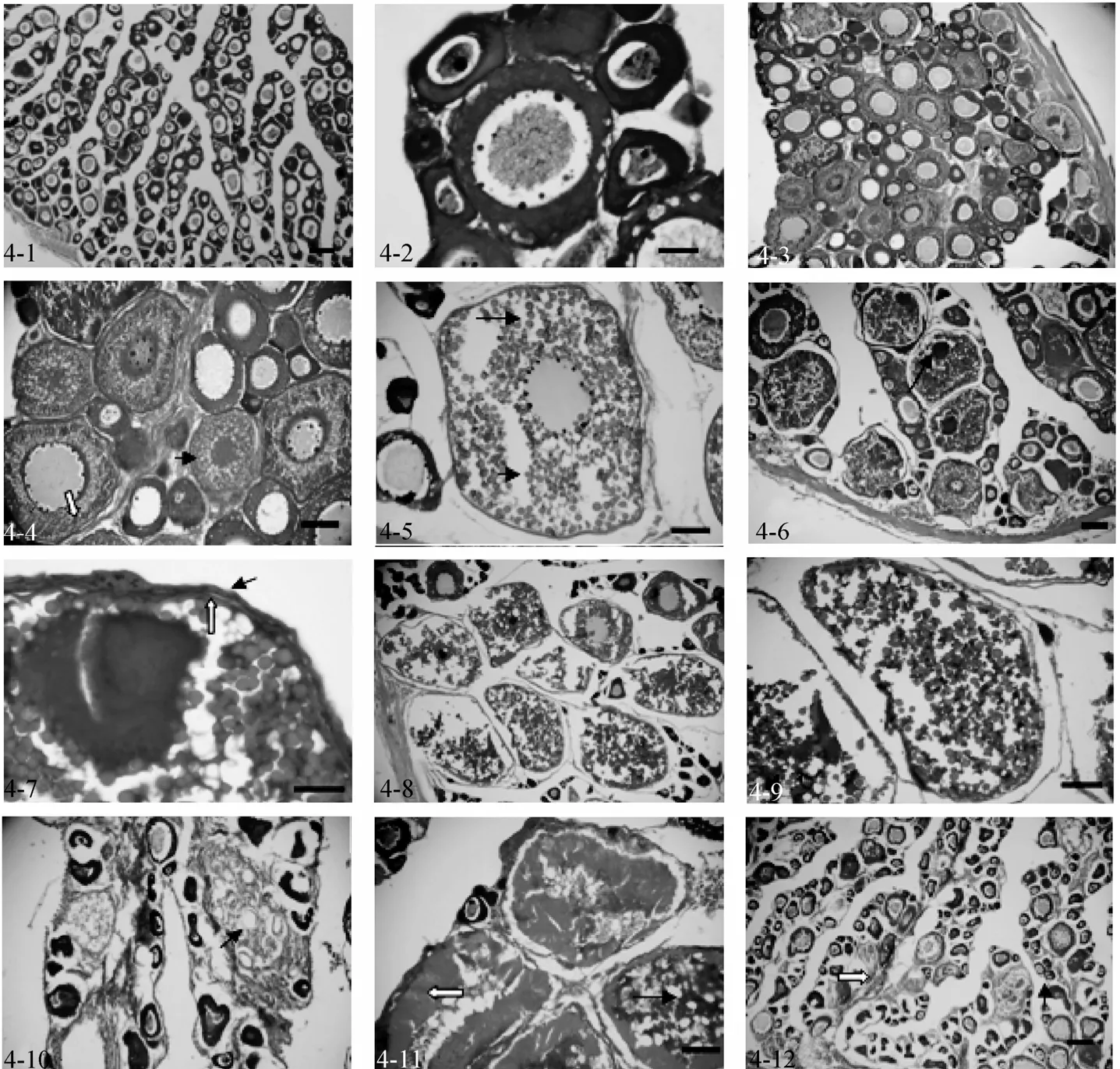
圖4 半滑舌鰨卵巢組織學分期Fig. 4 Ovarian developmental phase of Cynoglossus semilaevis4-1.Ⅱ期卵巢, 比例尺為100 μm; 4-2.Ⅱ時相卵母細胞, 比例尺為70 μm; 4-3. Ⅲ期卵巢, 比例尺為100 μm; 4-4. III時相卵母細胞, 比例尺為70 μm, 白箭頭為卵周的卵黃顆粒, 黑箭頭為液泡; 4-5. Ⅳ時相早期卵母細胞, 比例尺為70 μm, 長箭頭為大卵黃顆粒, 小箭頭為小卵黃顆粒; 4-6. Ⅳ期卵巢, 比例尺為100 μm, 箭頭為核偏位; 4-7. Ⅳ時相晚期卵母細胞, 比例尺為24 μm, 黑箭頭為雙層濾泡細胞, 白箭頭為增厚的放射膜; 4-8. Ⅴ期卵巢, 比例尺為100 μm; 4-9. Ⅴ時相卵母細胞, 比例尺為70 μm; 4-10. Ⅵ期卵巢, 比例尺為100 μm, 箭頭為排空的濾泡細胞層; 4-11. 正在退化吸收的Ⅵ時相卵母細胞, 比例尺為 70 μm, 白箭頭為顯著增厚的放射膜, 黑箭頭為崩解的卵黃顆粒; 4-12.重復發育二期卵巢, 比例尺為100 μm4-1.the ovary in the stageⅡ, bar=100 μm;4-2.the phase 2 oocyte, bar=70 μm; 4-3.the ovary in the stageⅢ, bar=100 μm; 4-4.the phase 3 oocyte,bar=70 μm, the white arrow shows vitellin granule, the black arrow shows vacuole; 4-5. the phase 4 oocyte, bar=70 μm, the long arrow shows big vitellin granule ,the short arrow shows small vitellin granule; 4-6.the ovary in the stageⅣ, bar=100μm,the arrow shows nuclear deflexion;4-7.the phase 4 oocyte, bar=24 μm, the black arrow shows two layer of follicular cells, the white arrow shows incrassated zona radiate; 4-8. the ovary in the stageⅤ, bar=100 μm; 4-9. the phase 5 oocyte, bar=70 μm; 4-10.the ovary in the stageⅥ, bar=100 μm, the arrow shows follicular cells after spawning; 4-11. assimilative phase-6 oocyte, bar=70 μm, the white arrow shows largely incrassated zona radiate, the black arrow shows collapsed vitellin granules; 4-12.the convalescence of ovary in the stageⅡ, bar=100 μm
3 討論
魚類的繁殖周期性活動中, 對于產卵類型通常有兩種劃分方法: 一種是根據卵巢組織學特征和產卵習性把硬骨魚類的產卵類型劃分為一次性產卵魚類和多次性產卵魚類; 另一種是根據卵母細胞的發育情況, 把魚類的卵巢分為3種類型: 完全同步型、分次同步型(或稱分批同步型)和分批非同步型[15]。由本研究結果可知, 半滑舌鰨各時期的卵巢中卵母細胞發育不同步, 在同一發育期的卵巢中存在不同發育時期的卵母細胞, 屬于卵母細胞發育不同步、分批產卵類型。進入繁殖期9 ~11月, 卵巢基本處于Ⅳ期或者Ⅴ期。在Ⅳ期卵巢中, 除了Ⅳ時相卵母細胞占主導地位外, 還有2、3時相卵母細胞; 在Ⅴ期卵巢中,除了占據多數的5時相卵母細胞, 還有4、3、2時相卵母細胞。由此可見, 半滑舌鰨的產卵類型與丁魚歲(Tinca tinc)[16]、黃鯛 (Dentex tumifron)[17]等魚類的產卵類型相似, 能進行多次產卵。
在發育成熟的半滑舌鰨卵巢中, 發現了大小兩種卵黃顆粒。關于魚類卵黃發生的機制可以分為兩種來源: 內源性卵黃發生和外源性卵黃發生[18]。方展強等[19]曾提出鲇魚(Silurus asotus)為外源性卵黃發生機制, 指出卵黃蛋白原首先在肝臟內合成, 然后通過血液循環進入顆粒細胞, 再經過微絨毛運送到卵母細胞內, 最后被線粒體包裝形成卵黃顆粒。在半滑舌鰨的Ⅲ期卵巢中, 卵黃顆粒首先出現在初級卵母細胞的細胞膜附近, 然后慢慢向胞核方向擴散,最終充盈整個細胞質。因此推斷, 半滑舌鰨的卵黃發生機制是外源性卵黃發生機制。這個現象在鱖魚(Siniperca chuatsi)[20]、白鰱(Hypophthal michthys molitrix)和鳙魚(Aristichthys nobilis)[21]內也有發現。但關于半滑舌鰨卵巢內是否存在內源性的卵黃形成,還有待于進一步研究。
近幾年來, 國內外對魚類卵巢發育周年變化的研究報道較多, 如旗魚(Xiphias gladius)[22]、黃鯛[17]、丁[16]、牙鲆(Paralichthys olivaceus)[14]等。但是關于半滑舌鰨卵巢發育的周年變化還未見報道。半滑舌鰨人工養殖的繁殖期是 9~11月份, 此時卵巢發育基本處于Ⅳ期或Ⅴ期, 且 GSI達到了一年中的最高峰, 兩者是相互吻合的, 這與柳學周等[2]的觀點是一致的。繁殖期過后, 產卵后或沒能及時催產排卵的舌鰨卵巢進入Ⅵ期退化吸收階段或重復發育Ⅱ期。進入 12月份后, 卵巢處于休整期, 并以Ⅱ期卵巢過冬, 此時GSI顯著下降, HSI顯著升高至全年最高峰。這與以前的普遍觀點相一致, 即性腺指數越大, 肝質量指數越小, 反之亦然。本研究的結果也表明了這一點, 這與繁殖期過后魚類體內能量合成主要不是用于性腺發育而是轉為能量儲存相關。從翌年 3月份開始, 人工投喂各種營養飼料, 使得卵巢發育慢慢復蘇, 進入了卵母細胞生長期的小生長階段, 此時GSI較越冬期下降, HSI則呈顯著下降趨勢, 這與經過一個越冬期能量的大量損耗而攝入量少有關。到6月份后, 開始進行人工養殖的營養強化階段, 進一步促進性腺的發育。此時卵巢內卵母細胞開始大量沉積卵黃顆粒, 為后面的繁殖期儲備營養物質。經過這些營養強化, GSI呈現升高趨勢, 而HSI則顯著下降至全年最低點。這與前文所述相吻合, 即魚類體內能量合成現主要轉向性腺發育。這些都說明半滑舌鰨性腺發育、性腺成熟系數、肝質量指數之間有著密切的關系, 且呈現了明顯的季節性規律變化。
本研究在國內外首次對半滑舌鰨卵巢發育周期進行了較系統研究, 為進一步闡明半滑舌鰨繁殖生理奠定基礎, 同時也為優化半滑舌鰨人工繁殖技術和單性育種提供科學依據。
[1] 姜言偉, 萬瑞景. 渤海半滑舌鰨的生殖習性及產卵生態的研究[J]. 海洋水產研究, 1988, 9: 185-192.
[2] 柳學周, 莊志猛, 馬愛軍, 等. 半滑舌鰨繁殖生物學及繁育技術研究[J]. 海洋水產研究, 2005, 26(5):7-14.
[3] 柳學周, 孫中之, 馬愛軍, 等. 半滑舌鰨親魚培育及采卵技術研究[J]. 海洋水產研究. 2006, 27(2): 25-32.[4] 孫中之, 柳學周, 徐永江, 等. 半滑舌鰨工廠化人工育苗工藝技術研究[J]. 中國水產科學, 2007, 14(2):244-248.
[5] 馬學坤, 柳學周, 溫海深, 等. 半滑舌鰨性腺分化的組織學觀察[J]. 海洋水產研究, 2006, 27(2): 55-60.
[6] 鄧思平, 陳松林, 劉本偉. 半滑舌鰨 FTZ-F1 cDNA克隆及表達分析[J]. 動物學研究, 2008, 29(6):592-598.
[7] Chen S L, Deng S P, Ma H Y, et al. Molecular marker-assisted sex control in half-smooth tongue sole(Cynoglossus semilaevis) [J]. Aquaculture,2008, 283:7-12.
[8] Deng S P, Chen S L, Xu J Y, et al. Molecular cloning,characterization and expression analysis of gonadal P450 aromatase in the half-smooth tongue-sole, Cynoglossus semilaevis[J]. Aquaculture, 2009, 287:211-218.
[9] 溫海深, 張葭人, 何峰, 等. 半滑舌鰨雄激素受體(AR)基因的克隆與表達分析[J]. 中國海洋大學學報(自然科學版), 2009, 39(3): 387-391.
[10] Yan Y, Zhong Q W, Li C M, et al. Isolation and characterization of Toll-like receptor 9 in half-smooth tongue sole Cynoglossus semilaevis[J]. Fish & Shellfish Immunology, 2009, 26: 492-499.
[11] 康現江, 梁春光, 郭明申, 等. 半滑舌鰨精子發生和精子形成的超微結構[J]. 動物學報, 2008, 54(2):356-365.
[12] 宋海霞, 翁幼竹, 劉志剛, 等. 半滑舌鰨精子發生的組織學研究[J]. 臺灣海峽, 2009, 28(1): 19-24.
[13] 梁春光, 康現江, 李鳳超, 等. 半滑舌鰨性腺的組織學研究[J]. 河北漁業. 2007, 11: 22-28.
[14] 宋海霞, 溫海深. 養殖牙鲆卵巢發育及其調控的組織學研究[J]. 海洋湖沼通報, 2005, 4: 75-83.
[15] 施 芳. 魚類生理學[M]. 北京: 農業出版社, 1991.300-319.
[16] 凌去非, 李思發, 梁新華, 等. 丁卵巢周年變化的組織學觀察[J]. 上海水產大學學報, 2006, 1(15):36-40.
[17] 施兆鴻, 王建鋼, 高露姣, 等. 南海黃鯛性腺發育的初步研究[J], 臺灣海峽, 2006, 25(3): 353-359.
[18] 劉筠. 中國養殖魚類繁殖生理學[M]. 北京: 農業出版社, 1993, 29-42, 42-46, 53-55.
[19] 方展強, 鄭文彪, 馬廣智, 等. 鲇卵膜形成和卵黃發生地超微結構觀察[J]. 華南師范大學學報(自然科學版), 2002, 2: 25-31.
[20] 林國輝, 方展強. 鱖魚卵母細胞發育的組織學和超微結構觀察[J]. 華南師范大學學報(自然科學版), 2007,1: 98-103.
[21] 樓允東. 組織胚胎學[M]. 北京: 中國農業出版社,1999. 126-136.
[22] Arocha F. Oocyte development and maturity classification of swordfish from the north-western Atlantic[J].Journal of Fish Biology, 2002, 60, 13-27.
Studies on ovarian development and spawn type of cultured half-smooth tongue sole, Cynoglossus semilaevis
CHEN Cai-fang, WEN Hai-shen, CHEN Xiao-yan, ZHANG Jia-ren, JIN Guo-xiong,SHI Bao, SHI Dan, YANG Yan-ping, HE Feng, LI Ji-fang
(Fisheries College, Ocean University of China, Qingdao 266003, China)
Sep., 16, 2009
Cynoglossus semilaevis; ovarian; spawn type
Seasonal variations of ovarian development and the relationship with Gonadosomatic index (GSI)、hepatosomatic index (HSI) was studied in the cultured half-smooth tongue sole Cynoglossue semilaevis. The results show that ovarian development consists of phaseⅡ,Ⅲ,Ⅳ,Ⅴ,Ⅵ, then cycles to recrudescent phase II; under artificial culture, most fish has phaseⅡovarium from March to May, and the oocytes begin to accumulate vitellin granule from June, then the whole cytoplasm is stuffed with vitellin granule ranging from September to November, suggesting the oocytes growth to mature, after spawning, the ovarium come to assimilative phase Ⅵ or recrudescent phaseⅡ; GSI reaches to an peak during reproduction, then dramatically drop after spawning or recrudescent phaseⅡ while HSI significantly increases to maximum; there is only one breeding season in the half-smooth tongue sole,and it belongs to batch-spawning fish. This study enriches reproductive physiology of fish, and offers the scientific foundation for optimizing the technology of the half-smooth tongue sole artificial reproduction.
Q133
A
1000-3096(2010)08-0029-06
2009-09-16;
2009-11-17
國家“十一五”科技支撐計劃資助項目(2006BAD09A01)
陳彩芳(1982-), 女, 浙江人, 博士研究生, 主要從事魚類繁殖生理學研究, E-mail: chencaifang@ouc.edu.cn; 溫海深, 通信作者,教授, 博士生導師, E-mail: wenhaishen@ouc.edu.cn
(本文編輯: 譚雪靜)

