在無藻粉飼料中添加包膜氨基酸對幼刺參生長、消化和免疫指標的影響
王吉橋, 張 坤, 姜玉聲, 張劍誠
(1. 大連水產學院 生命科學與技術學院, 遼寧 大連 116023; 2. 大連太平洋海珍品有限公司, 遼寧 大連116045)
在無藻粉飼料中添加包膜氨基酸對幼刺參生長、消化和免疫指標的影響
王吉橋1, 張 坤1, 姜玉聲1, 張劍誠2
(1. 大連水產學院 生命科學與技術學院, 遼寧 大連 116023; 2. 大連太平洋海珍品有限公司, 遼寧 大連116045)
研究了在糊化山藥粉全部替代鼠尾藻(Sargassum thunbergii)粉的飼料中添加不同方法處理及不同種類包膜氨基酸的飼料對刺參(Apostichopus japonicus Selenka)幼參生長、消化及免疫指標的影響。試驗1, 在水溫13.0~18.0℃下, 將平均體質量為2.27g的刺參飼養在18個50 L(50 cm×40 cm×30 cm)的塑料水槽中(15頭/槽), 投喂添加淀粉包膜的纈氨酸、蘇氨酸、亮氨酸等多種氨基酸的飼料。40 d的飼養表明, 幼參的特殊增重率(RSG)和對飼料蛋白及脂肪的消化率隨飼料中添加包膜氨基酸水平的增加而逐漸升高, 其中添加包膜氨基酸水平最高組的幼參顯著高于未添加包膜氨基酸的對照組(P<0.05)。試驗2, 在水溫10.0~19.0℃下, 給平均體質量1.55 g的刺參投喂在山藥粉完全替代鼠尾藻粉的對照飼料(S0)中分別添加0.37%明膠包膜賴氨酸(S1)、0.37%包膜賴氨酸加0.38%包膜蛋氨基酸(S2)和0.37%包膜賴氨酸、0.38%包膜蛋氨酸加0.39%包膜蘇基酸(S3)的飼料。60 d的飼養表明, 幼參的RSG隨飼料中添加氨基酸種類的增加而顯著增高, S3、S2和S1組刺參的RSG分別比S0組高154.6%、82.1%和57.2%。S3組刺參體腔液超氧化物岐化酶(SOD)和酸性磷酸酶(ACP)活力及對飼料蛋白的消化率(87.26%)均顯著高于 S0組,說明山藥粉替代鼠尾藻, 添加明膠包膜賴氨酸、蛋氨酸和蘇氨酸可以顯著提高刺參生長速度及免疫能力。
刺參(Apostichopus japonicus Selenka); 幼參; 氨基酸; 生長; 免疫
高效、廉價和安全的飼料是刺參(Apostichopus japonicus Selenka)養殖業發展的物質基礎。目前常用的刺參飼料中多含有 30%左右采自野生的鼠尾藻(Sargassum thunbergii)、馬尾藻(Sargassum sp.)或其他大型藻類粉[1]。近年來, 由于刺參養殖業發展迅速,養殖規模不斷擴大, 致使鼠尾藻資源被過度采收,生物量急劇降低。自然資源已不能滿足需求量的增加, 供不應求刺激了鼠尾藻粉等價格不斷攀升, 養殖成本不斷增加。大型海藻是近海生態修復和“海洋牧場”建設的重要內容和生態恢復的基礎環節, 即使將來鼠尾藻能人工育苗和成功養殖, 也不宜大面積采收,破壞近海天然牧場[2,3]。因此, 用來源廣、價格適宜的陸生植物淀粉替代鼠尾藻等大型藻粉, 降低刺參飼料成本, 具有重要的經濟、生態和環保價值。
陸生植物中氨基酸不平衡, 含有抗營養因子和消化率低, 在飼料中添加的比例過高時, 魚類生長明顯下降。例如, 用豆粕全部替代魚粉會導致鯉(Cyprinus carpio)[4]、羅非魚(Oreochromis nilotica)[5]和斑點又尾(Ictalurus punctatus)[6]生長下降。但是,大量研究表明, 利用除去抗營養因子的植物蛋白間氨基酸組成的互補性, 添加晶體或包膜的限制性氨基酸可顯著提高替代飼料的效果[7]。王吉橋等[8]發現,刺參攝食添加 0.78%包膜賴氨酸的飼料時, 特殊生長率和對飼料蛋白質的消化率差異顯著(P<0.05)和差異極顯著(P<0.01), 高于攝食對照飼料的刺參。但在陸生植物淀粉替代鼠尾藻等大型藻類粉的飼料中添加包膜氨基酸對刺參生長和免疫影響目前尚未見報道。為此, 作者研究了在山藥粉全部替代鼠尾藻粉的飼料中添加包膜氨基酸對刺參生長、消化和幾種免疫指標的影響, 為合理配制海參飼料, 提高刺參養殖效率, 豐富海參的營養學內容提供依據。
1 材料與方法
1.1 材料
試驗1中采用的1冬齡刺參來自盤錦市每日集團, 平均體質量 2.27 g, 暫養一周后, 挑選大小勻稱、體質健壯的個體270頭, 隨機分成6組, 放入容器為50 L(50 cm×40 cm×30 cm)的硬質塑料水槽中,每槽15頭, 槽內放一片20 cm×30 cm的波紋板, 分別投喂含不同包膜氨基酸的6種飼料(表1)。每種飼料3個重復。
試驗 2采用的刺參來源、暫養、飼養和重復同上, 平均體質量1.55 g, 挑選180頭大小勻稱、體質健壯的個體, 隨機分成4組, 分別投喂含不同明膠包膜氨基酸的4種飼料(表2)。
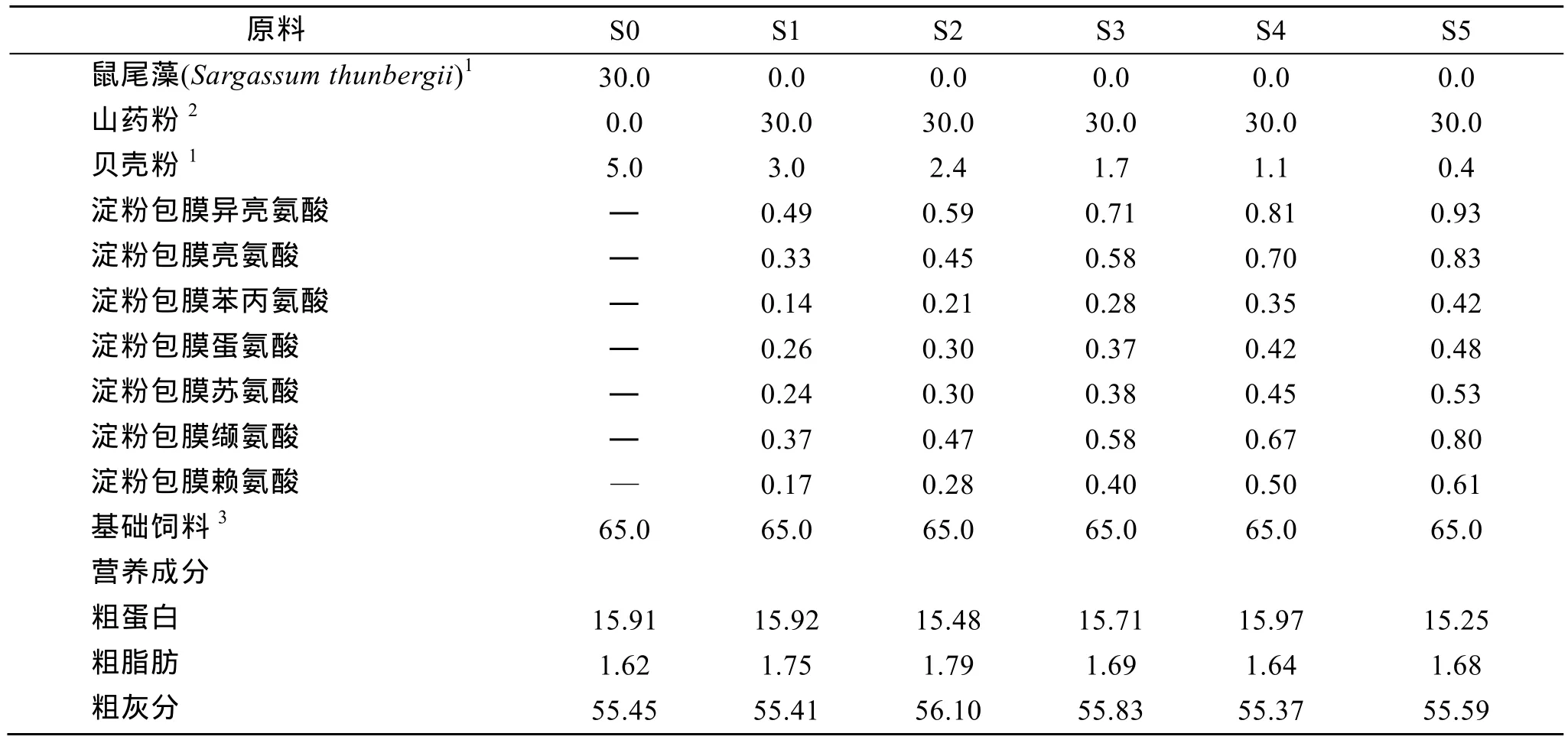
表1 試驗1中飼料的配方及營養成分(%)Tab. 1 Ingredients and approximate compositions of the experimental diets (%)

表2 試驗2中飼料配方及營養成分(%)Tab.2 Ingredients and approximate compositions in the experimental diets(%)
1.2 試驗飼料
1.2.1 包膜氨基酸的制作
試驗1用淀粉包膜氨基酸, 制備方法[9]: 稱取10 g氨基酸, 加入到10 g食用淀粉中, 攪拌均勻、加水繼續攪拌成糊狀。恒溫水浴鍋中加熱攪拌30 min (95), ℃干燥后粉碎, 即為淀粉包膜氨基酸, 4℃冰箱中保存、待用。
試驗 2用明膠包膜氨基酸, 制備方法依梁治齊[10]而略有改進。稱取0.75 g明膠, 加入到20 mL 55℃蒸餾水中, 30 min后加入5g晶體氨基酸, 攪拌均勻, 冷卻后, 加入 20%戊二醛 0.75 mL, 攪拌 2 h, 倒入20 mL丙酮溶液, 靜置、抽濾除去上清液, 以10 mL丙酮洗滌2次, 過濾、沉淀、干燥, 粉碎后得明膠包膜氨基酸, 4℃冰箱中保存、待用。
1.2.2 山藥粉的糊化
為提高山藥粉的消化率, 投喂前按下列方法糊化成α-淀粉[9,11]: 稱取30 g山藥粉, 加入300 mL蒸餾水, 攪拌成勻漿狀, 置于 95℃恒溫水浴鍋中不斷攪拌, 加熱30 min, 淀粉呈半透明的糊化狀。
1.2.3 飼料的配制和投喂
試驗飼料以山藥粉完全替代鼠尾藻粉, 適當添加包膜氨基酸。氨基酸添加量按聯合國糧農組織(FAO)的必需氨基酸推薦模式[12]和王吉橋等[8]推算飼料中氨基酸的總量。配制前, 將飼料原料粉碎過200目篩。原料按表1飼料配方混合均勻, 然后加入到已糊化的山藥粉中, 手工混合均勻, 壓制成薄片狀, 置-20℃冰箱保存。飼料中氨基酸含量采用日立L-8800型氨基酸自動分析儀、依據 GB/T5009.124-2003標準以酸水解法測定, 各試驗飼料中氨基酸組成基本相似。投喂前稱取適量冰凍飼料, 在室溫下放置成松軟適度的膏狀, 均勻涂抹在波紋板上, 置于水槽中。
1.3 飼養管理
試驗 1在大連水產學院水產動物繁育營養實驗室進行。每日上午觀察攝食情況, 以確定投餌量。下午用虹吸法清除殘餌和糞便, 換水 2/3, 然后投喂,連續充氣。養殖用水為經沉淀、曝氣2 d的天然海水。水溫13.0~18.0, ℃鹽度29~32, pH7.5~8.1, 溶解氧>7.0 mg/L。每20 d測一次刺參體質量。試驗2水溫為10.0~19.0℃。其他同試驗1。
1.4 測定指標與方法1.4.1 飼料消化率的測定
在試驗飼料中摻入0.5% Cr2O3, 采用SC/T1089-2006提供的方法測定。連續投喂后用虹吸法收集糞便及殘餌。早、中、晚各收集一次, 直至足量。糞便及殘餌經鼓風干燥箱處理后, 冷藏保存。
試驗飼料中蛋白質、脂肪、干物質的表觀消化率計算公式為:
蛋白質表觀消化率(%)=

1.4.2 生長指標的測定
在養殖的第20、40、60天用電子天平稱量(精確至 0.01g)各水槽中刺參的總體質量,刺參的特殊生長率(specific growth rate, RSG)計算公式為:
RSG(%/d)=[(In 末體質量-In 初體質量)×100]/飼養天數
1.4.3 體壁常規營養成分的測定
試驗1和試驗2結束后, 將各組所有刺參解剖,去除內臟, 用過濾海水沖洗后, 烘干、研磨后放入干燥器內備用。采用凱氏定氮法、105℃常溫干燥法、索氏抽提法(以無水乙醚為抽提液)和高溫灼燒法測定粗蛋白質、水分、粗脂肪和灰分含量。
1.4.4 酶活性的測定
體腔液提取:用 1 mL注射器從刺參體后部抽取體腔液后, 迅速注入已放置在冰盒中的0.5 mL離心管中, 于冷凍離心機(0~1)℃、3 000 r/min條件下,離心15 min, 取上清液備用。
酸性磷酸酶(ACP)活性采用磷酸苯二鈉法測定;超氧化物岐化酶(SOD)活性采用黃嘌呤氧化酶法測定, 每毫升反應液中 SOD抑制率達 50%時對應的SOD量為一個SOD活力單位(U)[13]。
粗酶液提取: 在冰盤中解剖取出刺參腸道, 擠出其內容物, 用去離子水沖洗干凈后用濾紙吸干,迅速稱量質量, 冰浴(0~4)℃條件下勻漿, 稀釋10倍制成勻漿液。-4℃離心(3 000 r /min)30 min, 取上清液備用。
蛋白酶活性采用福林-酚法測定; 淀粉酶活性采用碘-淀粉比色法測定。
1.5 數據處理
數據均以平均值±標準誤差表示, 用 SPSS16.0軟件包進行單因素方差分析, 用 Duncan’s多重比較法比較各組間平均值的差異顯著性, 以P<0.01為差異極顯著, P<0.05為差異顯著。
2 結果
2.1 刺參攝食添加不同包膜氨基酸飼料時的成活和生長
在試驗 1和試驗 2中, 各組刺參的成活率均為100%, 說明以山藥粉完全替代鼠尾藻粉, 適當添加包膜氨基酸對幼參的成活率無顯著影響(P>0.05),但飼料中添加包膜氨基酸的種類對刺參生長卻有所不同。
在試驗1中, 40 d的飼養表明, 幼參的RSG隨飼料中添加包膜氨基酸水平的增加而逐漸升高,其中S5組刺參的RSG顯著高于未添加包膜氨基酸的對照組(S0組)(P<0.05), 比 S0組高 23.39%, 而其他組幼參的RSG則顯著低于S0組(表3)。
在試驗2中, 60 d的飼養表明, 幼參的RSG隨飼料中添加氨基酸種類的增加而逐漸升高。當飼料中添加0.37%包膜賴氨酸、0.38%包膜蛋氨酸和 0.39%包膜蘇氨酸(S3組)時,RSG值最大。試驗結束時, 各試驗組RSG差異顯著, S3組、S2組、S1組刺參的RSG分別比對照組(S0組)高154.6%、82.1%和57.2%(表4)。
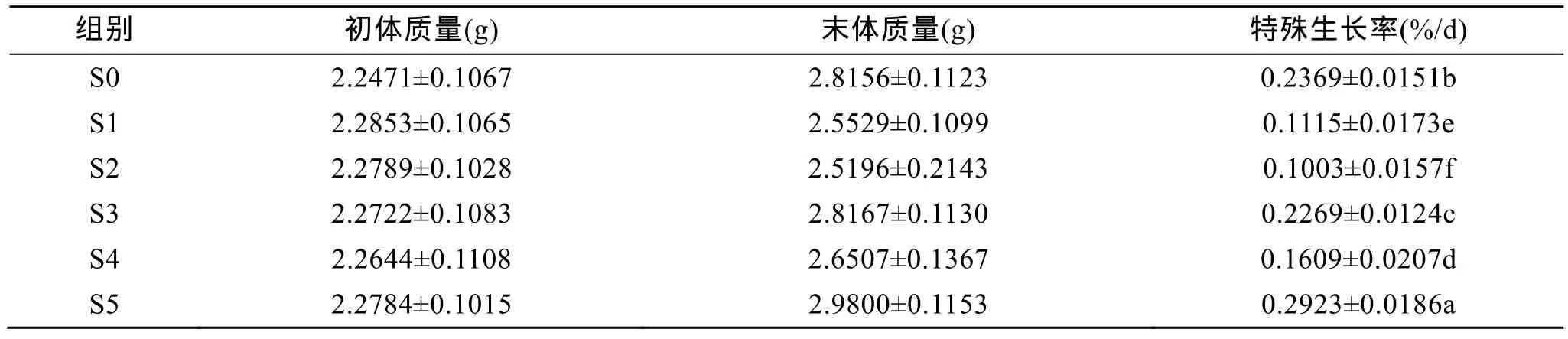
表3 試驗1中刺參攝食添加不同包膜氨基酸飼料時的生長 (平均值±標準誤差, n=2)Tab. 3 Growth of the sea cucumber fed the diets containing different coated amino acids in trail 1 (mean ± SD, n=2)
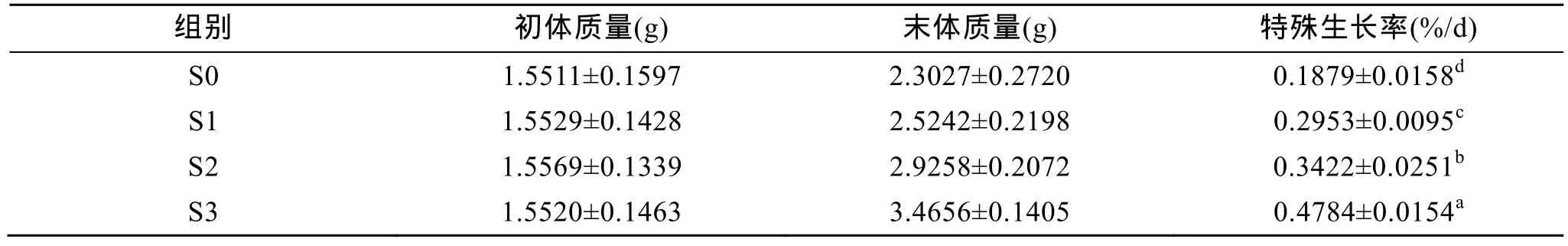
表4 試驗2中刺參攝食添加不同包膜氨基酸飼料時的生長 (平均值±標準誤差, n=3)Tab. 4 Growth of the sea cucumber fed the diets containing different coated amino acids in trail 2 (mean ± SD, n=3)
在試驗2中, 攝食對照飼料的刺參(S0)的RSG低而穩, 始終慢于攝食添加包膜氨基酸飼料的刺參(圖1, A)。但攝食添加不同包膜氨基酸飼料的幼參在不同飼養階段生長速度不同。試驗的頭20天時, 攝食添加賴氨酸和蛋氨基酸飼料刺參(S1和 S2組)的RSG低于攝食對照飼料的刺參(圖1, B); 試驗的第40和60天時, 攝食添加賴氨酸和蛋氨基酸飼料刺參(S1和S2組)的RSG顯著高于攝食對照飼料的刺參; 而攝食添加三種包膜氨基酸飼料刺參(S3組)的RSG始終顯著高于攝食對照飼料的刺參(圖1, B), 而且隨飼養時間的延長RSG值增加越顯著, 表明添加這3種氨基酸極顯著地優于不添加和只添加一、二種氨基酸。
方差分析也證明了上述觀點: 第一階段(0~20 d), 以S3組和S0組RSG值較大,顯著高于S2、S1組;而S3組又顯著高于S0組; S1組和S2組差異不顯著。第二階段(20~40 d), 各組RSG均顯著高于S0組, 而S1組又顯著高于S2、S3組; S3組和S2組差異不顯著。第三階段(40~60 d), 以S3組和S2組RSG值較大,顯著高于S1、S0組; 而S3組又顯著高于S2組; S1組和S0組差異不顯著。
2.2 幼參攝食添加不同包膜氨基酸飼料時的表觀消化率和體成分
試驗 1中, 刺參對飼料蛋白質消化率隨飼料中氨基酸添加水平的增加而有所升高。S5組顯著高于其他各組, S3組、S4組顯著高于S0組、S1組(P>0.05)(表5)。攝食含不同包膜氨基酸飼料的刺參對飼料脂肪消化率差異不顯著(P>0.05)。S5、S0和 S1組刺參對干物質消化率顯著高于S2、S4、S3組。
試驗 2中, 攝食添加三種包膜氨基酸飼料的刺參(S3組)對飼料蛋白質消化率顯著高于其他組。各組刺參對飼料蛋白質消化率與各組試驗刺參的特殊生長率變化趨勢基本相吻合(表6)。在飼料中添加不同種類的包膜氨基酸誘導幼參腸道蛋白酶的活力增加, 促進了對飼料中蛋白質的消化和吸收。攝食含不同包膜氨基酸飼料的刺參對飼料脂肪消化率及干物質消化率均差異不顯著(P>0.05)。刺參攝食含不同氨基酸飼料時體成分也差異不顯著(P>0.05)(表 7,表 8)。
2.3 刺參攝食含不同包膜氨基酸飼料時幾種免疫酶的活性
試驗2中, 幼參體腔液中ACP活力隨飼料中添加氨基酸種類的增加而增強(圖2)。攝食含三種包膜氨基酸飼料的S3組刺參體腔液中SOD和ACP活力最高, 與S0組差異顯著, 與其他各組差異不顯著(圖3)。
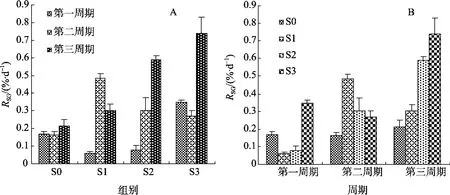
圖1 試驗2中各試驗組幼參在不同飼養階段生長速度Fig. 1 Growth of the sea cucumber fed the experimental diets during various periods in trail 2
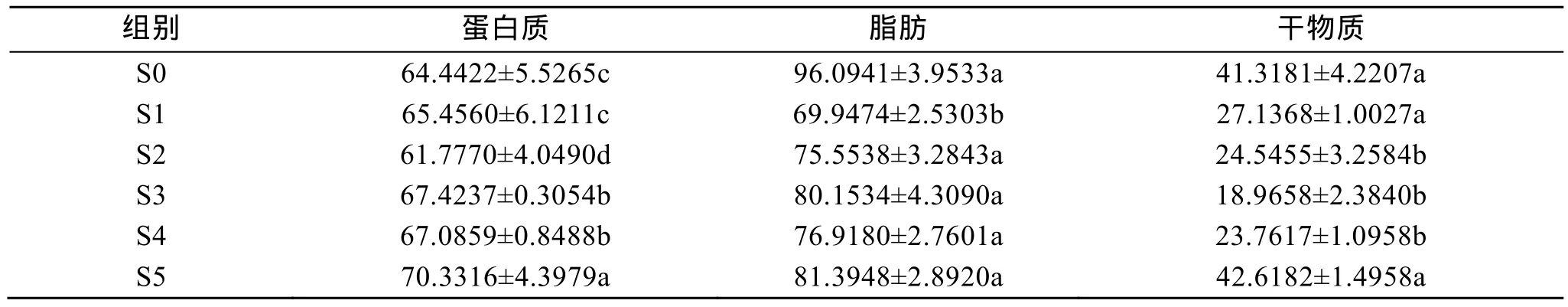
表5 試驗1中刺參攝食含不同包膜氨基酸飼料的表觀消化率(%, n=2)Tab. 5 Apparent digestibility of the sea cucumber fed the experimental diets in trail 1 (%, n=2)
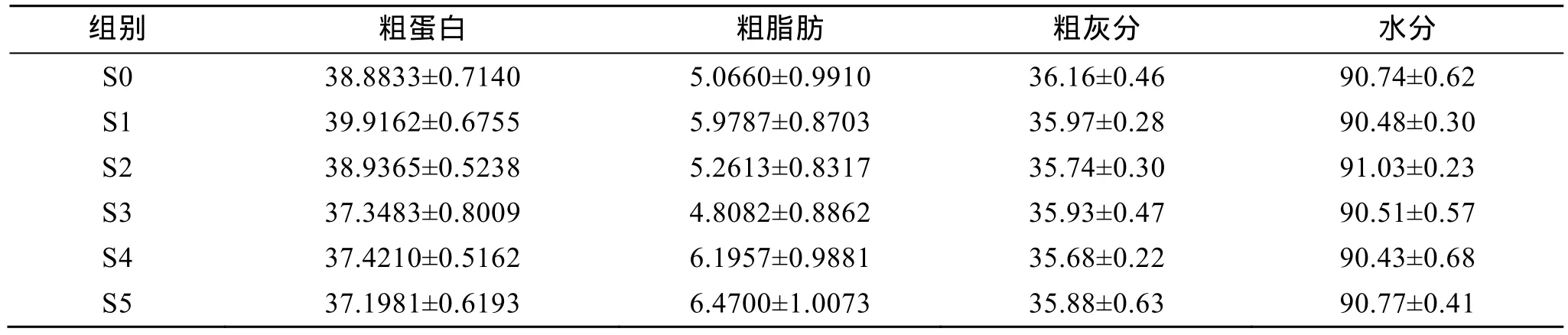
表7 試驗1中刺參攝食含不同包膜氨基酸飼料的體成分(%, n=3)Tab. 7 Approximate composition of the sea cucumber fed the experimental diets in trail 1 (%, n=3)
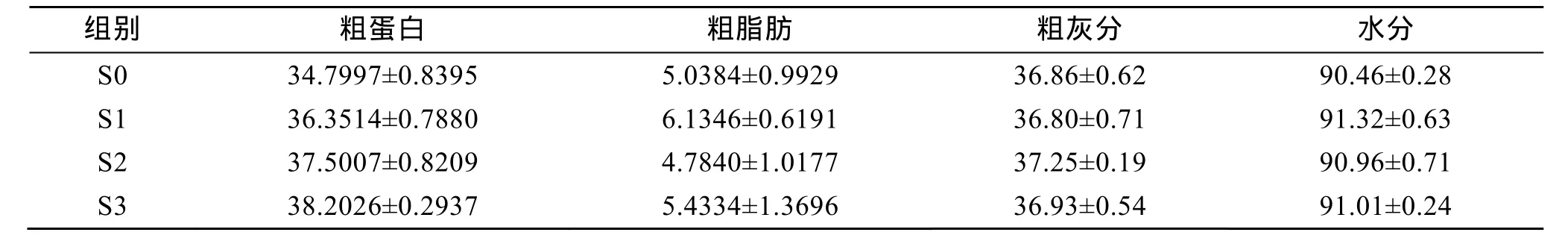
表8 試驗2中刺參攝食含不同包膜氨基酸飼料的體成分(%, n=3)Tab. 8 Approximate composition of the sea cucumber fed the experimental diets in trail 2 (%, n=3)
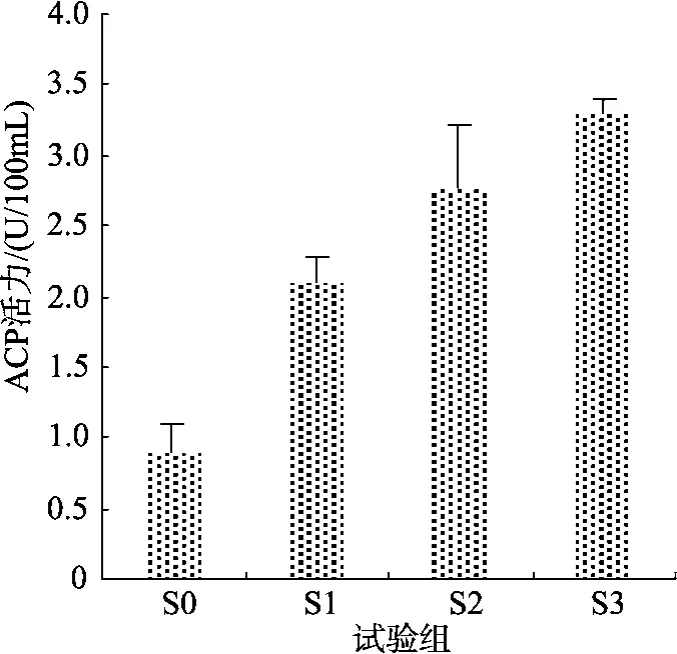
圖2 試驗2中各試驗組刺參ACP的活性Fig. 2 Acid phosphatase activity in sea cucumber fed different diets in trail 2
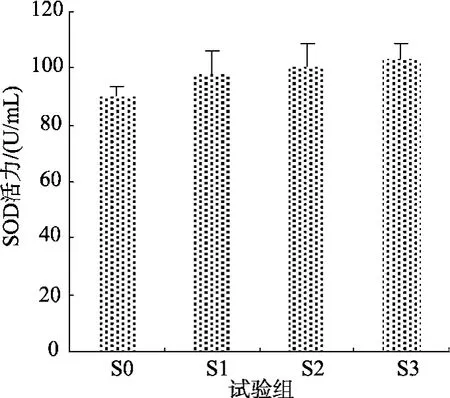
圖3 試驗2中各試驗組刺參SOD的活性Fig. 3 Superoxide dismutase activity in the serum of sea cucumber fed different diets in trail 2
2.4 刺參攝食含不同包膜氨基酸飼料時幾種消化酶的活性
試驗 1中, 刺參攝食含不同數量包膜限制性氨基酸飼料, 消化道中淀粉酶活力最高, 其中 S2、S3組的淀粉酶活力最高, 為SO組的1.88、1.93倍。對蛋白酶的分析表明, S5組與S0組差異不顯著, 可能是存在一定試驗誤差所導致, 其他各組均顯著高于S0 組(圖 4)。
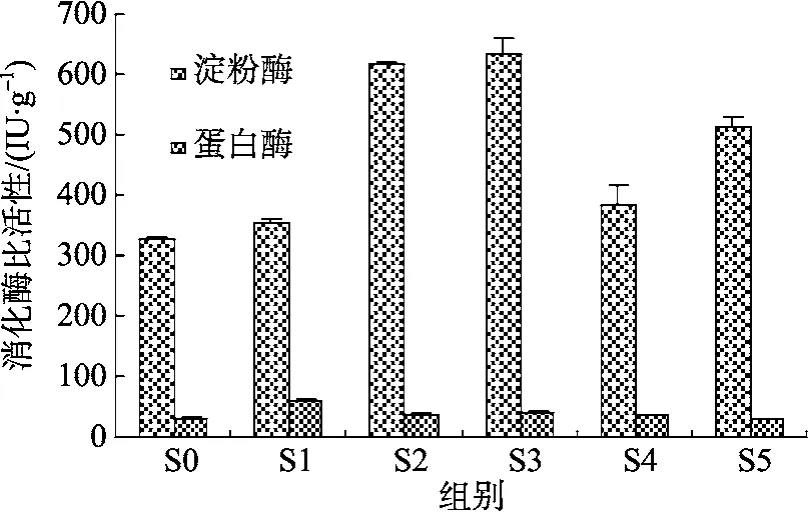
圖4 試驗1中各試驗組幼參幾種消化酶的活性Fig. 4 Activities of digestive enzymes in the sea cucumber fed the experimental diets in trail 1
3 討論
目前, 在水產飼料中補充限制性氨基酸, 通常僅添加1~3種氨基酸, 添加量也相對較小。本試驗添加了多種氨基酸, 添加量在0~4.6%之間, 以探討在刺參飼料中添加多種氨基酸對刺參生長的影響。
本實驗室研究了用馬鈴薯、小麥、玉米、山藥等淀粉取代 20%鼠尾藻的飼料對刺參幼參生長的影響, 結果表明山藥淀粉組及馬鈴薯淀粉組顯著高于鼠尾藻粉組, 說明山藥淀粉及馬鈴薯淀粉能夠有效替代鼠尾藻粉, 在滿足刺參生長需要的同時顯著提高了其生長。但是陸生植物淀粉添加到水產飼料中投喂時, 其不溶于冷水, 凝沉性大等, 導致養殖水體出現起泡、混濁, 影響攝食。本試驗所用淀粉為預糊化淀粉, 與天然原淀粉的明顯區別是能夠在冷水中溶解, 溶脹后具有一定黏度, 與飼料中其他成分混合均勻后, 可以較好地依附在養殖網片上, 避免了養殖水體起泡、混濁, 影響攝食。
在試驗1中, 僅S5組的RSG顯著高于S0組。但S0組卻顯著高于 S4、S3、S2、S1組。這說明在飼料中添加多種氨基酸能夠促進刺參的生長, 但其利用效率并不高。這可能與包膜方法有關。在加工的濕熱反應環境下, 飼料所含的氨基化合物(蛋白質、氨基酸及醛、酮等)與羰基化合物(糖類)反應生成褐色聚合物的現象稱為褐變反應, 也稱為 Maillard反應[14]。動物缺乏水解這類縮合物的酶, 使賴氨酸的利用率下降, 影響了蛋白質的消化利用。最常見的是用褐變的大豆粕、棉籽粕、菜子粕和葵花籽粕等植物性高蛋白質油粕作為飼糧主要蛋白源,其危害更為明顯[15,16]。試驗表明, 賴氨酸最易在褐變反應中損失,色氨酸、組氨酸、蘇氨酸等在加熱過程中也會參與反應而失去功能, 室溫條件下氨基與羰基共存時都會引起 Maillard反應, 當加熱后特別是 60℃以上時反應速度加劇[17]。在本試驗1中, 包膜氨基酸壁材為淀粉, 糊化溫度為95, ℃加工過程為實驗室自行制備, 加工條件受到較大限制導致加工過程中出現Maillard反應, 使添加的氨基酸在加工過程中損失,整體氨基酸含量降低, 刺參有效攝入量也隨之減少,這是導致僅 S5組RSG顯著高于 S0組的原因之一。另一方面, Maillard反應時間太長,反應過度,容易產生過度的焦糖化反應,產生苦味,使產品整體風味較差[18]。本次試驗糊化反應時間為 30 min, 糊化完成后需在鼓風干燥箱中干燥。反應時間過長, 干燥溫度過高, 飼料的適口性降低, 刺參不喜攝食, 可能是僅S5組RSG顯著高于S0組的另一原因。
本試驗 2中添加用明膠包膜的氨基酸顯著提高了刺參的生長性能, 表明刺參能夠有效利用氨基酸,這與王吉橋等[8]先前的試驗結果相一致。明膠可能是較好的包膜材料。它使氨基酸在水中的溶失率降低;在消化道中需先降解包膜材料后才可被吸收, 吸收速度能與結合蛋白同步, 在消化過程中釋放游離氨基酸的速率幾乎和蛋白質釋放氨基酸的速率相同,因此提高了包膜氨基酸的營養價值和利用效率。
酸性磷酸酶是動物體內巨噬細胞內溶酶體的標志酶和最有代表性的水解酶之一。在動物體內如果某一種酶缺失或活性降低, 就會影響細胞的代謝而發生疾病。研究表明, 山藥多糖可明顯提高環磷酞胺引起的免疫功能低下的小鼠腹腔巨噬細胞吞噬百分率和吞噬指數[19]。本試驗中, 攝食用山藥粉替代鼠尾藻粉添加包膜氨基酸飼料的刺參幼參, 體腔液中ACP活性大幅度提高, 其中 S3組 ACP活性是對照組刺參的3.7倍。其原因可能是山藥促進了刺參的攝食, 使包膜氨基酸的攝入量增加, 而氨基酸攝入量的增加又誘導幼參蛋白酶及淀粉酶的分泌量增加,活性增強, 提高飼料蛋白質的利用率, 加速了生長。
SOD是生物體內一種重要的抗氧化酶。羅氏沼蝦(Macrobrachium rosenbergii) 受莫格球擬酵母感染致病后, 肝胰臟中的SOD 活力顯著降低, 表明病蝦的代謝功能和免疫功能明顯衰退和紊亂[20]。南美白對蝦(Litopenaeus vannammei) 攝食免疫多糖后,血淋巴中的 SOD 活性有一定的提高[21]。山藥中的黏液多糖可刺激和調節人體免疫系統,使被抑制的細胞免疫功能部分或全部恢復正常[22]。山藥糖蛋白能清除羥自由基, 隨著濃度的增加, 清除作用增強[23]。山藥多糖能清除黃嘌呤-黃嘌呤氧化酶體系產生的超氧自由基及 Fenton 反應體系產生的羥自由基, 明顯提高衰老型小鼠體內紅細胞超氧化物歧化酶(SOD)活力及血過氧化氫酶(CAT)活力[24]。本試驗中,S3組幼參體腔液中SOD活力是對照組(S0組)的1.14倍。經核算, 各試驗組飼料成本分別為 S0組 7.67元/kg、S1組6.55元/kg 、S2組6.68元/kg 、S3組6.79元/kg。S3、S2和S1組飼料成本分別比S0組降低了11.47%、12.90%和14.60%。可見, 用山藥粉替代鼠尾藻并添加包膜氨基酸不僅提高了幼參體內免疫因子的活性, 增強了機體的抗氧化能力, 還能降低刺參飼料成本, 減輕了對海洋環境修復起重要作用的植被的壓力。
[1] 楊娟, 于凱先, 郭相平. 刺參池塘養殖技術[J]. 齊魯漁業, 2004, 11: 6-9.
[2] 許妍, 董雙林, 金秋. 幾種大型海藻對赤潮異彎藻生長抑制效應的初步研究[J]. 中國海洋大學學報, 2005,35(3): 475-477.
[3] Jeong J H, Jin H J, Sohn C H, et al. Algicial activity of the seaweed Corallina pilulifera against red tide microalgae [J]. Journal of Applied Phycology, 2000, 12:37-43.
[4] Violas S, Mokad Y, Arieli Y S. Effect of soybean proceeding methods on the growth of carp [J]. Aquaculture, 1983, 32: 27-38.
[5] Wilson R P, Poe W E, Robinsin H. Leucine, isoleucine,valine and histidine requirements of fingerling channel catfish [J]. J Nutr, 1980,110:627.
[6] Chhom L. Effect of dietary pH on amino acid by shrimp[A]. 編者. Advance of the Studies on Nutrition of Finish and Shellfish [C]. Guangzhou: Zhong Shan University Publishing House, 1995. 287-300.
[7] Aoe H, Matsuda I, Abe T, et al. Nutrition of protein in young carp: nutrition value of free amino acids [J]. Bull Jap Soc Sci Fish, 1970, 37: 407-413.
[8] 王吉橋, 蔣湘輝, 姜玉聲, 等. 在飼料中添加包膜賴氨酸對仿刺參幼參生長、消化和體成分的影響[J]. 水產科學, 2009, 28(5): 241-245.
[9] 胡友軍, 周安國, 楊鳳, 等. 飼料淀粉糊化的適宜加工工藝參數研究[J]. 飼料工業, 2002, 23(12): 5-8.
[10] 梁治齊. 微膠囊技術及其應用[M]. 北京: 中國輕工業出版社, 1999. 255-256, 348-350.
[11] 曹衛東. 飼料糊化技術的意義、目的及應用[J]. 漁業現代化, 2002, 3: 29-30
[12] 黃濤, 陳喜斌, 蔡江. 螺旋藻的生物活性成分分析及其在飼料中的應用[J]. 飼料工業, 2003, 24(7): 21-23.
[13] 桂遠明. 水產動物機能學實驗[M]. 北京: 中國農業出版社, 2004. 113-212.
[14] 李淑媛. 美拉德反應產物抑制冷凍甘薯片的褐變[J].食品與生物技術學報, 2006, 25(3): 46-51.
[15] 王之盛, 周安國, 陳德. 加工對配合飼料蛋白質營養價值的影響[J]. 四川農業大學學報, 2000, 18(1):57-61.
[16] 馬得. 飼料褐變的危害及對策[J]. 飼料與畜牧, 2005,6: 16-17.
[17] 蘭云賢, 陳代文, 林鵬. 美拉德反應對養分消化代謝影響的研究現狀[J]. 飼料工業, 2005, 26(9): 12-16.
[18] 蔡培鈿, 白衛東, 錢敏. 美拉德反應在肉味香精中的研究進展[J]. 中國釀造, 2009, 5: 7-10.
[19] 苗明三. 懷山藥多糖對小鼠免疫功能的增強作用[J].中藥藥理與臨床, 1997, 13(3): 25-26.
[20] 蔡完其. 羅氏沼蝦莫格球擬酵母病的病理研究[J].水產學報, 1996, 20(1): 13-17.
[21] 劉恒, 李光友. 免疫多糖對養殖南美白對蝦作用的研究[J]. 海洋與湖沼, 1998, 29 (2) : 113-118.
[22] 王蕊. 山藥的營養保健功能與貯藏加工技術[J]. 江蘇食品與發酵, 2006, 3: 34-37.
[23] 邵海, 龔鋼明, 管世敏. 山藥糖蛋白微波輔助提取及抗氧化活性研究[J]. 食品工業科技, 2009, 4: 131-133.
[24] 詹彤, 陶靖, 王淑如. 水溶性山藥多糖對小鼠的抗衰老作用[J]. 藥學進展, 1999, 23(6): 356-360.
Effects of dietary supplementation of coated amino acids as sea weed meal substitution on the growth, dietary digestibility and immune indices of juvenile sea cucumber Apostichopus japonicus Selenka
WANG Ji-qiao1, ZHANG Kun1, JIANG Yu-sheng1, ZHANG Jian-cheng2
(1. Life Science and Technology Institute, Dalian Fisheries University, Dalian 116023, China; 2. Dalian Pacific Seafood Co., LtD, Dalian 116045, China)
Dec., 16, 2009
Apostichopus japonicus Selenka; juvenile sea cucumber; amino acid; growth; immune
The effects of supplementation of coated amino acids in the diets replacement of sea weed Sargassum thunbergii meal on the growth, dietary digestibility and immune indices of juvenile sea cucumber Apostichopus japonicus Selenka were studied. In trail 1, sea cucumber juveniles averaging 2.27g were stocked into the plastic tanks(45cm×31cm×30cm) at a density of 15/tank and fed with the diets replacement of yam meal for the sea weed meal (as a control) supplemented with the amino acids coated by starch according to the supplementation of essential amino acids in aquaculture recommended by FAO in triplicates for 40 days with water temperature varying from 13.0 to 18.0 °C. The results showed that there were gradual increase in specific growth rate (RSG), and digestibilities of dietary protein and fat for sea cucumber juveniles fed the diets containing gradual increase of the coated amino acid; significant increase was seen in the diets containing maximum level of amino acid (P<0.05). In trail 2, under similar conditions sea cucumber juveniles (1.55 g) were fed with coated lysine(S1), coated lysine plus arginine (S2) and coated lysine, arginine and threonine (S3) and S0 (control) in triplicates for 60 days with water temperature varying from of 10.0 to 19.0 °C. The results showed that the sea cucumber had increase in SGRas they fed the diet containing more and more types of coated amino acids, i.e. the peak SGR was observed in group S3, 154.6%, 82.1%, and 57.2% higher than that in the S0. There were significantly higher serum superoxide dismutase (SOD) and acid phosphatase, and dietary digestibility(87.26%) than those (73.75%)of the group S0(P < 0.01), indicating that sea weed meal-free diets supplemented with coated amino acids improve the growth, digestibility and immune in the sea cucumber.
Q493
A
1000-3096(2010)09-0036-08
2009-12-16;
2010-03-23
遼寧省教育廳計劃 (No 20060186);遼寧省海洋與漁業廳資助項目
王吉橋 (1950-), 男, 遼寧瓦房店人, 博士, 教授, 研究方向:養殖生態學和水產飼料學, E-mail: jqwang1950@163.com
(本文編輯: 梁德海)

