RT-PCR法快速檢測與鑒別診斷豬瘟病毒野毒株和三個兔化弱毒疫苗株的研究
萬 莉 譯,顏其貴 校
(四川農業大學動物醫學院,四川 雅安 625014)
豬瘟以前又名爛腸瘟,是由黃病毒科黃病毒屬的豬瘟病毒(CSFV)引起家豬和野豬的高度接觸傳染的嚴重傳染病。屬內其他兩個成員為牛病毒性腹瀉病毒和綿羊邊界病病毒,也是能自然感染豬的重要動物病原微生物。從世界各地分離的CSFV株暫被分為3個主要基因群,每一個基因群有3~4個亞群,即 1.1、1.2、1.3;2.1、2.2、2.3;3.1 和 3.2、3.3、3.4。CSFV野毒株的系統發生分析揭示亞群2.1a、2.1b、2.2、3.4在臺灣均確實存在。
CSFV兔化弱毒疫苗株免疫仔豬后,疫苗病毒在組織和血液能持續存在一段時間。用C株(ChineseCstrain)疫苗病毒接種仔豬,接種后2~16d(接種后天數,DPV)內均可在扁桃體或在血液中檢測到疫苗病毒。C株可在8DPV的家豬器官中檢測到,而野豬則在9DPV可檢測到。南非使用的PAV-250疫苗株,用RT-PCR和熒光抗體試驗(FAT)檢測均顯示,28DPV可在扁桃體中檢出。用C-株疫苗病毒肌內注射斷奶仔豬,通過實時RT-PCR檢測,該病毒基因組可在扁桃體持續被檢測到的時間長達42DPV。
采用遺傳多樣性的分子分析技術可以區分密切相關的病毒株。目前已經成功使用RT-PCR、RT-PCR/限制性內切酶分析、RT-PCR/核酸雜交試驗,或實時RT-PCR法來鑒別豬瘟病毒、牛病毒性腹瀉病毒和邊界病病毒。豬瘟病毒基因組分型也是通過使用RT-PCR及E2基因的限制性片段長度多態性來進行的。RT-PCR/限制性內切酶分析用于鑒別豬瘟野毒和疫苗毒已有報道。采用RT-PCR擴增后直接測定擴增片段序列是對豬瘟病毒基因組遺傳進行分析和鑒別野毒株和疫苗株目前使用最廣泛的方法。最近有學者報道,依據單個核苷酸差異設計TaqManMGB探針,采用實時熒光RT-PCR技術用來鑒別韓國野毒株和弱毒疫苗株(LOM株)。多重巢式RT-PCR和多重實時熒光RT-PCR法用來檢測和鑒別野毒株和疫苗病毒C-株亦有研究報道。

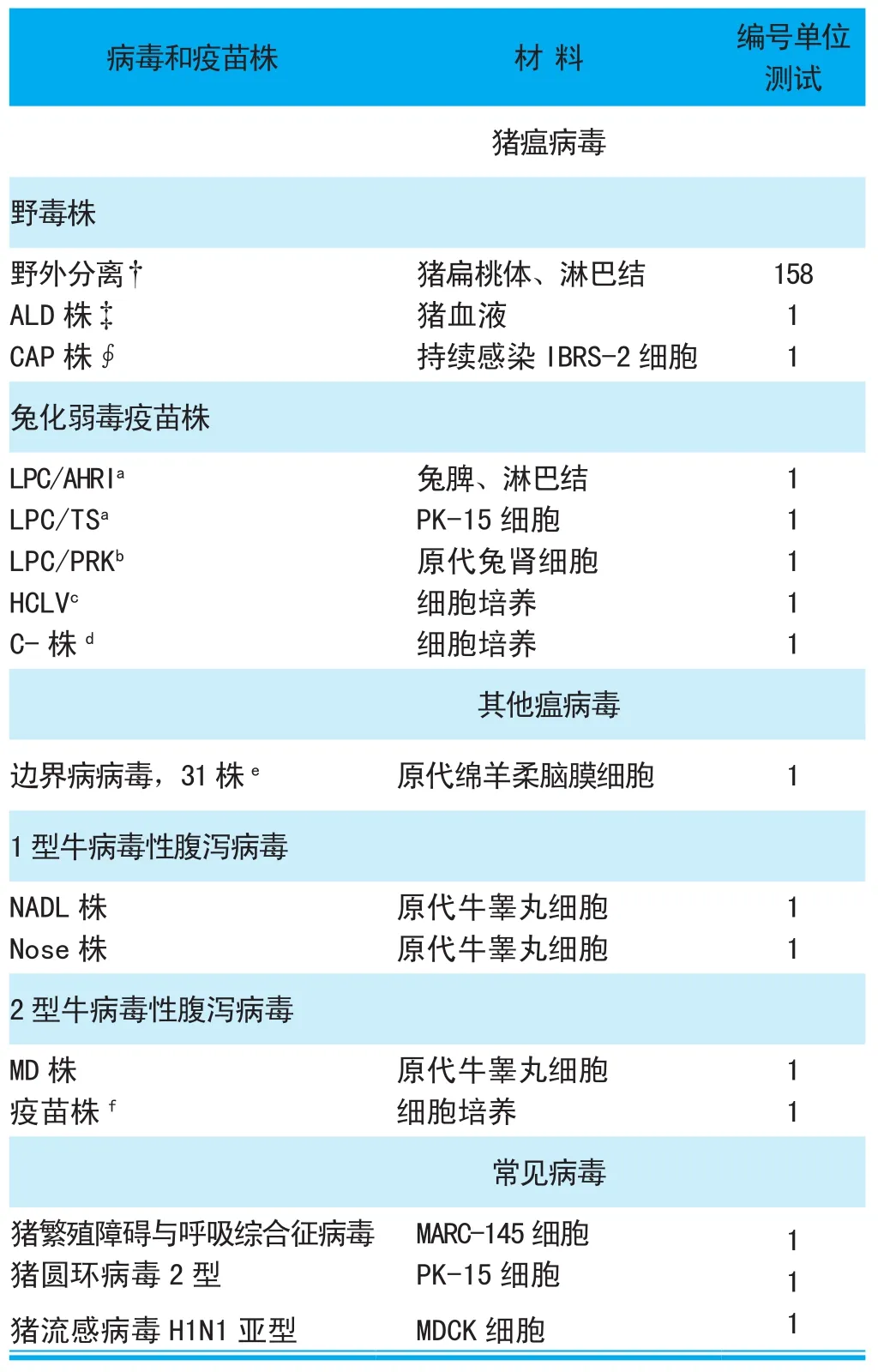
表1 用于本研究的病毒、疫苗株
當前預防控制豬瘟廣泛采用免疫接種兔化弱毒疫苗,差異在于不同國家地區使用不同的兔化弱毒株,主要有 LPC 株(LapinizedPhilippinesCoronel)、HCLV 株(HogCholeraLapinizedVirus)、RiemsC 株(Chinese)、C株(ChineseCstrain)。 通 過 對 C 株、HCLV 株、LPC 株疫苗病毒全長cDNA序列比對分析發現,在其病毒基因組的3′NTR中均存在有12~13nt的富含T的插入序列。進一步對兔化弱毒Porcivac株、Rovac株、俄國LK株以及原始兔化弱毒疫苗株C株的3′NTR非編碼區進行比對,結果顯示4株疫苗病毒中均存在獨特的長12~14nt富含T的插入序列。獨特的長12~14nt富含T的插入序列在豬瘟病毒野毒株中缺失,極有可能是兔化弱毒疫苗株的一個遺傳標記。因此,依據兔化弱毒疫苗株3′NTR序列差異,能夠建立一種RT-PCR技術可以快速鑒別豬瘟病毒野毒株和兔化弱毒疫苗株。本研究是依據上述原理建立的一種簡單、快捷RTPCR檢測與鑒別技術,可以非常有效的應用于豬瘟病毒感染的常規檢測診斷。同時,該方法不僅能夠提高檢測豬瘟病毒的靈敏度,而且可用于鑒別野毒株和兔化弱毒疫苗株。
1 材料與方法
1.1 病毒、疫苗株與臨床樣本
用于該項研究的病毒和疫苗株在表1中列出。來自不同免疫豬場的248個臨床樣本,是2004~2007年間由當地動物疾病控制中心做常規豬瘟診斷確定的樣本并提交動物健康研究所的。所有的扁桃體和淋巴組織樣品均使用MEM培養液制備成10%的懸液,采用RT-PCR檢測以及病毒分離鑒定,在樣品制備的懸液接種到細胞,培養2d后使用熒光抗體試驗(FAT)進行病毒分離檢驗。
1.2 引物設計
從 GenBank上 下 載 72株 CSFV、11株 BDV、15株1型BVDV、8株2型BVDV的部分NS5B和3′-NTR 序 列, 使 用 MegAlign5.03 軟 件 的 ClustalV功 能進行序列比對分析。依據72株CSFV保守的NS5B和3′-NTR序列設計兩套簡并的引物,用于鑒別豬瘟野毒株和兔化弱毒疫苗株。這些引物中包含兔化弱毒疫苗株特有的富含T的插入序列。同時設計兩條上游引物,C5(5′-GTAGCAAGACTGGRAAYAGGTA-3′,Y=CorT,R=AorG;Alfort/187 株基因組位置 11874 ~ 11895bp),C3(5′-ACCCTRTTGTARATAACACTA-3′,Alfort/187株基因組位置12106~12126bp),和一條下游引C6(5′-AAAGTGCTGTTAAAAATGAGTG-3′,Alfort/187基因組位置12240~12219bp)。C5/C6引物對預計能在野毒株和兔化弱毒疫苗株中依次產生367bp和379bp產物,而C3/C6引物對預計依次產生135bp和147bp產物短片段。為了增加敏感性,C3/C6引物對作為內源引物,結合C5/C6引物對進行巢式PCR擴增檢測。
1.3 RT-PCR和巢式 PCR擴增
使用Trizol試劑直接從100μL的10%的組織樣品懸液、稀釋疫苗、血清樣品或細胞培養物中提取病毒RNA。采用一步法RT-PCR,50μL的反應體系包括1U超耐熱DNA聚合酶、10×buffer(包括 1.5mmol的 MgCl2)、8URNA 酶抑制劑、2UAMV,每條引物10pmole,0.1mmol的 dNTP和5μL 的病毒 RNA 模板。在 GeneAmpPCRSystem9700基因擴增儀中進行。反應程序為:42℃,反轉錄,40min;94℃,變性3min ;94℃變性40s,55℃退火40s,72℃延伸40s,30 個循環 ;最后72℃延伸7min。當需要更高靈敏度時,巢式PCR擴增以同法進行,1.0μLRT-PCR擴增產物做模板,C3/C6做巢式引物。
1.4 用RT-PCR和巢式PCR檢測實驗感染豬的血清樣本
用含有105TCID50滴度的豬瘟野毒株(92-TC1株)的全血肌內接種4頭8周齡的SPF豬。分別于接種0d、1d、2d、3d、5d、7d、10d 和 12d 后收集血清樣品。用 RTPCR和巢式PCR擴增方法來決定這些樣品中是否存在豬瘟病毒。
1.5 用瓊脂糖凝膠和高效毛細管電泳分析擴增產物
引物對C3/C6擴增產物使用4%的瓊脂糖凝膠,引物對C3/C5擴增產物使用2%的瓊脂糖凝膠分別進行電泳分析。擴增產物使用eGeneHDA-GT12系統電泳儀,在高效毛細管膠盒GCK-5000F上進行分析。10.0μL擴增產物與15.0μLTris-EDTA緩沖液在樣品盤中混合并自動被上樣都到高效毛細管道中,參照eGene操作手冊進行電泳。采用 AM420 方法,10s上樣時間和420s分離時間進行分離。擴增產物的分子質量標準和濃度參考pGEMDNA大小標記。
1.6 敏感性和特異性試驗
為了檢查RT-PCR和巢式PCR反應的敏感性,將豬瘟野毒株O1030/CH/05熒光抗體實驗滴度為103.8TCID50/mL的細胞培養上清液用PBS進行10倍倍比稀釋。總的RNA從每個稀釋度中提取,用于RT-PCR和巢式PCR試驗。在特異性試驗中,2個BVDV-1株,2個BVDV-2株,BDV,PRRSV,PCV-2以及SIV亦采用該法做特異性檢驗處理。
1.7 疫苗株和野毒株非編碼區3′NTR序列分析
引物對C5/C6的RT-PCR擴增產物使用QIAQuick純化試劑盒直接提純。采用BigDye終止法測序反應試劑盒,以RT-PCR原始引物直接測定RT-PCR擴增產物的DNA序列。在這個試驗中,直接測定一個長的富含T片段是不可能的,因為基因滑動的影響。為了克服該困難,使用pBAD/硫拓撲異構酶I耐熱擴增克隆試劑盒,對從疫苗株LPC/PRK和LPC/TS長的富含T的插入序列擴增的RT-PCR產物分別進行克隆。疫苗株LPC/PRK和LPC/TS各自做10個不同的克隆質粒,通過使用標準載體引物對其進行DNA測序。
2 結果與分析
2.1 RT-PCR和巢式PCR的特異性
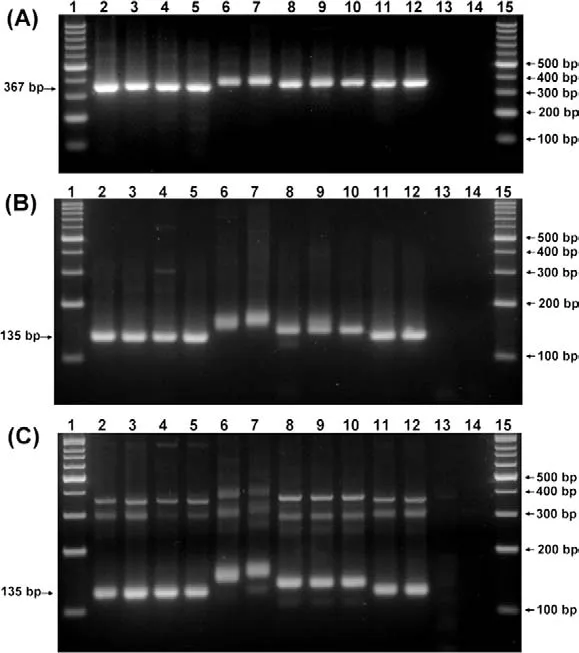
圖1 不同基因型的豬瘟病毒和4個兔化疫苗株擴增產物瓊脂糖凝膠電泳分析
通過利用引物對C5/C6,采用RT-PCR,158株豬瘟野毒株,ALD,CAP株和5株兔化疫苗株(LPC/AHRI,LPC/TS,LPC/PRK,HCLV和C株)基因序列都成功被擴增出。正如預期所料,野毒株病毒有367bp的PCR產物和3個疫苗株病毒(LPC/AHRI,HCLV和C-株)有379bp的PCR產物。LPC/PRK和LPC/TS株病毒略大的產物在2%瓊脂糖凝膠中與野毒株病毒區分開來,但是其他3個疫苗株病毒(LPC/AHRI,HCLV和C株)不能與野毒株區分開(圖1A)。通過利用引物對C3/C6,之前提到的野毒株和疫苗株的基因序列也成功被擴增出。如預期所料,在4%瓊脂糖凝膠中,產生135bp的片段為野毒株,而5株疫苗病毒擴增出范圍在147bp~177bp間的基因片段,因此疫苗病毒的產物能容易與那些野毒株區分開(圖1B)。為了增加靈敏度,建立巢式PCR,引物對C3/C6作為內源引物。在巢式PCR試驗中,158株野毒株豬瘟病毒,ALD,CAP株和5株兔化疫苗株的擴增產物與前面的RT-PCR擴增產物大小一致(圖1C)。其他瘟病毒,包括BVDV(國家動物疾病實驗室),BVDV(Nose),BVDV-1(疫苗株),BVDV-2(疫苗株)和BDV,以及其他常見豬病毒,例如PRRSV,PCV-2和SIV,用這2套引物沒有擴增出片段(資料未顯示)。
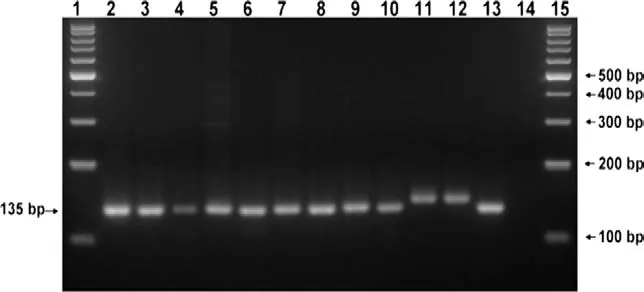
圖2 用引物對C3/C6進行RT-PCR擴增產物瓊脂糖凝膠電泳分析
2.2 用RT-PCR檢測和鑒別臨床樣本中的野毒株和兔化弱毒疫苗株
在本研究中總共有248個臨床樣品進行了試驗。通過RT-PCR,樣品中有35個顯陽性,其中9個被鑒定為野毒株(圖2),以及26個被鑒定為免疫存留的兔化弱毒疫苗株。在病毒中和試驗(VI)中,通過熒光抗體試驗,248個臨床樣本中只有19個對豬瘟病毒顯陽性,10個是疫苗病毒。這些結果顯示RT-PCR試驗比VI試驗靈更敏。
2.3 高效毛細管電泳分析
通過利用高效毛細管電泳系統,引物對C5/C6擴增出的RT-PCR產物很容易被分離成野毒株和疫苗株病毒,甚至差異小至12nt也被分離出。5個不同的病毒基因組代表的4株兔化疫苗株(LPC/AHRI,LPC/TS,LPC/PRK和HCLV)和野毒株豬瘟病毒的平板凝膠觀察分離效果見圖3。
2.4 RT-PCR和巢式PCR的靈敏度實驗
在RT-PCR實驗中,通過利用引物對C5/C6和C3/C6,豬瘟病毒野毒株的檢測限制依次是6.3TCID50/mL和63TCID50/mL,顯示引物對C5/C6的RT-PCR,比用引物對C3/C6靈敏度高10倍。在巢式PCR實驗中,通過使用引物對C3/C6,檢測野毒株豬瘟病毒限制是0.63TCID50/mL,基于這些結果顯示,巢式PCR比RT-PCR靈敏度高10~100倍。
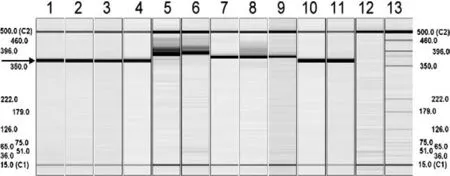
圖3 高效毛細管電泳分析豬瘟病毒(CSFV)野毒株和兔化疫苗株的富含T的插入序列片段

圖4 豬瘟病毒3′NTR富含T的插入序列片段的核苷酸比對排列(從Alfort/187基因組位置12106bp~12185bp)
2.5 野毒株與兔化弱毒疫苗株基因組3′NTR核苷酸序列
從248個臨床樣本中獲得的9個野毒株和8個疫苗型豬瘟病毒的RT-PCR產物用C5和C6做測序引物進行序列測定。DNA測序結果顯示9株野毒株豬瘟病毒屬于豬瘟病毒2.1a亞群,而8株疫苗病毒是屬于1.1亞群(資料沒有顯示)的LPC株。除此之外,亞群1.1(LPC/AHRI,LPC/PRK和LPC/TS)的3個疫苗株和4個不同基因型(2.1亞群的92-TC1,2.1b亞群的90-YL1,2.2亞群的84-KS1,3.4亞群的85-12A)的野毒株亦都測定序列。這7株的序列提交到GenBank,依次為85-12A(EU107748),84-KS1(EU107749),92-TC1(EU107750),90-YL1(EU107751),LPC/AHRI(EU107752),LPC/TS(EU107753),和 LPC/PRK(EU107754)。RT-PCR 產物直接測序結果顯示野毒株基因組缺乏富含T的插入序列,而疫苗株LPC/AHRI含有一個長12bp富含T的插入序列。10個不同質粒克隆測序的結果顯示LPC/PRK和LPC/TS依次含有一個大小在32~42個和27~36個核苷酸間富含T的插入序列。含有最長為42bp和36bp的富含T的插入序列的2個克隆分別來源于LPC/PRK和LPC/TS。通過使用上游和下游引物對它們進行測序,并用這兩個引物獲得了鑒定結果。疫苗株LPC/AHRI,LPC/PRK和LPC/TS的富含T的插入序列的一個序列對比顯示,這3株疫苗株富含T 的插入序列長度分別是 12bp、36bp、42bp(圖 4)。
包括在這個排列里的22個序列加入如下:Alfort/187(X8739),ALD(D49532),Shimen(AF092448),Alfort/Tubingen(J04358),Bresci(M31769),GXWZ02(AY367767),85-12A(EU107748),84-KS1(EU107449),92-TC1(EU107752),LPC/PRK 疫 苗 株(EU107754),LPC/TS 疫苗(EU107753),LPC/AHRI疫苗株(EU107752),HCLV疫苗株(AF531433),C株疫苗株(Z46258),俄國LK疫苗株(AF026718),俄國CS疫苗株(AF099102),Porcivac疫苗株(AF026714),Povac疫苗株(AF026717),Riems疫苗株(U45477),Riem疫苗株(AY259122),和Riems疫苗株(U45456)。
3 討論
豬瘟是具有高度接觸傳染性并保持常態的致死性的豬病。豬瘟兔化弱毒株,例如C株,LPC和HCLV,幾乎完全能誘導對豬瘟的保護。因為弱毒疫苗株能在已經種的豬體內持續一長段時間,它們會干擾用實驗室診斷檢測豬瘟野毒株。在臺灣,為了防制豬瘟,已經強制執行弱毒疫苗的接種工作,因此鑒別野毒株和疫苗株是實驗室診斷豬瘟必備的、重要的能力。RT-PCR之后測序或用限制性酶切是目前在臺灣用于檢測豬瘟并排除疫苗病毒干擾的主要方法。在本實驗中,為了簡化豬瘟鑒別診斷方法,我們基于疫苗株富含T的插入序列建立了一種一步法單管RT-PCR檢測技術,可同時檢測和鑒別豬瘟病毒野毒株和疫苗株。該技術中RT-PCR擴增產物能通過普通瓊脂糖凝膠電泳(圖1B,1C,2)或自動高效毛細管電泳進行分析,后者為快速鑒別豬瘟病毒野毒株和疫苗株提供高分辨率和快速分析(圖3)。臨床試驗結果顯示248個臨床樣本中的26個樣本(10.5%)通過RT-PCR被鑒別為疫苗病毒。類似的結果在以前的研究實驗中獲得,133個野外臨床分離樣品中的18個(13%)來源于疫苗免疫接種豬群,用多重巢式RT-PCR檢測顯示C株疫苗弱毒的存在。因此,在使用豬瘟活疫苗的國家,在常規豬瘟診斷程序中應該考慮檢測到疫苗病毒的可能性。
為了僅能擴增豬瘟病毒不同基因型而不擴增出與之密切相關的2個其他瘟病毒(BVDV和BDV),基于豬瘟病毒基因組保守區設計了2套簡并引物。5個不同基因型的豬瘟病毒,包括158個野毒株豬瘟(2.1a,2.1b,2.2和3.4亞群),ALD和CAP株(1.1亞群)以及5個兔化疫苗株(1.1亞群)能被擴增,而且用這2套引物可以鑒別野毒株和疫苗株,而且沒有從其他瘟病毒(如BVDV-1,BVDV-2和BDV)為模板中觀察到擴增產物,或者以其他常見豬病病毒(如PRRSV,PCV-2和SIV)為模板中觀察到擴增產物。這表明所設計的RT-PCR引物是高特異性的。在敏感性試驗中,RT-PCR的引物對C5/C6和C3/C6能夠各自在一個病毒滴度為6.3和63TCID50/mL時分別檢測豬瘟病毒野毒株。而且,C3/C6能夠被用作巢式PCR的內源引物而獲得更高的靈敏度。該巢式PCR檢測限制提高到0.63TCID50/mL。野毒株實驗感染的豬,在用RT-PCR檢測免疫接種后3d和用巢式PCR檢測免疫接種后2d的樣品時,被檢測出豬瘟病毒顯陽性。該試驗表明本方法是高靈敏的而且能檢測病毒早期感染。
基于單個核苷酸間差異設計特異的TaqManMGB探針,韓國建立一步法實時熒光RT-PCR用于檢測疫苗型和野毒株豬瘟病毒。韓國LOM弱毒疫苗株在233nt位置有一個T,但是韓國野毒株病毒和大多數豬瘟病毒在相同的位置有一個G。因此,通過特異的TaqManMGB探針可能鑒別它們。但是,兔化豬瘟疫苗株,例如LPC,HCLV,C株和RiemC,所有的都在233nt位置含有一個G,因此上述實時熒光RT-PCR似乎不適合用于鑒別野毒株和兔化弱毒疫苗株。另一研究報道基于在一個特異性引物的3′末端的2個核苷酸間差異(GT對AC)而建立的多重巢式PCR用于檢測和鑒別野毒株和C株。但是,LPC株和野毒株豬瘟病毒有相同的AC等位基因。因此,之前描述的這些引物似乎不適合用于鑒別LPC疫苗株和野毒株豬瘟病毒。最近亦有報道建立實時熒光定量多重RT-PCR用于檢測和鑒別野毒株與C株疫苗弱毒。然而,若干臺灣的野毒株(P97和0406/TWN)顯示探針序列內存在多態性。因此,這些臺灣的野毒株很可能不能使用實時熒光定量多重RT-PCR檢測。現有研究報道顯示,有7個疫苗株病毒基因組3′NTR具有12~14nt富含T的插入序列,同時沒有相關報道顯示野毒株基因組中存在這類插入序列。結果顯示,本試驗所建立的RT-PCR技術至少能用于3個兔化弱毒疫苗株檢測,即LPC,HCLV和C株。RiemC疫苗株是一個適應細胞培養的HCLV株衍生毒株。GenBank已有的三個RiemC疫苗株序列顯示富含T的插入序列區域存在差異。其中一個Riem疫苗株(U45477)缺乏富含T的插入序列;另外一個Riem疫苗株(AY259122)含有一個富含T的插入序列和一個缺失位點點;第三個Riem疫苗株(U45456)含有一個28bp富含T的插入序列(圖4)。因此,該檢測技術能否用于RiemC疫苗株檢測尚需進一步研究。
本研究中發現LPC/PRK和LPC/TS株富含T的插入序列比之前報道的更長。為了確定LPC/PRK和LPC/TS疫苗株富含T的插入序列的精確長度,將這些疫苗株的RT-PCR擴增產物克隆制備質粒并進行測序工作。結果顯示LPC/PRK和LPC/TS株富含T的插入序列分別長32~42nt和27~36nt。結合高效毛細管電泳分析的結果確定了最長序列是它們基因組里富含T的插入序列,LPC/PRK 株是 42nt,LPC/TS 株是 36nt。我們在 LPC/ 中國疫苗病毒的衍生毒株基因組中發現42nt與36nt兩個不同長度的富含T的插入序列片段(圖4)。臺灣豬瘟兔化弱毒疫苗株最開始是在20世紀50年代研究生產的。在LEDERLE實驗室里,在兔體中已經歷大約250次連續傳代的一個兔化豬瘟病毒變異Rovac株由Coronel交給了Lee,1952年由Lee從菲律賓引入臺灣。由于這個變異株接種豬表現了嚴重的接種后反應,而且甚至死于明顯的豬瘟,為了獲得一個安全的疫苗株,病毒需要通過兔體更長的連續傳代。在超過800次傳代后,適應兔體的病毒已經完全失去了其毒力,而且變成一個保護豬瘟安全有效的疫苗。這個病毒被指定為LPC株或LPC/中國株,而且種毒保存在動物健康研究所(AHRI)中用于活疫苗的制造。LPC/TS疫苗株來源于LPC/中國疫苗株,經過在PK-15(豬腎細胞)的10代細胞系適應后在一個有限稀釋度克隆2次,隨后在該細胞系里增長21代。為什么原始LPC/中國株含有一個長12nt富含T的插入序列,但是它的衍生毒株LPC/TS含有一個長36nt富含T的插入序列?追溯疫苗發展的過程,發現富含T的插入序列加入在有限稀釋克隆期間發生而不是在組織培養中連續傳代時發生的。LPC/PRK疫苗株一個長42nt富含T的插入序列也是在有限稀釋克隆間獲得的。因為LPC/中國疫苗病毒在兔體中經歷了1050次連續傳代,沒有考慮疫苗病毒統一傳代次數問題。事實上,疫苗含有幾個攜帶不同長度富含T的插入序列的不同病毒顆粒。攜帶了長為36nt、42nt富含T的插入序列、適應組織培養的兩個兔化疫苗病毒,是在疫苗準備期間意外被選擇的。LPC/TS株在PK-15細胞系中增值到107.3TCID50/mL,而且病毒滴度比生長在PK-15細胞中LPC/中國株更高。富含T的插入序列的功能可能增加病毒滴度,以及使得有限稀釋的克隆篩選過程中更容易。
綜上所述,本研究所建立的簡捷一步法RT-PCR,能夠提供一個快速、靈敏診斷技術用于特異性檢測豬瘟病毒,同時能夠鑒別野毒株感染和接種兔化弱毒疫苗株。

