Humanin對STZ誘導培養的皮層神經細胞損傷的保護作用1)
馬國英,楊小榮,趙 欣,趙晉楓,秦華平,史瑞紅,張 策
鏈脲佐菌素(STZ)是一種烷基化物,腦室注射STZ可以導致正常大鼠出現阿爾茨海默病(AD)樣的病理退行性變化,如線粒體功能異常、神經元死亡、學習記憶與認知的障礙等[1]。在離體神經細胞培養中可以引起細胞活力的下降,活細胞數目的減少,乳酸脫氫酶(LDH)的釋放增加。其機制可能是削弱或破壞胰島素的信號轉導,破壞胰島素受體的自身磷酸化和內在酪氨酸激酶活性,增加磷酸化酪氨酸磷酸酶的活性[1]。導致胰島素信號傳導障礙,引起葡萄糖代謝紊亂和能量生成受阻。
Humanin(HN)是在AD病人大腦內發現的由24個氨基酸組成的線性多肽[2],能夠有效抑制多種 FAD(Family Alzheimer’s disease)基因突變和 Aβ衍生物誘發的神經毒作用,初始被認為是 AD特異性或AD相關毒性的神經保護肽。抑制APP、PS1、PS2突變誘發的神經元死亡,拮抗Aβ完整肽鏈以及Aβ片斷誘導的神經毒作用[3]。HN的作用機制還不清楚,但隨著科學研究的逐步深入研究發現,HN可以拮抗NMDA所致的興奮毒[4],拮抗缺氧所致的皮層神經元損傷[5],拮抗OA通過誘導tau蛋白過度磷酸化所致的神經毒[6]。提示HN具有廣泛的神經保護作用,我們前期實驗已經證實STZ對離體培養的神經細胞有損傷作用,本實驗旨在探討HN是否對STZ的神經損傷有保護作用。
1 材料與方法
1.1 實驗動物和試劑 神經細胞培養應用新生1 d~3 d的Wistar大鼠,雌雄不限。STZ、Calcein-AM 購于Sigma公司,HN由上海生工合成胎牛血清(FBS)購于杭州四季青公司,將STZ溶于D-Hanks溶液中,配成 10 mmol/L的母液,由于STZ溶液的半衰期在生理pH值條件下為19 min[7],需要溶解后立即使用。HN溶于三蒸水,配成 1 mmol/L的溶液,0.2 μ mol/L濾器過濾除菌,分裝,-20℃保存待用。
1.2 原代皮層神經細胞培養 用新生1 d~3 d的Wistar大鼠,將大腦皮層神經細胞分離成單細胞懸液,經1 000 r/min離心5 min,按細胞的濃度為1×106/L接種于96孔板或培養皿中,放在37℃,5%CO2培養箱中培養。
1.3 實驗分組 神經細胞培養到第7天時,將培養的神經細胞隨機分組:由于中樞的胰島素主要來自兩方面,由胰島產生即外周血漿中的胰島素透過血腦屏障進入中樞和神經組織自身合成的胰島素[5],為了更好的模擬在體的情況,所以在實驗中都加入胰島素15 μ U/mL。對照組、STZ組以全培液培養;HN組加入終濃度分 別為 0.1 μ mol/L、1 μ mol/L、10 μ mol/L、100 μ mol/L 的HN,16h后除了對照組以外,其他組都加入STZ(100μ mol/L)。在他們共同作用 36 h后觀察細胞的活力以及活細胞數目(LDH,CCK-8和Calcein-AM染色)。
1.4 細胞活力分析 在96孔板中培養的皮層神經細胞經提前16 h加入 HN,再經STZ誘導36 h后,換新的全配液,每空加入10μ L的CCK-8,37℃避光培養2 h,到酶標儀上測定450 nm吸光度值。
1.5 LDH釋放的檢測 將皮層神經細胞培養在培養皿中,經提前16 h加入HN,再加入STZ誘導36 h后,收集細胞培養液進行LDH活性的檢測。
1.6 Calcein-AM染色 將神經細胞培養在有玻片的培養皿中,經提前16 h加入 HN,再加入STZ誘導 36 h后,用 PBS液沖洗3次,加入終濃度為10 μ mol/L的 Calcein-AM,37℃避光培養20 min,再經PBS避光洗滌3次后,在激光共聚焦顯微鏡(Olympus,FV-1000)下觀察細胞,激發波長為490 nm,發射波長為515 nm拍片。
1.7 統計學處理 由SPSS13.0統計軟件進行統計分析,數據用均數±標準差(±s)表示,進行單因素方差分析,P<0.05為差異有統計學意義。
2 結 果
2.1 CCK-8的測定 STZ組與對照組比較,細胞活力明顯下降,STZ組由對照組的 100%降至45.56%(P<0.01);提前16 h加入HN(0.1μ mol/L)不能抑制STZ引起的細胞活力下降(P>0.05),1 μ mol/L HN可以拮抗由STZ引起的細胞損傷,細胞活力升高了 28.47%(P <0.05),10 μ mol/L 、100 μ mol/L HN細胞活力升高了48.47%、53.04%(P<0.01)。詳見圖1。
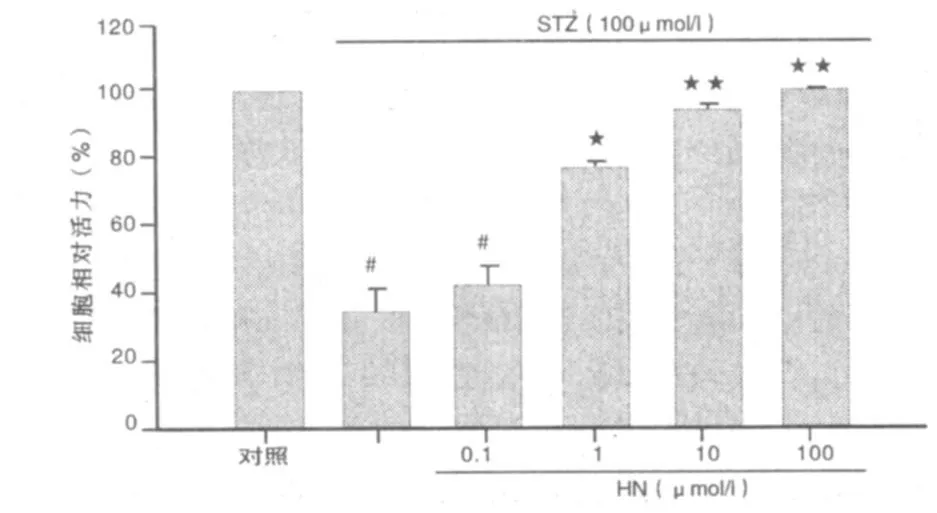
圖1 HN保護STZ誘導皮層神經細胞的損傷作用(CCK-8檢測)
2.2 Calcein-AM染色 STZ處理后,活細胞的數量明顯減少,伴有突起的數目明顯減少;提前加入 HN(0.1 μ mol/L)不能抑制STZ引起的活細胞數目減少;提前加入 HN(1 μ mol/L)可以減少STZ引起的活細胞數目減少,和突起數目有所增加,HN(10 μ mol/L、100 μ mol/L)明顯的抑制STZ引起的活細胞數目減少,而且突起數目更加明顯。
2.3 LDH釋放的檢測 STZ組與對照組比較,LDH的含量明顯增加,釋放量增加52.75%(P<0.01),0.1 μ mol/L HN不能抑制STZ引起的細胞損傷,使LDH的釋放減少9.36%(P>0.05);1 μ mol/L HN可以降低有 STZ引起的細胞損傷,使LDH的 釋放減少18.76%(P<0.05);10μ mol/L、100μ mol/LHN可以明顯降低由STZ引起的細胞損傷,使LDH的釋放減少21.05%和23.65%(P<0.01)。詳見圖2。
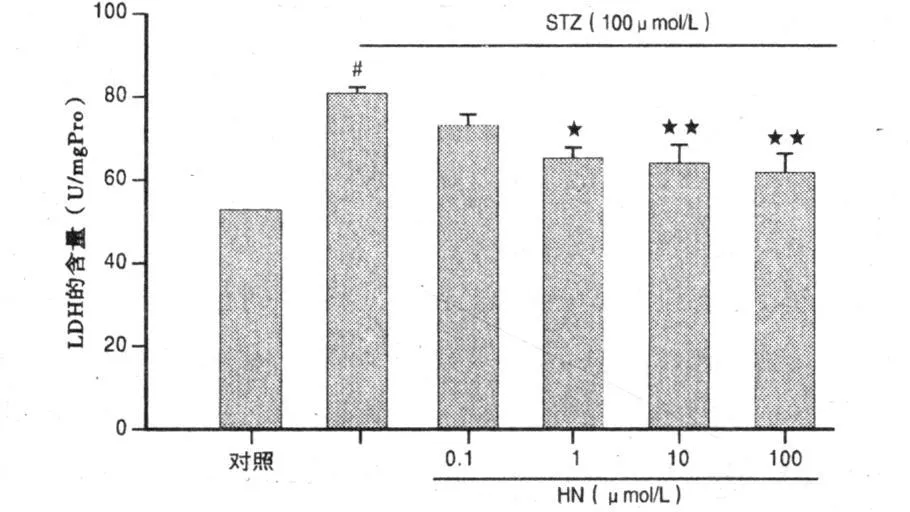
圖2 HN保護STZ誘導皮層神經細胞的損傷作用(LDH釋放水平檢測)
3 討 論
中樞胰島素主要由胰島產生即外周血漿中的胰島素透過血腦屏障進入中樞,然而研究發現神經組織自身也可以合成胰島素并參與代謝調節而發揮作用[8]。此外研究顯示胰島素受體在腦內皮層、海馬等與認知功能密切相關的區域分布較密集。胰島素通過它與細胞膜上的胰島素受體(IR)相結合,通過胰島素信號轉導過程激發細胞內特定的生理生化反應。
研究證實,糖代謝紊亂和AD發病機制有密切的聯系,尤其在晚發性AD中,糖代謝紊亂可能是重要的始動因子。多種證據顯示腦內糖代謝障礙可以引起認知功能受損,而認知功能障礙為主的AD常伴有腦內糖代謝障礙。由于糖代謝紊亂(糖尿病)與AD間有著非常密切的聯系,有可能存在同樣的發病因素和病理過程,因而有專家提出AD可能是一種大腦特異的神經內分泌疾病或者稱“3型糖尿病”[9]。
HN是一個由24個氨基酸組成的線性多肽,在AD病人未受損的腦區發現,具有很強的神經保護作用。初始認為HN是AD特異性的神經保護因子,因為研究發現HN主要抑制與AD發病和病理變化密切相關的一些毒性因素,如HN可以抑制APP、PS1、PS2突變誘發的神經元死亡,拮抗Aβ完整肽鏈及Aβ片斷誘導的神經毒作用。但隨著研究的深入發現,HN可能具有較廣泛的神經保護作用。我們前期的實驗觀察也證實HN可以拮抗缺氧導致的神經損傷,拮抗NMDA引起的神經損傷。因此HN可能不像研究者提出的那樣,只是一種特異的針對AD損傷的神經保護因子,而有可能是一個廣譜的神經保護因子。本實驗以離體神經細胞培養的方法證實HN可拮抗STZ對培養的神經細胞產生的毒性作用,包括細胞活力的逐漸增加,LDH的釋放逐漸增少,以及活細胞數目的逐漸增加,并有劑量依賴性的保護作用。本實驗結果為HN作為廣譜神經保護因子提供了新的證據。由于HN具有的強大的和較為廣泛的神經保護作用,因而可能在神經退行性疾病包括AD的防治都具有重要意義。HN可拮抗STZ誘導的培養神經細胞損傷,發揮神經保護作用。
[1] Steen E,T erry BM,Rivera EJ,et al.Impaired insulin and insulinlike growth factor expression and signaling mechanisms in Alzheimer’s disease is this type 3 diabetes[J].J Alzheimers Dis,2005,7:63.
[2] Hashimoto Y,Niikura T,Tajima H,et al.A rescue factor abolishing neuronal cell death by a wide spectrum of familial Alzheimer’s disease genes and Aβ[J].Proc Natl Acad Sci USA,2001,98:6336-6341.
[3] Hashimoto Y,Ito Y,Niikura T,et al.M echanism of neuropretection by a novel rescue factor humanin from Swedish mutant amyloid precursor protein[J].Biochem Biophys Res Commun,2001,283:460-468.
[4] 崔愛玲.Humanin拮抗NMDA誘導的興奮性神經毒的作用觀察[D].山西醫科大學博士學位論文,2007.
[5] 趙珅婷.Humanin保護培養皮層神經元缺氧性作用損傷作用的觀察[D].山西醫科大學碩士學位論文,2006.
[6] 趙晉楓.Humanin拮抗岡田酸通過誘導T au蛋白過度磷酸化所致神經毒的作用研究[D].山西醫科大學碩士學位論文,2007.
[7] Muller D,Nitsch RM,Wurtman RJ,et al.Streptozotocin increases free fatty acids and decreases phospholipids in rat brain[J].J Neural Transm,1998,105:1271-1281.
[8] 盛樹力.老年性癡呆及相關疾病[M].北京:科學技術文獻出版社,2006:226-266.
[9] Sun M K,Alkon DL.Links between Alzheimer’s disease and diabetes[J].Drugs Today(Barc),2006,42:481.

