A Review of Epidermal Growth Factor Receptor/HER2 Inhibitors in the Treatment of Patients with Non-Small-Cell Lung Cancer
Ramaswamy GOVINDAN
Alvin J. Siteman Cancer Center, Washington University School of Medicine, St Louis, MO
前言
非小細胞肺癌(non-small cell lung cancer, NSCLC)——最常見的肺癌類型,是美國乃至全世界癌癥死亡的首位原因[1,2]。多數患者呈現局部晚期肺癌或轉移性肺癌,并采用基于鉑類的聯合化療來治療;但是,與最佳支持治療相比,此類治療的有效率(response rates, RRs)較低,且總生存期(overall survival, OS)改善甚微。基于ErbB受體家族在NSCLC和其它人類惡性腫瘤的生長和轉移中所起的關鍵作用,表皮生長因子受體(epidermal growth factor receptor, EGFR)酪氨酸激酶抑制劑(tyrosine kinase inhibitors, TKIs)已發展成為靶向抗腫瘤藥物。
目前,在美國和世界各地,小分子EGFR TKI厄洛替尼已被批準用于晚期NSCLC患者的二、三線治療。厄洛替尼獲得監管部門的批準基于III期BR.21試驗的結果,此結果顯示,與安慰劑相比,厄洛替尼可給患者帶來生存期獲益[3]。盡管另一EGFR TKI吉非替尼在美國最初獲得監管部門的批準,但是III期ISEL(Iressa Survival Evaluation in Lung Cancer)顯示其與安慰劑相比無生存期獲益,隨后其指征被僅限于曾獲益于吉非替尼治療的患者[4]。厄洛替尼與吉非替尼均為EGFR TK區三磷酸腺苷(adenosine triphosphate, ATP)結合位點的可逆性競爭性抑制劑。僅少數NSCLC患者采用EGFR TKI治療有效(約10%的白種人和30%-40%東亞患者)。有研究發現,有效性與特定的分子特征相關[5],特別是EGFR活化突變[6]。還有研究顯示,EGFR基因拷貝數的升高與EGFR TKI的有效性相關[7-9]。盡管可逆性EGFR TKI具有諸多優點,但是在多數起初有效的患者中,這些藥物的療效受限于耐藥性的產生,這將導致在中位時間12個月之后患者出現腫瘤進展和腫瘤復發[10]。
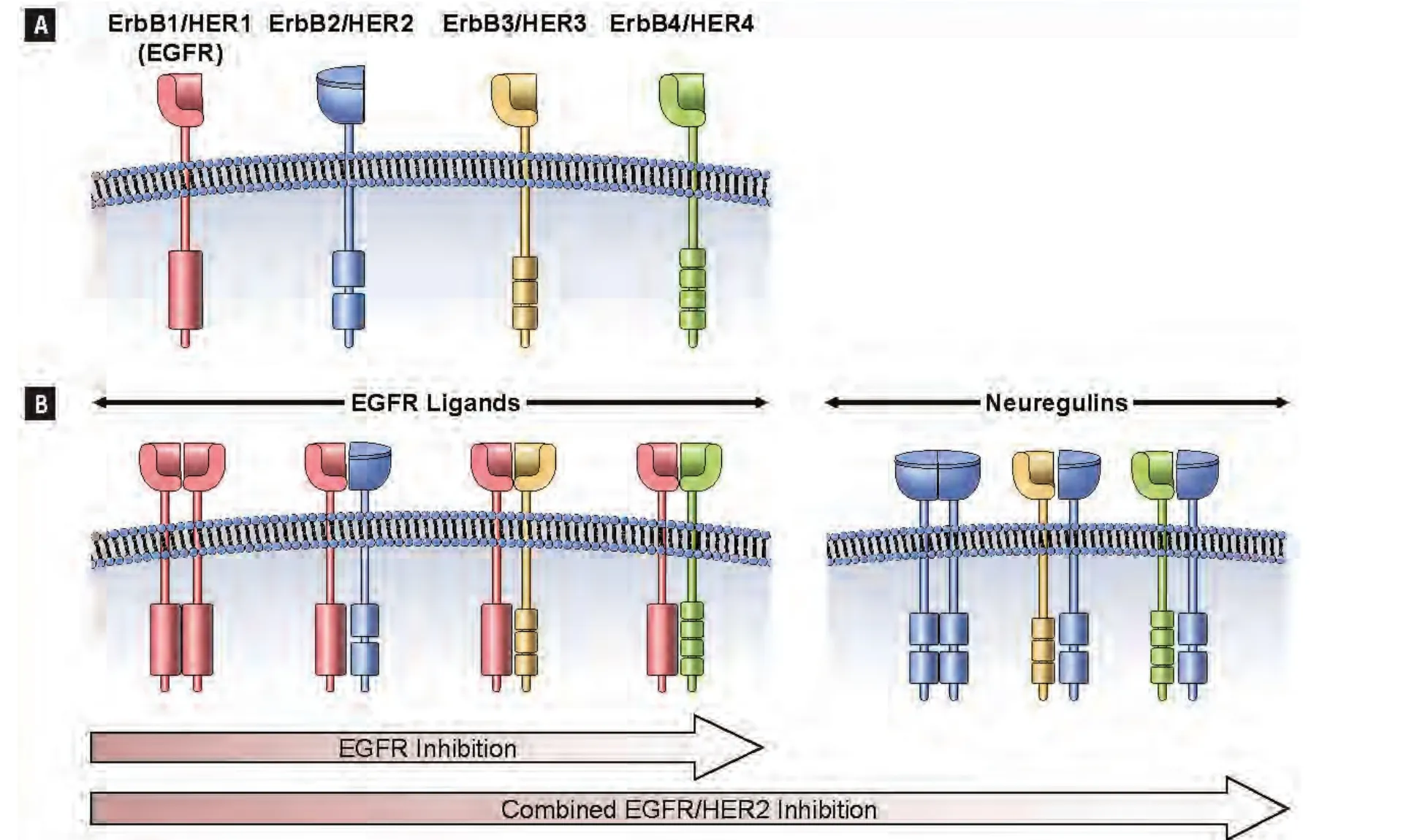
Fig 1 Cooperative ErbB Signaling and Differential Activity of Sole EGFR Inhibition Versus EGFR/HER2 Inhibition(A) The 4 ErbB receptors are encoded by the genes EGFR (ErbB1), HER2 (ErbB2), HER3 (ErbB3), and HER4 (ErbB4). The 11 growth factors that bind to these receptors include EGF, transforming growth factor-α, amphiregulin, °-cellulin, epigen, epiregulin, heparin-binding EGF, and the 4 neuregulins. The neuregulins are ligands for the HER3 and HER4 dimers. (B) Ligand binding triggers the homodimerization and heterodimerization of the receptors. Whereas EGFR inhibition blocks only EGFR-mediated signal transduction, inhibition of EGFR and HER2 blocks signal transduction from all NSCLC-related homodimers and heterodimers.Abbreviation: EGFR =epidermal growth factor receptor.Note: Reprinted with permission from the copyright holder ? CIG Media Group, L.P.圖1 ErbB信號的協同作用和所有EGFR抑制劑對比EGFR/HER2抑制劑的不同活性A:EGFR(ErbB1)、HER2(ErbB1)、HER3(ErbB3)、HER4(ErbB4)基因編碼4個ErbB受體。有11個生長因子可結合于這些受體,包括:EGF、轉化生長因子-α、雙調蛋白、纖維素、epigen、表皮調節蛋白、肝素結合EGF和4個神經調節蛋白。神經調節蛋白為HER3和HER4二聚體的配體。B:配體結合可觸發受體的同源二聚化和異源二聚化。盡管EGFR抑制劑僅可阻斷EGFR介導的信號傳導,但抑制EGFR和HER2可阻斷所有來自NSCLC相關的同源二聚體和異源二聚體的信號傳導。縮寫:EGFR=表皮生長因子受體。注:本圖得到版權所有者?CIG Media Group, L.P.復制許可
現有治療的局限性、NSCLC的高發病率和晚期肺癌患者的高死亡率促使人們探尋新型藥物。HER2為ErbB受體家族的另一成員,對EGFR和HER2具有抑制作用的化合物是一類處于臨床研發階段的針對晚期NSCLC患者新型藥物。在此,我們將對采用EGFR/HER2抑制劑作為抗癌藥物的科學原理進行綜述,并將對用于治療NSCLC患者的這些藥物的臨床研發做一概述。
非小細胞肺癌中ErbB/ HER受體的作用
從結構上來看,表皮生長因子受體是4個HER家族相關受體之一。HER家族的每一成員均由胞外生長因子結合區、單一跨膜區、胞內TK區和含有可能發生磷酸化的酪氨酸殘基的胞質尾區組成(圖1)。然而,HER2無已知配體,HER3無激酶活性。這些受體通過一系列復雜的第二信使起作用,可影響各種細胞功能,包括凋亡、遷移、生長、粘附和分化。現有多種刺激性配體,包括EGF、轉化生長因子(transforming growth factor,TGF)-α和神經調節蛋白,這些刺激性配體對不同的HER家族成員呈現不同的特性(圖1)[11]。同源配體和受體的類型和數量決定著受體激活引發的生物反應。
NSCLC細胞的信號傳導有賴于多種HER家族成員的共表達與協同作用。配體結合所觸發的受體同源二聚化和異源二聚化是EGFR/HER信號傳導的必經步驟。二聚化可觸發受體內在TK活性的活化,繼而可引起各種第二信使的募集。HER家族成員間的相互作用可影響配體結合后生物反應的類型和持續時間。
禽流紅細胞增多癥病毒的產物v-ErbB致癌基因是EGFR衍生的有活性的變異體,這一發現首次證實EGFR和其它HER家族受體與癌癥相關[12]。EGFR通路的過度活化可引起各種人類惡性腫瘤的發生和進展。有研究表明EGFR突變具有致癌性:L858R和G719S的替代突變、外顯子19的缺失突變和外顯子20的插入突變可引起配體依賴性細胞轉化[13]。編碼TK區的外顯子21中的L858R活化突變是最常見的NSCLC突變。EGFR活化與腫瘤細胞增殖和侵襲的增多及凋亡和化療耐受相關[14]。EGFR的過表達亦見于大多數實體瘤中,包括NSCLC。這是重度吸煙者支氣管上皮所見的早期異常之一,且幾乎見于所有鱗癌及≥65%的大細胞癌和腺癌中[15]。
盡管較EGFR過表達少見,但HER2過表達亦見于NSCLC中,而且相比其它NSCLC類型(如鱗癌或大細胞癌),在腺癌中更為多見[16]。在NSCLC患者中,EGFR與HER2的共過表達與臨床預后不良相關[17]。
EGFR/HER2抑制劑的原理
EGFR/HER2抑制劑作為抗癌治療的科學原理源于EGFR與HER2各種分子間的相互作用,EGFR與HER2可調節HER家族信號傳導通路,并使之多樣化。EGFR與HER2共表達可使EGFR的有絲分裂信號被放大[18]。HER家族成員間的相互作用可影響配體與受體的親和力,并可促進受體活化。例如,人類上皮細胞系統中HER2的擴增可導致HER2的組成性活化及EGFR的配體依賴性激活[19]。在這些研究中,HER2的擴增對EGFR信號具有長久的刺激作用,其發生經由減少EGFR的下調、降低溶酶體靶向作用、促進活化的EGFR再循環至細胞表面以及降低配體與EGFR的解離。EGFR與HER2間的上述各種相互作用導致生物信號協同作用。
EGFR與HER2間的協同作用在NSCLC的發生和進展中起關鍵作用。一系列臨床前研究表明,EGFR與HER2基因具有使細胞轉化為惡性表型的能力[20]。更重要的是,EGFR與HER2基因呈現協同轉化潛能[21]。高度同步的EGFR與HER2的mRNA共表達與I-IIIA期NSCLC患者的不良預后相關[17],隨后這一現象在蛋白水平得以證實[22]。有假說認為同步的過表達使EGFR與HER2異源二聚化,從而導致腫瘤生長加快以及OS與無進展生存期(progression-free survival, PFS)縮短。其它研究顯示,NSCLC的轉移潛能與EGFR/HER2的共表達相關[23]。值得注意的是,在EGFR陽性(采用免疫組化或熒光原位雜交進行檢測)的腫瘤中,HER2基因拷貝數的增多與對吉非替尼的敏感性相關,且臨床療效優于這兩種受體均為陰性的腫瘤患者。這些資料為同步靶向作用于這兩種受體提供了更深層次的理由[24]。
人們已開發出兩種類型的EGFR/HER2 TKI:與TK區ATP結合位點可逆性結合的藥物和與TK區ATP結合位點非可逆性(共價鍵)結合的藥物。非可逆性EGFR/HER2 TKI可抑制含激活突變及其它對可逆性EGFR/HER2 TKI厄洛替尼和吉非替尼耐藥突變的NSCLC細胞的活性[25]。非可逆性TKI克服可逆性TKI耐藥突變的活性很可能歸因于這些藥物與EGFR TK區的共價結合[26,27]。此外,與可逆性EGFR抑制劑相比,在細胞培養模型中非可逆性EGFR抑制劑的耐藥性似乎較為罕見,這意味著非可逆性抑制劑可能在預防和克服耐藥中均具有臨床價值[25]。
在臨床前研究中,非可逆性EGFR/HER2 TKI BIBW 2992和HKI-272(neratinib)及非可逆性EGFR抑制劑HKI-357,可干擾EGFR的自身磷酸化,并抑制對厄洛替尼和吉非替尼耐受的NSCLC細胞的生長,包括含有獲得性EGFR T790M耐受突變的細胞和以T790M非依賴性耐受機制為特征的細胞,T790M非依賴性耐受機制包括受體運輸的改變[25,28]。BIBW 2992可抑制野生型HER2和野生型及突變型EGFR的離體TK活性,包括對厄洛替尼耐受的各種EGFR亞型。此外,BIBW 2992可抑制完整細胞中EGFR和HER2的自身磷酸化[28]。在體外,對厄洛替尼或吉非替尼獲得性耐藥且明確為EGFR L858R/T790M雙重突變的NSCLC患者中,BIBW 2992的有效性約為厄洛替尼的上百倍。最近的報道顯示,BIBW 2992對新的二次突變T854A有效,此突變與對可逆性EGFR TKI的獲得性耐藥相關。可逆性EGFR/HER2 TKI BMS-599626高度選擇性地抑制依賴于EGFR/HER2的腫瘤細胞的增殖,而且受體的免疫共沉淀研究顯示,這一藥物可抑制經由EGFR/HER2異源二聚化的信號[29]。在采用12個EGFR突變(代表5種突變類型)進行肺癌細胞系和BaF3細胞轉化的研究中,HKI-272在抑制含外顯子18和20突變的細胞方面較厄洛替尼更有效。相反,厄洛替尼在抑制主要為外顯子19缺失突變的細胞方面較HKI-272有效[30]。根據后者的結果,有假說認為通過基于特定突變選擇最適宜的藥物可能會優化EGFR TKI的預期臨床反應。BIBW 2992和HKI-272對含有HER2突變776 insV且對厄洛替尼耐受的NSCLC細胞系均有效[28,31]。
非可逆性EGFR/HER2抑制劑在體內亦有效。在長時間表達2種人類EGFR突變后會發生肺腺癌的雙轉基因小鼠中,HKI-272具有強大的腫瘤抑制作用[32]。相似的是,在EGFR L585R/T790M或HER2過表達誘發的異種移植模型及EGFR L585R/T790M誘發的對厄洛替尼耐受的鼠科動物肺癌模型中,BIBW 2992具有強大的腫瘤抑制作用[28]。H1975 NSCLC腫瘤含有EGFR L585R/T790M突變且對厄洛替尼和吉非替尼耐受,非可逆性EGFR/HER2抑制劑AV-412可干擾H1975 NSCLC腫瘤的生長,并抑制EGFR和HER2過表達的腫瘤的生長[33]。AV-412以產生抗腫瘤效應的濃度可抑制EGFR和HER2的自身磷酸化。
臨床試驗
目前,數個EGFR/HER2抑制劑處于NSCLC臨床研發的不同階段(表1)。已有的臨床數據顯示,此類藥物通常是安全的且耐受性好,毒性譜與其它EGFR抑制劑一致。在晚期惡性腫瘤患者的早期試驗中,采用各種EGFR/HER2抑制劑后會出現疾病穩定(stable disease,SD),有時SD延長[34-37]。
可逆性酪氨酸激酶抑制劑
在采用可逆性TKI拉帕替尼治療乳腺癌中,EGFR/HER2抑制劑的臨床價值得到證實。美國食品與藥品監督管理局批準該藥與卡培他濱聯用以治療HER2過表達的晚期或轉移性乳腺癌患者。然而,由于拉帕替尼在一項II期試驗中未達到主要終點,因此對其不再進行NSCLC單一療法的臨床研發[38]。
非可逆性酪氨酸激酶抑制劑
在BIBW 2992治療一系列實體瘤患者(n=26)的一項I期試驗中,初步實驗結果顯示肺腺癌女性患者中有2例達部分緩解(partial responses, PRs),其中1例含有復合雜合子EGFR突變[39]。BIBW 2992用于治療EGFR突變陽性且未接受過化療或曾接受1次化療的晚期肺腺癌患者的單臂II期試驗(LUX Lung 2)的中期結果最近得以報道。在接受二線治療的67例可評估的患者中,43例達PS(64%; 95%CI: 52%-76%),疾病控制率(disease control rate, DCR)為96%(95%CI: 87%-99%),中位PFS為10.2個月(95%CI: 7.5-17.7)[40]。在可評估有效性的38例未接受過化療的患者中,RR為63%,DCR為97%[41]。在曾接受化療失敗的NSCLC患者的一項探索性II期研究中,3例含有HER2突變的患者采用BIBW 2992治療后均達客觀有效,HER2突變大約見于2%-4%的腺癌患者中[42]。在BIBW 2992的臨床試驗中最常發生的不良事件(adverse events,AEs)為皮膚毒性和腹瀉[39-41]。當前,IIB/III期LUX Lung-1試驗正在評估BIBW 2992克服可逆性EGFR抑制劑獲得性耐藥的潛能(圖2)[43,44]。旨在評估BIBW 2992vs順鉑/培美曲塞作為含有EGFR突變的腺癌患者的一線治療療效的一項隨機III期試驗(LUX Lung 3)已于2009年8月開始進行[45]。
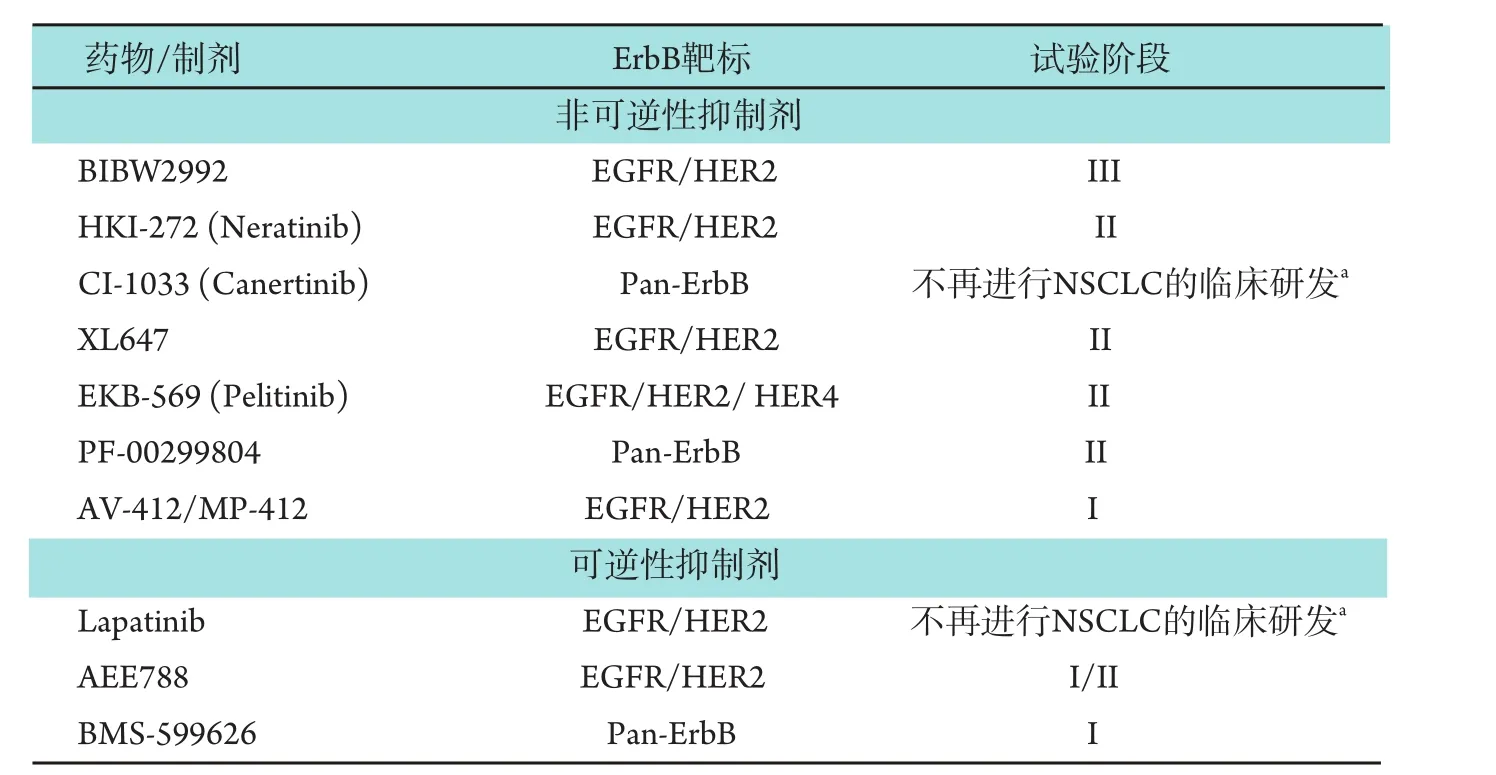
表1 處于NSCLC臨床研發中的EGFR/HER2抑制劑
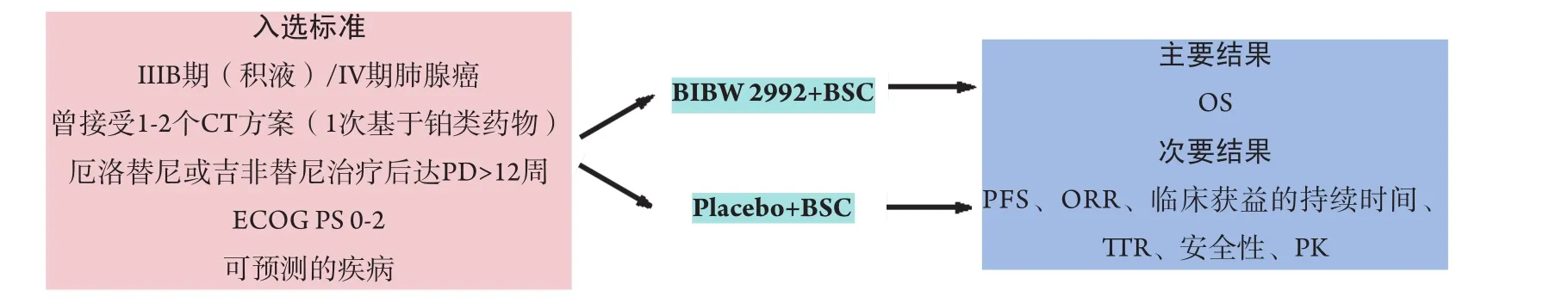
Fig 2 The Phase IIB/III LUX Lung-1 Trial Design[34]Abbreviations: BSC=best supportive care; CT=chemotherapy; ECOG=Eastern Cooperative Oncology Group; ORR=overall response rate; OS=overall survival;PD=progressive disease; PFS=progression-free survival; PK=pharmacokinetics; PS=performance status; TTR=time to recurrence.Note: Reprinted with permission from the copyright holder ? CIG Media Group, L.P.圖2 BLUX Lung-1 IIB/III期試驗設計[34]縮寫:BSC=最佳支持治療;CT=化療;ECOG=東部腫瘤協作組;ORR=總有效率;OS=總生存期;PD=疾病進展;PFS=無進展生存期;PK=藥代動力學;PS=體力狀態;TTR=再發時間。注:本圖得到版權所有者?CIG Media Group, L.P.復制許可
在有關HKI-272的一項I期試驗中,16例曾接受厄洛替尼或吉非替尼治療且表達EGFR或HER2的NSCLC患者中42%達SD[46]。有一項II期試驗,在NSCLC患者的3個亞組中對HKI-272進行評估,這3個亞組分為:曾接受吉非替尼或厄洛替尼治療失敗且含有EGFR突變的患者(n=91);突變陰性的患者(n=48);未曾接受EGFR TKI治療的患者(n=28)。3組間有效率、SD率和PFS無明顯不同(RR,2%-4%;SD率, 39%-47%;中位PFS,7.4-11.6周)[47]。在HKI-272的臨床試驗中,腹瀉為最常見的AE[46,47]。
PF-00299804為非可逆性pan-HER(對EGFR、HER2和HER4具有活性)TKI,在PF-00299804的一項I期研究中,2例達PR,在29例可評估的晚期NSCLC中,8例達SD[48]。一項II期試驗正在評估PF-00299804對曾接受1-2個化療方案和厄洛替尼治療失敗的晚期NSCLC患者(KRAS為野生型)的療效。在36例可評估的患者的初步分析中,3例達PR,臨床獲益率(CR+PR+SD超過2個周期,比如6周)為67%。含有T790M突變的患者的SD延長[49]。PF-00299804最常見的AE為皮膚疾病和胃腸疾病[48,49]。
在日本患者中進行的有關非可逆性EGFR/HER2抑制劑EKB-569(pelitinib)的一項I期試驗中,含有EGFR突變并對吉非替尼獲得性耐藥的2例NSCLC患者均出現放射反應。最常見的AE為腹瀉、皮疹、厭食和皮膚干燥[37]。目前,一項有關EKB-569治療晚期NSCLC患者的II期研究正在進行中。
總結
ErbB靶向藥物批準用于NSCLC和其它惡性腫瘤,這表明此受體家族是抗癌治療的有效靶標。第一代EGFR TKI為晚期NSCLC患者帶來顯著的臨床獲益,但療效有限。克服這些局限性的最重要的改進策略是干擾HER家族成員間的協同作用,它們之間的相互作用對其生物活性至關重要。目前,非可逆性EGR/HER2抑制劑正在臨床研發中,可能有助于預防和克服第一代EGFR抑制劑的獲得性耐藥。有關這些藥物的在研III期隨機臨床試驗結果值得我們翹首以待。
Acknowledgments
This work was supported by Boehringer-Ingelheim Pharmaceu-ticals, Inc. Writing and editorial assistance was provided by Johna-than Maher, PhD, of BlueSpark Healthcare Communications, and was contracted by Boehringer-Ingelheim Pharmaceuticals, Inc. Dr. Govindan meets the criteria for authorship as recommended by the International Committee of Medical Journal Editors (ICMJE), was fully responsible for all content and editorial decisions, and was involved in all stages of manuscript development. Dr. Govindan received no compensation related to the development of this article.
Disclosures
Ramaswamy Govindan has served as a paid consultant or been on the Advisory Board of AstraZeneca; Avantis Medical Systems, Inc.; Bristol-Myers Squibb Company, Boehringer Ingelheim GmbH; and Eli Lilly and Company, and is a member of the Speaker’s Bureau of Eli Lilly and Company and Genentech, Inc.

