惡性胸腺腫瘤的診斷與治療進展
王敬慧 張樹才
作者單位:101149 北京,北京胸科醫院腫瘤內科(通訊作者:張樹才,E-mail: zhangshucai6304@yahoo.com.cn)
胸腺腫瘤包括來源于胸腺上皮細胞的腫瘤-胸腺瘤和胸腺癌,來源于胸腺淋巴細胞的霍奇金淋巴瘤及其它淋巴瘤,來源于胸腺內分泌細胞的腫瘤-胸腺類癌、燕麥細胞癌等;此外還包括生殖細胞腫瘤、胸腺脂肪瘤、胸腺囊腫、轉移癌等。胸腺腫瘤中90%為胸腺瘤,其余是胸腺癌、淋巴瘤及類癌等。胸腺瘤在全部成人惡性腫瘤中不足1%,在成人前縱隔腫瘤中約占30%。據美國國家癌癥研究所報告,美國胸腺瘤的發病率為0.15/10萬[1],我國尚無相關數據報告。胸腺瘤和胸腺癌的好發年齡為50歲-60歲,中位年齡為56歲,男性發病率高于女性,兒童罕見。胸腺腫瘤的病因尚不明確,有些學者證實部分患者既往有放射治療、EB病毒感染史。下面將就兩種主要的胸腺腫瘤—胸腺瘤和胸腺癌的診斷與治療等方面的研究進展做一綜述。
1 病理
WHO胸腺瘤病理分類法是Rosai領導的專家組于1999年公布的,后于2004年得到修改,是目前應用最廣泛的胸腺腫瘤病理分類系統。根據腫瘤上皮細胞形態將胸腺瘤分為A型、B型、AB型,A型由梭形腫瘤上皮細胞組成,B型由圓形上皮樣細胞組成,具有二者混合表現的為AB型。按照淋巴細胞的比例將B型分為B1型、B2型和B3型3個亞型,B1型富含淋巴細胞,有少量上皮細胞;B2型的淋巴細胞與上皮細胞比例接近;B3型以上皮細胞為主,淋巴細胞稀少。胸腺瘤除了上述分類外,還有幾種罕見腫瘤無法歸納至以上標準分類中,包括小結節型胸腺瘤、化生型胸腺瘤、硬化型分類法胸腺瘤等。1999年分類法把胸腺癌定義為C型,2004年刪除了胸腺瘤中C型類別,將胸腺癌另列為一類,胸腺癌表現為明顯的惡性腫瘤細胞學特征,有多種組織學類型,包括低度和高度惡性腫瘤,低度惡性胸腺癌包括鱗狀細胞癌、粘液表皮樣癌和基底細胞癌等,高度惡性胸腺癌包括淋巴上皮瘤樣癌、小細胞癌、肉瘤樣癌、透明細胞癌、未分化腫瘤等。
A型胸腺瘤占5%-24%,患者就診時年齡大,中位年齡約為61歲,24%合并重癥肌無力,絕大多數患者為I期。A型和AB型的生物學行為與良性疾病相似,AB型占11%-43%。B型常合并重癥肌無力和其它免疫疾病,B1型惡性程度略高于A型、AB型,低于B2型、B3型,是低度惡性腫瘤,占8%-38%。B2型胸腺瘤的惡性程度高于B1型,低于B3型,占4%-46%。B3型以往被定義為分化好的胸腺癌,常無包膜,侵犯縱隔脂肪及鄰近器官,預后差,占6%-34%。胸腺癌和其它器官惡性腫瘤相似,復發率高,生存期短,預后最差[2]。A型、AB型、B1型、B2型、B3型腫瘤的侵襲性分別為10%-40%、30%-40%、45%-50%、65%-70%、85%-90%,B1型、B2型、B3型侵襲性高,多為III期或IV期疾病[3]。
2 臨床表現
1/3胸腺惡性腫瘤患者表現為無癥狀的前縱隔腫物,多在影像學檢查時發現;1/3表現為局部癥狀,如:咳嗽、呼吸困難、胸痛、咯血、吞咽困難、聲音嘶啞、上腔靜脈壓迫綜合征、膈神經麻痹等;還有1/3患者表現為副瘤綜合征,最多見的為重癥肌無力,約30%-50%胸腺瘤患者伴重癥肌無力,而單純性紅細胞再生障礙、低丙種球蛋白血癥、紅斑狼瘡等約占28%。就診時胸腺瘤患者出現轉移并不常見,最常見的轉移部位是胸膜,胸腔外轉移不到10%,轉移部位有腎、淋巴結、肝、腦、腎上腺、甲狀腺、骨。與胸腺瘤不同,胸腺癌侵襲性強,就診時轉移常見,轉移部位有骨、肺、肝、胸膜和淋巴結,極少伴有副瘤綜合征[4]。
3 影像學檢查
近80%胸腺瘤患者在正位胸片上表現為縱隔輪廓異常或腫物。胸部增強CT是診斷前縱隔腫物的首選影像檢查方法,CT不僅能顯示病變大小、密度、邊緣,而且能提示病變與胸腔內周圍器官包括大血管、肺、心包、心臟、胸膜等的關系,腫塊內鈣化、出血、壞死常提示腫瘤侵襲性高。MRI對評價病變是否侵犯血管更有優勢。Sadohara等[5]回顧性分析了胸腺腫瘤的CT與MRI的表現,在CT和MRI影像上,與低危(A型、AB型、B1型)和高危(B2型、B3型)胸腺瘤相比,胸腺癌多表現為不規則輪廓、壞死或囊變、不均勻強化、淋巴結腫大及大血管受侵。MRI影像上,與高危胸腺瘤和胸腺癌相比,包膜完整、分隔、均勻強化在低危胸腺瘤更常見,MRI在顯示包膜、分隔或瘤內出血方面優于CT。
盡管探討正電子發射計算機斷層掃描(positron emission tomography, PET)對胸腺腫瘤診斷價值的研究多是小樣本的,但多數研究顯示PET能夠區分胸腺增生和胸腺瘤,也可區分胸腺瘤和胸腺癌,胸腺癌的標準吸收值明顯高于胸腺瘤。PET攝取值與WHO分類相關,但不能鑒別侵襲或非侵襲性胸腺瘤,也不能鑒別胸腺瘤和淋巴瘤[6,7]。Inoue等[8]對46例胸腺腫瘤進行了PET檢查,結果顯示,高危腫瘤的早期和延遲SUV值(分別為6.0、7.4)均顯著高于低危腫瘤(分別為3.2、3.4)。早期SUV值>4.5支持高危腫瘤,以SUV值4.5為截斷值,診斷的敏感性、特異性和準確性分別為78.3%、91.3%、84.8%,早期SUV值>7.1,可區分胸腺癌與其它類型胸腺瘤。
4 診斷
前縱隔腫物的常見病因包括胸腺瘤、淋巴瘤、甲狀旁腺或甲狀腺腫瘤、生殖細胞腫瘤、結締組織腫瘤及良性腫瘤等。通過血α甲胎蛋白、β人絨毛膜促性腺激素等標志物可鑒別生殖細胞腫瘤和胸腺瘤。臨床上,多數情況下需要對淋巴瘤和胸腺瘤進行鑒別,但這兩種疾病鑒別起來較為困難。一般來說,胸腺瘤患者年齡更大,合并相關免疫異常提示為胸腺瘤;淋巴瘤患者多表現盜汗、發熱、消瘦和不適等癥狀,體檢時應仔細檢查淺表淋巴結,腫塊伴周圍淋巴結腫大在淋巴瘤多見,可行淋巴結活檢確診。
當發現前縱隔腫物且懷疑是淋巴瘤或胸腺瘤時,應行活檢以明確診斷。創傷最小的是CT引導下細針抽吸活檢(fine needle aspiration, FNA),但這種方法只能提供細胞學標本,難以明確胸腺腫瘤的組織學分型,更不能鑒別胸腺瘤和淋巴瘤,因此,FNA一般不用于胸腺腫瘤的診斷。CT引導下芯針活檢是確診縱隔腫物的首選方法,它能獲取足夠的組織進行組織學及免疫組化檢查,從而做出準確診斷,尤其是可鑒別胸腺瘤和淋巴瘤,也比較安全。如果不能進行芯針活檢或未確診時,可考慮行縱隔切開術或電視輔助胸腔鏡手術(video-assisted thoracic surgery, VATS)活檢。
Yonemori等[9]回顧性分析了CT引導下經皮穿刺對138例前縱隔腫瘤的結果,評價其對胸腺上皮腫瘤的診斷價值,敏感性和特異性分別為91.7%和100%,陽性預測值100%,陰性預測值94.0%,總準確率96.4%,經皮穿刺和手術在WHO分類方面的診斷總符合率為79.4%,結果令人滿意。另有幾項研究報告經皮穿刺的敏感性在44%-83%之間。
5 分期
目前采用最廣泛的胸腺腫瘤分期方法是Masaoka于1981年制定的Masaoka分期法,后于1994年得到修改。修改后的胸腺瘤Masaoka分期系統的定義是:I期:腫瘤局限在胸腺內,肉眼及鏡下均無包膜浸潤;II期:IIa期:鏡下有包膜浸潤,IIb期:肉眼可見周圍脂肪組織浸潤,但局限于縱隔胸膜內;III期:侵犯周圍器官,IIIa期不侵犯大血管,IIIb期侵犯大血管;IV期:IVa期:胸膜或心包浸潤,IVb期:淋巴或血行轉移。I期為非侵襲性胸腺瘤,II期及以上為侵襲性胸腺瘤。
6 治療
手術、放療和化療是胸腺腫瘤主要的3種治療方法,胸腺癌的治療與胸腺瘤相似。
6.1 手術 手術是治療胸腺腫瘤的基石,是最有效的治療方法,所有可能切除的病例均應得到專業團隊的仔細評估。對于可切除的前縱隔胸腺瘤,應立即行手術切除。外科切除至少有10種不同的方式,如:經頸部、經胸骨、VATS及聯合術式等,但是由于缺乏前瞻性研究結果尚不能證實哪種方式更好。手術第一步應仔細檢查縱隔和胸膜腔,肉眼評估有無包膜受侵、腫瘤周圍和胸膜受侵程度及周圍組織是否受累,注意仔細探查縱隔胸膜,尤其是后橫膈竇處有無轉移。切除范圍包括全部胸腺和周圍縱隔脂肪,手術完全切除是治愈最重要的因素。近來研究[10]報告手術死亡率不超過2%。
I期患者手術切除率為95%-100%,II期疾病切除也較為容易,完全切除率為85%-100%,其中分類為B2型、B3型和胸腺癌的患者復發率高。III期患者完全切除率為65%-80%,即使術后接受放療,將近50%患者5年內會復發,復發多在胸膜或肺內,極少擴散至胸腔外。單純手術不是IVa期胸腺瘤患者的最有效治療,完全切除率僅為30%-40%。近年來的擴大手術范圍治療及多學科治療模式明顯提高了IVa期患者的生存率,目前資料顯示IVa期患者的5年生存率為40%-78%[11]。一項大樣本的回顧性研究[12]發現,切除不完全的胸腺癌患者未能從手術獲益。
6.2 放療 胸腺瘤對放療敏感,放療在胸腺瘤治療中起著重要作用,包括術后輔助治療、局部晚期、不可切除及復發疾病等的治療。
I期胸腺瘤完全切除后復發率極低(0.9%),術后無需放療。II期胸腺瘤有肉眼包膜、縱隔周圍脂肪侵犯,或胸膜粘連,術后復發危險增加,II期5年生存率為98%,復發率為4%。對于II期患者術后是否行常規放療曾存在爭議,迄今為止,越來越多的研究[13-16]證實完全切除的II期胸腺瘤患者不會從放療中獲益。而III期、IV期胸腺瘤及胸腺癌術后復發率高(28%, 34%),術后應行放療以控制局部復發。
腫瘤分期是決定術后是否放療的主要依據,但還應考慮腫瘤的WHO類型。對于手術邊緣不足夠大的I期胸腺瘤不推薦放療,但如果為B3型,則應行放療。對于II期患者,B型患者的復發率高于A型,B2型、B3型和胸腺癌即使無胸膜的鏡下侵犯,也會從輔助放療中受益[17,18],這些患者放療和不放療的縱隔復發率分別為0%、36.4%。Utsumi等[19]回顧性分析了324例完全切除的胸腺瘤患者預后,單純手術切除后的A型、AB型、B1型患者不需放療,B2型、B3型患者的最佳治療策略尚需探索。如果病灶緊貼鄰近器官,建議行放療以降低局部復發風險。對于切除不完全的II期、III期患者應行術后放療,控制病灶,降低復發率。
僅有幾項小型的研究評價了新輔助放療的作用,證實新輔助放療可使病灶縮小,腫瘤分期降低,從而提高完全切除率,尤其是對局部晚期患者,但尚無數據顯示這種方法對患者長期生存期的影響,因此,新輔助放療的作用仍存在爭議。
一般來說,術后胸腺瘤放療的推薦劑量為45 Gy-55 Gy。對于術后殘存病灶,劑量可達60 Gy。目前推薦的放療方法有:三維適形放療或調強放療,臨床靶區包括整個胸腺體積、腫瘤部位、前、上、中縱隔(放療量至50 Gy-55 Gy時縮野),不推薦預防性鎖骨上淋巴結放療。胸腺腫瘤放療的副反應包括急性心包炎、肺炎,晚期副反應有冠脈疾病及肺纖維化[11],近來研究[20]報告3度-4度的放療毒副反應發生率為5%-10%。胸腺癌的放療劑量尚無一致的結論,多數研究采用的放療劑量在40 Gy-70 Gy,1.8 Gy/次-2.0 Gy/次。
術后胸膜腔復發是最常見的,因此僅行縱隔放療不全面。為減少胸膜復發,有研究在縱隔放療基礎上加整個單側胸腔放療(劑量15 Gy),5年無復發率和生存率分別為100%、96%,顯著高于僅行縱隔放療患者(74%,66%)(P=0.03),但15%-25%患者出現2度或以上的放射性肺炎,肺毒性明顯增加,單側胸腔放療可能無法成為常規[21,22]。
6.3 化療 化療可用于晚期胸腺腫瘤的姑息治療、新輔助化療及復發疾病的治療等。在與放療聯合時,順序為序貫化放療,以免增加治療的毒副反應。
胸腺瘤對化療相對敏感,目前胸腺腫瘤的標準方案是以順鉑、蒽環類為基礎的聯合方案,有PAC、ADOC、PE、VIP等,但哪種化療方案最佳尚未明確。表1、表2介紹了胸腺腫瘤的幾種化療方案。
6.4 綜合治療 綜合治療包括化療、放療、手術3種方法中2種或3種的聯合。臨床實踐證實,對于不可切除疾病,放化療聯合優于單一治療,對殘存疾病或切除不完全的疾病也應考慮多學科綜合治療。對于局部晚期患者,尤其是III期患者,術前化療后行手術、術后行放療或化療是可行的,多學科治療能夠提高III期或IVa期胸腺瘤患者的手術切除率和生存期。Venuta等[33]實施的一項前瞻性新輔助化療的臨床試驗結果顯示多學科治療可提高III期患者的遠期生存率,降低復發率。新輔助化療的推薦方案為含順鉑的聯合方案,術前治療已成為局部晚期患者治療方案中重要的組成部分。一項多中心II期研究[34]正在評價新輔助同步化放療后手術對III期或IVa期胸腺腫瘤患者的治療效果。
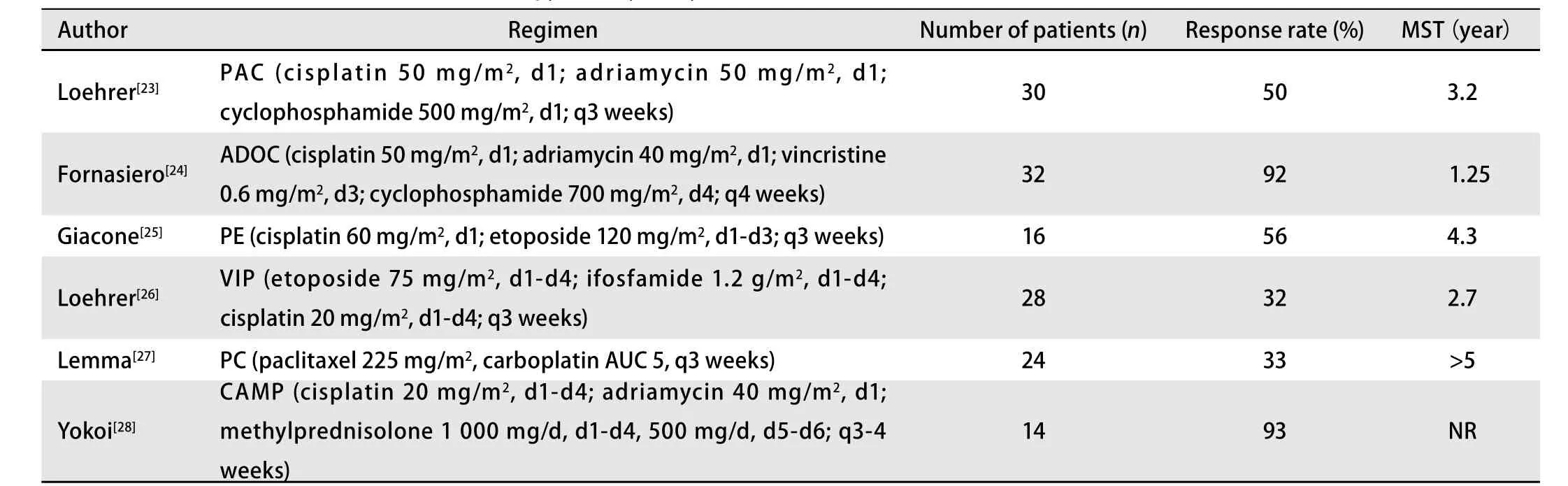
表 1 幾項胸腺瘤化療的試驗結果Tab 1 Results of several trials about chemotherapy efficacy in thymoma
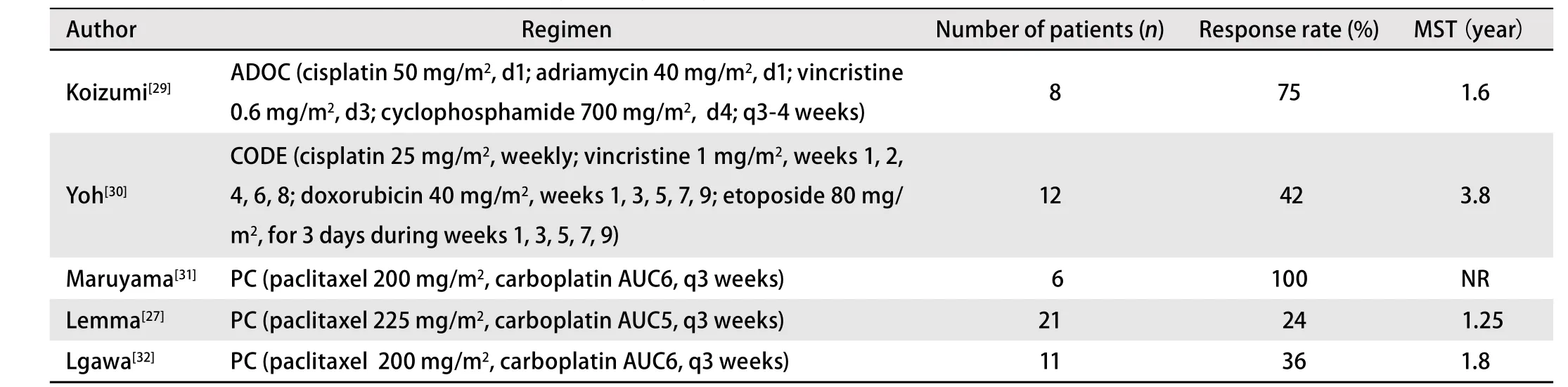
表 2 幾項胸腺癌化療的試驗結果Tab 2 Results of several trials about chemotherapy efficacy in thymic carcinoma
6.5 靶向治療 當前,腫瘤的靶向治療及其靶點的研究是全球的熱點,非小細胞肺癌、乳腺癌、結腸癌等腫瘤的靶向治療已取得了較好的臨床療效,同時與靶向治療相關的生物預測因素也日益明確。近來一些研究[35-39]報告了胸腺腫瘤EGFR及c-KIT的表達及突變情況,胸腺瘤多表達EGFR而幾乎不表達c-Kit,EGFR表達率為71%-94%;胸腺癌則相反,EGFR表達率低于胸腺瘤,為33.3%-67%,c-Kit表達率高,為53%-88%,胸腺瘤和胸腺癌EGFR和Kit的突變罕見。
Kurup等[40]采用吉非替尼治療26例既往接受過治療的胸腺腫瘤患者(19例轉移性胸腺瘤,7例胸腺癌),250 mg/d,1例部分緩解(partial response, PR),14例疾病進展(progressive disease, PD),故作者認為吉非替尼對胸腺腫瘤無效。另一項Bedano等[41]報告的II期研究采用厄洛替尼聯合貝伐珠單抗治療18例復發的胸腺瘤和胸腺癌,厄洛替尼150 mg/d,貝伐珠單抗15 mg/kg,每3周重復,11例疾病穩定(stable disease, SD)(60%),7例PD(40%),厄洛替尼聯合貝伐單抗對胸腺腫瘤的療效也是有限的。Palmieri等[42]報告西妥昔單抗治療2例胸腺瘤的個案報告,2例均獲得PR,免疫組化檢測EGFR均為陽性。Giaccone等[43]采用伊馬替尼600 mg/d治療7例胸腺腫瘤患者(B3型2例,胸腺癌5例),結果顯示,2例SD,5例PD,中位進展時間為2個月,中位生存期4個月,標本檢測未發現c-KIT突變。Bisagni[44]報告1例經多線化療的晚期胸腺癌患者接受索拉非尼治療獲得PR,標本經PCR測序顯示c-KIT外顯子17突變。Strobel等[45]報告有KIT強表達及KIT外顯子11基因活性突變的1例胸腺癌患者持續6個月對伊馬替尼有效。
盡管胸腺腫瘤存在EGFR和c-KIT過度表達,但已有的臨床試驗結果表明靶向治療的療效令人失望,胸腺腫瘤的靶向治療及預測因素等還需進一步探索。
7 復發疾病的治療
胸腺瘤最常見的復發部位是胸腔,其次是縱隔。對于復發的胸腺瘤患者,手術仍然是主要的治療方法。50%-75%的復發疾病患者仍可以手術,其中62%(45%-71%)可行完全切除。復發后行完全切除患者的生存期能夠得到延長,5年生存率近72%,不完全切除的患者僅為0-25%[11]。對于不能手術的患者,放療是有效的治療方法,有研究報告接受放療患者的5年生存率為80%。復發患者也可行化療,一項評價培美曲塞治療復發胸腺瘤或胸腺癌的II期研究中,共16例復發胸腺瘤和11例胸腺癌入組,在可評價的23例患者中,2例完全緩解(complete response, CR),2例PR,均為IVa期胸腺瘤,胸腺瘤患者的中位進展時間是45.4周,胸腺癌患者是5.1周,表明培美曲塞對復發胸腺瘤有一定的療效[46]。Loehrer等[47]采用奧曲肽治療奧曲肽掃描陽性的不可切除或晚期胸腺瘤或胸腺癌患者,在可評價的38例患者中,31例曾接受過化療,結果顯示,2例CR,10例PR,2年生存率為76%,6例胸腺癌或類癌患者無PR。另外文獻報告紫杉醇、多西紫杉醇、吉西他濱對復發惡性胸腺腫瘤也有一定的效果[48-50]。
8 預后因素
多種因素能夠預測胸腺瘤患者的預后。多項研究證實Masaoka分期是胸腺瘤最重要的預后因素。完全切除患者的生存期與分期密切相關,I期、II期、III期、IV期的5年生存率分別為90%-100%、75%-90%、50%-70%、30%-40%,I期、II期、III期、IV期的10年生存率分別為85%-95%、70%-85%、25%-60%、0-15%[3]。完全切除是另一個預后因素,完全切除的III期、IV期患者的復發率較未完全切除的復發率低。WHO分類也是手術切除后患者獨立的預后因素,從A型到C型(胸腺癌),預后越來越差。大樣本研究及meta分析[51,52]均證實,A型、AB型、B1型生存率高于B2型和B3型,有明顯差異,A型、AB型、B1型、B2型、B3型的5年生存率分別為100%、93%、89%、82%、71%,A型、AB型、B1型、B2型、B3型的10年生存率分別為95%、90%、85%、71%、40%,胸腺癌5年生存率約為20%-30%[3]。Okumura[53]對273例胸腺瘤的研究顯示,A型、AB型、B1型、B2型、B3型患者的20年生存率分別為100%、87%、91%、59%、36%。腫瘤大小也是可靠的預后因素,一項對馬薩諸塞州總醫院179例患者的回顧性分析表明,病灶≥8 cm患者的復發率顯著增加(分別為1.8%、28%),這些患者更多為III期或IV期,多為B1型而不是A型或AB型。大血管受侵也是獨立的預后不良因素。此外,伴重癥肌無力患者的預后優于不伴肌無力的患者,這可能與合并肌無力患者能更早地就診有關,而且大多數研究顯示,合并重癥肌無力的大部分患者是I期、II期。單純性紅細胞再生障礙(5%-10%)可能影響治療的完成,尤其是對化療影響較大。早期復發(<40個月)也是預后不良因素[2]。
9 小結
盡管胸腺腫瘤發展相對緩慢,但仍是一種具有侵襲性的疾病。I期、II期胸腺瘤應行手術切除,部分II期患者可從術后放療獲益。多學科綜合治療在III期、IVa期胸腺腫瘤中起重要作用。現有的多種化療方案中大多數包括順鉑和蒽環類藥物。靶向治療尚無令人滿意的療效。今后應針對胸腺腫瘤開展多中心前瞻性臨床研究,探索更有效的治療方法。

